原花青素对2型糖尿病大鼠坐骨神经传导速度的影响
刘行海,买文丽,郑 倩,刘 华,敬华娥,陈大斌
(川北医学院 1.生理学教研室;2.寄生虫学教研室,四川 南充 637100)
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病(diabetes mellitus,DM)常见的慢性并发症之一,严重影响患者的健康与生活质量[1]。原花青素(proanthocyanidins,PC)是植物中广泛存在的一大类多酚化合物的总称。药理研究表明原花青素具有明显的抗氧化、抗肿瘤、保护心血管等活性作用,临床主要用于心肌缺血、心绞痛、脑梗塞等的辅助治疗[2]。研究发现,氧自由基可通过脂质过氧化等机制参与DM及其慢性并发症的发生、发展[3-4]。原花青素作为强氧自由基清除剂,是否对DPN具有治疗作用?本实验采用高脂饲料加小剂量链脲佐菌素(STZ)复制2型糖尿病大鼠模型,并以PC进行干预,检测大鼠坐骨神经传导速度、血清SOD活性及丙二醛(MDA)含量,探讨PC对DPN的保护作用。
1 材料与方法
1.1 主要材料与动物
原花青素,纯度95%,购自南京泽朗植提技术有限公司,用蒸馏水配成悬液;链脲菌素(STZ)、戊巴比妥钠购自sigma公司;超氧化物歧化酶(SOD)与丙二醛(MDA)测试盒购自南京建成生物工程公司,胰岛素放射免疫检测试剂盒购自北京北方生物技术研究所。快速血糖测定仪及试纸(三诺SXT-1型,长沙),神经肌电诱发电位仪(ND-400,上海海神)。3月龄雄性Wistar大鼠,一级,体质量为(195±16) g。动物合格证号:SCXK(川)2004-15。高能饲料[5]:60%常规饲料,20%蔗糖,15%猪油,5%胆固醇。常规饲料:57%碳水化合物,22%蛋白质,6%脂肪,8%纤维素,7%其它成分。动物及饲料均由四川省医学科学院实验动物研究所提供。
1.2 动物模型建立与分组
T2DM大鼠模型建立参照本实验室既往方法[6]。自由进食饮水,适应性饲养1周后,按体质量随机分为对照组(A)8只和实验组18只。实验组高能饲料喂养4周,空腹12 h后一次性腹腔注射链脲菌素25 mg/kg(注射前用pH=4.2的枸橼酸缓冲液配成1%浓度)。A组注射等量的柠檬酸缓冲液,实验组继续高能饲料喂养4周后,采尾静脉血测定空腹血糖(FBG)、血清胰岛素(FINS),计算胰岛素敏感指数(ISI),以FBG≥7.8 mmol/L作为2型糖尿病模型判断标准[7]。将成功造模的16只大鼠随机分为两组:糖尿病组(B)、PC治疗组(C)。C组:每日上午PC150 mg/kg灌胃;A组与B组:每次灌胃等量蒸馏水。动物治疗期间,自由饮水,全部大鼠常规饲料饲养于川北医学院动物实验中心。
1.3 坐骨神经传导速度测定
药物治疗8周后,以1%戊巴比妥钠35 mg/kg腹腔注射麻醉动物后,俯卧位固定于操作平板上。严格控制室温(20±5)℃,保持肢体温度在37 ℃左右。用ND-400多导联神经肌电诱发电位仪检测坐骨神经传导速度。刺激针电极插入左坐骨切迹,记录针电极插入踝关节处坐骨神经经过部位,参考电极插于记录电极与刺激电极之间,距离记录针电极1 cm处。采用单脉冲方波刺激,波宽0.2 ms,强度1.0倍阈值,每两个刺激之间间隔5 s及以上。记录刺激开始到肌肉出现诱发电位的时间,测定刺激电极到记录电极之间的距离,计算运动神经传导速度。
1.4 生化及放免检测
实验结束时心脏取血,快速血糖测定仪测定FBG;采用751分光光度计测定SOD和MDA;放射免疫分析法测定FINS。同时摘取各组大鼠坐骨神经于10%中性甲醛溶液中,固定24 h后常规石蜡包埋,按病理学常规制片HE染色。
1.5 统计学分析
2 结果
2.1 一般情况观察
与A组大鼠比较,B组大鼠出现明显的多饮,多尿,多食的症状,活动减少,毛发晦暗,B组中因感染死亡一只;与B组大鼠比较,C组症状体征均有所好转。
2.2 各组大鼠FBG和坐骨神经传导速度的比较
与A组比较,B组FBG升高(P<0.01),而C组低于B组(P<0.01)。与A组比较,B组的坐骨神经传导速度减慢(P<0.01),而C组的传导速度快于B组(P<0.01)。结果见表1。

表1 各组大鼠血糖和神经传导速度的变化
*P<0.01,与A组比较;△P<0.01,与B组比较。
2.3 各组大鼠血清SOD活性和MDA含量比较
与A组相比,B组大鼠坐骨神经SOD明显降低(P<0.01),MDA含量明显升高(P<0.01)。C组大鼠坐骨神经组织SOD活性较B组明显升高(P<0.01),MDA水平较明显下降(P<0.01)。结果见表2。
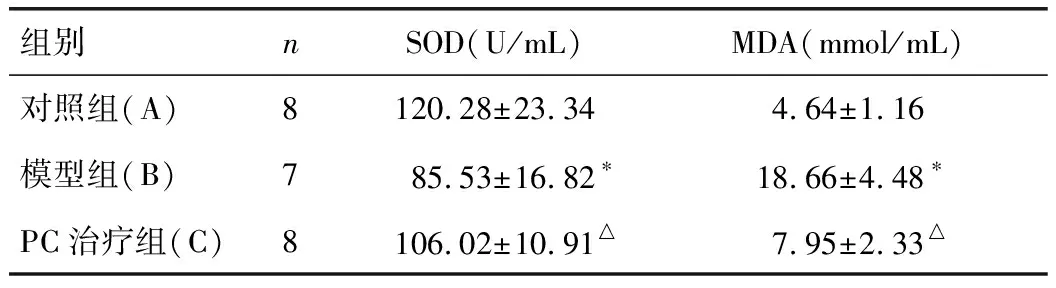
表2 各组SOD活性和MDA含量比较
*P<0.01,与A组比较;△P<0.01,与B组比较。
2.4 各组大鼠血清胰岛素水平和胰岛素敏感指数比较
与A组比较,B组大鼠FINS水平显著升高(P<0.01),ISI显著降低(P<0.05);与B组比较,C组大鼠FINS水平显著降低(P<0.01),ISI显著升高(P<0.05)。

表3 药物治疗对实验大鼠血清FINS、ISI的影响
*P<0.01,与A组比较;#P<0.05,△P<0.01,与B组比较。
2.5 坐骨神经HE染色
与A组相比较,B组大鼠坐骨神经有纤维排列紊乱、松散和断裂的病理改变;C组大鼠坐骨神经病理改变较B组轻。
3 讨论
近年来,2型糖尿病发病呈快速上升趋势,而DPN在糖尿病并发症中又具有发病早、发病率高的特点。有研究表明以下机制参与了DPN发生和发展:血糖升高;脂质代谢紊乱;过氧化物产生过多;抗氧化能力的下降;氧自由基通过与细胞膜不饱和脂肪酸发生脂质过氧化反应[8]。
MDA为脂质过氧化代谢产物,它的变化可间接地反映出细胞损伤的程度;SOD是体内主要的抗氧化酶,其变化反应了机体的抗氧化能力。本实验参照以往造模方法,成功复制与2型糖尿病病理状况相符的大鼠模型,实验结果显示模型B组大鼠有相对稳定的高血糖,胰岛素抵抗以及多食多饮多尿等症状和体征。B组大鼠血清SOD活性降低,MDA明显高于正常A组,提示2型糖尿病大鼠脂质过氧化反应增强,抗自由基损伤能力降低,与文献报道一致[9]。
检测DPN较为敏感的指标是坐骨神经传导速度降低,因此检测大鼠坐骨神经传导速度可合理地判断DPN的治疗效果[10]。实验结果显示C组大鼠坐骨神经传导速度增快,坐骨神经病理学改变较B组轻,说明原花青素对T2DM大鼠周围神经病变具有一定的保护作用。原花青素具有很强的抗氧化活性,是一种很好的氧自由基清除剂和脂质过氧化抑制剂。经原花青素治疗8周后,C组与B组相比,血清中SOD活性升高,MDA含量明显降低。并且治疗后的C组大鼠虽血糖仍比A组大鼠高,但和未治疗的B组大鼠相比有统计学意义。本研究结果说明原花青素能够改善2型糖尿病大鼠血糖水平和提高机体抗氧化能力,这可能是原花青素影响DPN发展的机制之一。
综上所述,本研究提示原花青素对T2DM大鼠周围神经病变具有一定的保护作用,其机制可能与其抗氧化作用和降低血糖有关,至于原花青素使用的最佳时机及浓度等有待进一步研究。
【参考文献】
[1]蔡 洁,董继宏.糖尿病性周围神经病变常用评分量表比较与研究[J].中华临床医师杂志电子版,2009,3(1):e12-17.
[2]李皓霎,段俊丽,王一尘.原花青素的功能与研究进展[J].国际老年医学杂志,2013,34(2):73-76.
[3]杨 波,张 钧.氧自由基脂质过氧化反应致运动性疲劳产生的机制研究[J].中国临床康复,2005,9(4):188-190.
[4]徐 波,雷少青,刘慧敏,等.糖尿病鼠早期心脏抗氧化能力及心功能改变与脂质过氧化反应的关系[J].武汉大学学报(医学版),2010,31(1):16-18,99.
[5]郭啸华,刘志红,李 恒,等.实验性2型糖尿病大鼠模型的建立[J].肾脏病与透析肾移植杂志,2000,9(4):351-355.
[6]刘 红,罗 蕾,高 原.2型糖尿病大鼠近球小管Na+,K+-ATPase活性变化[J].第三军医大学学报,2006,28(20):2062-2064.
[7]Guo XH,Liu ZH,Li H,et al.Establishment of a rat model with type 2 diabetes mellitus[J].Chinese Journal of Nephrology,Dialysis & Transplantaion,2000,9(4):351-355.
[8]番寿蕊,杨红英.醛糖还原酶与糖尿病慢性并发症病变关系的研究进展[J].检验医学与临床,2010,7(1):75-77.
[9]梁佳琦,朱翠风,李艳飞.大豆异黄酮与葡萄籽原青花素对2型糖尿病大鼠抗氧化功能的影响[J].Chinese General Practice,2008,11(6):948-950.
[10]刘立新,刘好文,刘力强.实验性2型糖尿病大鼠模型及其周围神经病变特点[J].脑与神经疾病杂志,2005,13(2):117-119.

