3.0T磁共振波谱成像结合T2WI对前列腺癌与前列腺增生的鉴别诊断价值
刘兴华,曾文兵,汪明全,温 云,王怀武
(重庆三峡中心医院放射科,重庆 万州 404000)
前列腺癌(prostate cancer,PCa)与前列腺增生(benign prostatic hyperplasia,BPH)均为老年男性常患疾病,两者的治疗和预后完全不同。PCa的治疗和预后取决于早期诊断和分期,因此在临床工作中对PCa和BPH的鉴别诊断尤为重要。磁共振成像(resonance imaging,MRI)已成为PCa诊断和分期最有效的影像手段[1-2]。MRI常规序列及磁共振波谱成像(magnetic resonance spectrocopy,MRS)能够分别从形态和功能方面对前列腺病变进行评价。本研究拟通过对病理证实的PCa和BPH的MRS和常规T2WI表现进行对照分析,探讨两者相互结合在PCa和BPH鉴别诊断中的价值。
1 材料与方法
1.1 一般资料
搜集2013年9月至2014年3月经穿刺活检证实的49例前列腺疾病患者的完整临床资料,其中PCa22例,BPH27例。所有患者均行MRI常规序列及MRS检查,检查前均未行穿刺活检及任何治疗。穿刺活检时间不超过MRI检查后1个月。
1.1.1 经直肠超声引导下系统穿刺活检 根据前列腺大小和临床需要先常规系统活检6~12针,并对重点怀疑部位行靶穿刺2~5针,并记录穿刺部位。
1.1.2 分区方法 将前列腺分为左右两侧,从上到下分为基底部、中部和尖部,共6个分区。根据穿刺结果,将病变纳入相应分区。
1.1.3 临床资料 PCa组年龄56~89岁,平均(73.2±8.6)岁,主诉排尿困难、血尿、血精等症状,17例直肠指检触及质硬结节,tPSA1.53~102.6 ng/mL,平均(53.2±10.5) ng/mL。BPH组年龄57~89岁,平均(72.8±8.7)岁,主诉尿频、排尿困难,直肠指诊触及前列腺增大,tPSA 2.6~20.8 ng/mL,平均(6.5±3.4) ng/mL。
1.2 MRI及MRS检查
1.2.1 硬件设备及检查前准备 应用SIMENS 3.0T Verio超导型磁共振成像系统。以体线圈为射频发射线圈,以腹部相控阵线圈为接受线圈,患者检查前1 d进少渣饮食,晚间口服缓泻剂,以保证检查时直肠内清洁,检查前排尽膀胱尿液。
1.2.2 常规MRI检查序列 TSE轴位T1WI(TR/TE 530 ms/12 ms,层厚/层距4 mm/0.8 mm,NEX2,ETL3,FOV20,矩阵250×250);TSE轴位T2WI及抑脂T2WI(TR/TE 4 000 ms/108ms,层厚/层距4 mm/0.8 mm,NEX2,ETL25,FOV22,矩阵384×269);矢状位抑脂T2WI(TR/TE 3 850 ms/89 ms,层厚/层距3 mm/0.6 mm,NEX3,ETL4,FOV38,矩阵256×192)。扫描范围包全前列腺及精囊腺。
1.2.3 3DMRS 扫描采用3D多体素波谱成像的方法,以前列腺专用空间定域采用点分辨波谱(PRESS)序列,枸橼酸盐(Citrate,Cit)、胆碱(Choline,Cho)、肌酸(Creatine,Cre)波峰经过耦合效应校正,TR750 ms,TE145 ms,扫描时间约9.54 min,采集次数6。3D矩形兴趣区平面内的范围和上下界应尽量包括全部前列腺组织而尽量少包括前列腺周围脂肪和直肠内气体。在兴趣区边缘加八条饱和带,以消除矩形兴趣区内前列腺周围脂肪、前列腺后方直肠内气体和呼吸伪影的影响。采集MRS数据前进行常规自动预扫描,包括自动匀场和抑水。
1.3 MRI常规序列观察和MRS数据分析
1.3.1 MRI常规序列 主要观察T2WI序列,测量前列腺的大小、观察前列腺形态、有无病变,病变位置及信号特点;前列腺包膜是否完整,周围脂肪间隙及血管神经束有无受累,是否侵犯膀胱、精囊腺及直肠;盆腔淋巴结及骨盆有无转移等。
1.3.2 MRS数据采集与分析 参照穿刺活检标记的取材位置及病理结果选择相应的体素,观察各体素Cho、Cre、Cit波峰形态,分别计算相应体素的(Cho+Cre)/Cit比值。所选体素未受到水和脂肪信号的污染,主要代谢物波谱的信噪比>5。
1.4 统计学分析
2 结果
2.1 MRI常规T2WI表现
22例PCa患者中18例T2WI序列有典型的肿瘤征象,其中14例表现为外周带结节状或斑片状低信号影,边界欠清,另4例外周带、中央腺同时受累。18例中膀胱受累4例,精囊腺受累12例,直肠受累4例,盆腔淋巴结转移8例,骨盆转移11例。有4例未见明显前列腺癌征象。
27例BPH患者T2WI序列均有典型的增生征象,主要为前列腺体积增大,以中央腺增大明显,信号均匀或不均匀,不均匀者其内可见结节状低信号或囊状高信号,边缘清楚,外周带受压变薄,前列腺包膜完整。
2.2 MRS形态表现及数据分析
2.2.1 MRS形态 3D多体素波谱图,每个体素观察3个主峰:Cit、Cho、Cre的共振峰分别位于2.62 ppm、3.25 ppm、3.05 ppm,部分Cho峰与Cre峰重叠,不易分离,呈共峰显示。PCa患者MRS形态表现为Cit峰明显降低甚至消失,Cho显著升高,两者波峰可呈现倒置(图1A-C)。BPH患者MRS形态表现为Cit峰高耸,Cho峰及Cre峰相对较低(图2A-C)。

2.2.2 MRS数据分析 参照经直肠超声引导下穿刺活检的病理结果选取体素,两组数据经K-S检验均符合正态分布特点;PCa组(Cho+Cre)/Cit平均值明显高于BPH组,差异具有统计学意义(表1)。
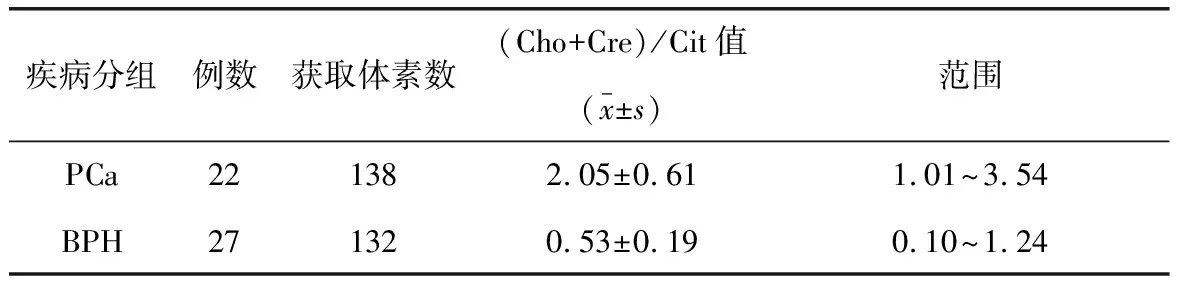
表1 PCa组与BPH组代谢物浓度(Cho+Cre)/Cit比值比较
注:Cho:胆碱;Cre:肌酸;Cit:枸椽酸盐。PCa组与BPH组(Cho+Cre)/Cit值比较,(t=-27.241,P<0.05)。
3 讨论
3.1 MRS与T2WI、临床常规检查的优势对比
PCa是欧美国家老年男性最常见的恶性肿瘤之一,其死亡率仅次于肺癌,居第二位[3]。近年来随着人口的老龄化及生活方式的改变,PCa在我国的发病率有明显增高趋势。临床诊断前列腺病变的常规检查手段有PSA、直肠指检、经直肠超声、经直肠超声引导下穿刺活检,但都有其局限性。PSA敏感性较高,但特异性较差;直肠指检及经直肠超声均有操作者依赖性;经直肠超声引导下穿刺活检常作为诊断前列腺病变的金标准,但属有创检查,容易遗漏较小的病灶。
MRI检查以其无创、软组织分辨率高的优点已成为临床最受欢迎的影像学检查手段之一。MRI常规检查特别是T2WI序列能准确地将前列腺进行解剖分区,清楚地显示PCa外周带内的低信号,并能评价肿瘤对周围组织有无侵犯及有无远处转移等。但外周带T2低信号同样可见于出血、炎症、瘢痕、萎缩、放疗后、冷冻术后及激素治疗后,并且MRI常规序列对中央腺体内的肿瘤诊断仍较困难,因此常规序列对PCa的诊断价值有限。国内沈钧康等[4]将MRI功能成像序列联合T2WI对PCa进行筛查,具有较高的临床价值。
MRS属于MR功能成像,能够提供活体组织的生化代谢信息,应用于多种肿瘤包括PCa的生物标记,Kurhanewicz等[5]在1996年将MRS应用于前列腺的检查中,近年来其在PCa的诊断中应用越来越广泛。
早期前列腺MRS检查多采用直肠内线圈(ERC)作为信号接收线圈,其高信噪比和小FOV虽然可提供高分辨率图像,但也有一定局限性,如作为表面线圈造成的磁场不均匀使得前列腺各部信噪比出现差异[6],且易受ERC伪影的影响[7-8],ERC检查相对繁琐,而且ERC检查有较多禁忌症[9],故其应用受到一定限制。本研究用3.0T超高场MRI体线圈代替直肠内线圈,与1.5TMRI比较,3.0TMRI空间分辨率及时间分辨率更高,用体线圈患者检查舒适度增加,易于接受。据李新民等[10]研究报道体线圈与直肠内线圈的MRS对PCa定性诊断效能接近,临床应用具有可行性。
3.2 前列腺增生、前列腺癌的病理基础及代谢特点
PCa系前列腺上皮来源或间叶来源的肿瘤,大多数发生于腺体外周带或后叶的腺泡腺管上皮,病理类型以腺癌为主,其次为移行细胞癌,极少数为鳞状细胞癌。前列腺增生结节主要发生于移行带和尿道周围腺体区。早期尿道周围腺体区的结节完全为间质成分,而早期移行带的结节主要表现为腺体组织的增生,并有间质数量的相对减少。
正常和增生的前列腺组织可分泌Cit,其腺管有浓缩Cit的能力,因此Cit含量较高[11],而PCa由于正常腺体功能破坏,Cit生成减少,腺管对精液的浓缩功能丧失,Cit浓度亦降低。Cho与细胞膜的合成与降解有关。前列腺癌组织的细胞增殖速度快,细胞膜合成与降解活跃,因此Cho较正常组织含量高,而Cre的浓度在PCa与正常前列腺组织中含量无明显差异。
3.3 MRS结合T2WI对前列腺癌和前列腺增生诊断的临床价值
鉴于PCa和BPH的病理基础及代谢特点,可运用MRS对PCa行定性和半定量分析,定性分析为粗略评价谱线中Cit与Cho+Cre峰的相对高低,而半定量分析为计算Cit与Cho+Cre峰值的峰下面积比值。目前应用最广、最有价值的标准化比值为(Cho+Cre)/Cit。周良平等[12]报道增生的前列腺组织(Cho+Cre)/Cit比值约0.62±0.19,而PCa的比值约2.13±0.82,本研究PCa组(Cho+Cre)/Cit的值为2.05±0.61,BPH组(Cho+Cre)/Cit的值约0.53±0.19,与上述报道基本一致,提示MRS对PCa及BPH的鉴别诊断有较高的特异性。
常规T2WI序列对PCa的诊断具有较高的敏感性。本研究中有18例在T2WI序列中有典型的前列腺癌的影像学征象,但有4例未见确切肿瘤征象,分析原因可能为:(1)通常外周带PCa表现为T2信号减低,但部分可表现为等信号。(2)起源于移行带的PCa增加了MRI诊断的难度,因为中央腺信号不均匀。支持移行带肿瘤的表现:移行带均匀T2低信号、低信号结节边界不清楚,但低信号亦可出现在前纤维基质及BPH间质增生[13]。
本研究的不足之处为样本量偏小,没有评价PCa的(Cho+Cre)/Cit比值与Gleason评分的相关性,病理结果均为穿刺结果,可能会有部分阳性患者漏诊为阴性,对结果产生一定影响。
综上所述,T2WI与MRS相互结合,能够提高PCa与BPH鉴别诊断的准确性,具有较高的临床应用价值。随着MRS与术后前列腺标本逐层大病理切片对照研究的开展,会使PCa的MRS结果与病理改变间的相关性更加准确[14]。
【参考文献】
[1]李春媚,陈 敏,李飒英,等.前列腺癌MRI动态增强扫描定量分析及其应用[J].中华放射杂志,2011,45(5):508-510.
[2]史 浩,武乐斌,丁红宇,等.MR动态增强、扩散加权和波谱分析在前列腺癌诊断中的价值[J].中华放射学杂志,2006,40(7):678-683.
[3]Bonekamp D,Jacobs MA,El-Khouli R,et al.Advancements in MR Imaging of the Prostate:From Diagnosis to Interventions[J].RadioGraphics,2011,31(3):677-703.
[4]沈钧康,赵文露,杨 毅,等.1.5T功能成像序列联合T2WI对前列腺癌筛查的临床价值[J].中华放射杂志,2014,48(1):38-42.
[5]Kurhanewicz J,Vigneron DB,Hricak H,et al.Three-dimensional H-1 MR spectroscopy of the in situ human prostate with high(0.24~0.7 cm3)spatial resolution[J].Radiology,1996,198(3):795-805.
[6]陈雅青,毛丽娟,王道虎,等.正常成人前列腺的体线圈3T多体素1H-MRS[J].中国医学计算机成像杂志,2008,14(2):119-123.
[7]Kaji Y,Wada A,Imaoka I,et al.Proton two-dimensional chemical shift imaging for evaluation of prostate cancer:external surface coil vs.endorectal surface coil[J].J Magn Reson Imaging,2002,16(6):697-706.
[8]李新民,王霄英,郭雪梅,等.前列腺癌的MR波谱成像中体线圈与直肠内线圈的比较[J].中华放射学杂志,2009,43(11):1165-1169.
[9]陈 敏,欧阳汉,全冠民,等.体部磁共振诊断学[M].福建:福建科学技术出版社,2010:460.
[10]周良平,王霄英,丁建平,等.正常前列腺、前列腺癌和良性前列腺增生的MR波谱成像代谢特征并与病理结果对照[J].中华放射学杂志,2005,39(1):50-53.
[11]Hricak H,Choyke PL,Eberhardt SC,et al.Imaging prostate cancer:a multidisciplinary perspective[J].Radiology,2007,243(1):28-53.
[12]汪 剑,陆建平,张 晶.不同线圈接收信号的三维前列腺MR波谱[J].中国医学计算机成像杂志,2008,14(2):124-129.
[13]Kaji Y,Kuroda K,Maeda T.Anatomical and metabolic assessment of prostate using a 3-Tesla MR scanner with a custom-made external transceive coil:healthy volunleer study[J].J Magn Reson Imaging,2007,25(3):517-526.
[14]赵 阳,徐 勇,韩 悦,等.MR波谱成像对前列腺癌分化程度预估价值的初步研究[J].中华放射学杂志,2011,45(10):951-954.

