脊柱术后急性感染的治疗策略探讨
魏军渔
手术部位感染(surgical site infection,SSI)是脊柱术后常见的并发症之一,它是指无置入物手术30 d内和有内置物(如椎弓根螺钉、椎体间融合器、人工椎间盘等)手术后1年内发生的与手术相关感染。急性感染指手术后30 d内发生的手术部位感染。患者出现术后感染,不仅延长了治疗时程,增加了治疗费用,而且严重影响患者的临床治疗效果。针对术后急性感染,有效的治疗方法可以在一定程度上缩短治疗周期,减低治疗费用,改善患者治疗效果。本文总结分析了2006年1月~2011年1月期间通过清创开放引流,持续封闭负压引流术(vacuum sealing drainage,VSD)治疗及抗生素治疗治愈的42例脊柱术后急性感染患者,对治疗效果进行评估,从而为脊柱术后急性感染的临床治疗提供参考。
1 资料和方法
1.1 一般资料
2006年1月~2011年1月脊柱手术后发生急性感染患者42例,男性22例,女性20例;年龄为28~79岁,平均53岁。手术持续时间115~260 min,平均170 min,术前30 min常规使用1剂抗生素(头孢唑啉 0.5 g,对于头孢类药物过敏患者使用克林霉素0.6 g),对于手术时间>3 h,出血量>1.5 L的手术,术中追加1剂抗生素。37例患者术前血常规、血沉、C-反应蛋白(C-reaction protein,CRP)等各项指标在正常范围内,5例患者CRP稍高(10~15 mg/L)。
1.2 临床表现
42例感染患者中38例患者存在切口部位疼痛症状,疼痛逐渐加重,且使用塞来昔布对症处理效果不佳; 25例患者体温>38.5 ℃,12例患者体温为37.5~38.5 ℃;5例患者体温为37.0~37.5 ℃。37例存在切口部位红肿,并有局部皮温升高,其中35例患者切口部位渗出;相对于术前水平,42例患者术后血沉、CRP、白细胞计数、中性粒细胞绝对数与比例不同程度升高,血沉30~95 mm/h,平均52 mm/h,CRP 19~87 mg/L,平均48.6 mg/L,白细胞计数12×109~28×109/L,平均18.3×109/L,中性粒细胞比例55%~87%,部分患者MRI T2加权像提示手术部位组织高信号。
1.3 病原菌分布
42例患者中31例切口分泌物微生物培养结果阳性,12例患者为多种微生物混合感染,其中9例患者检测出2种不同病原菌,3例患者检测出3种不同病原菌。耐甲氧西林金黄色葡萄球菌(methicillin resistant staphylococcus au-reus,MRSA)感染6例。
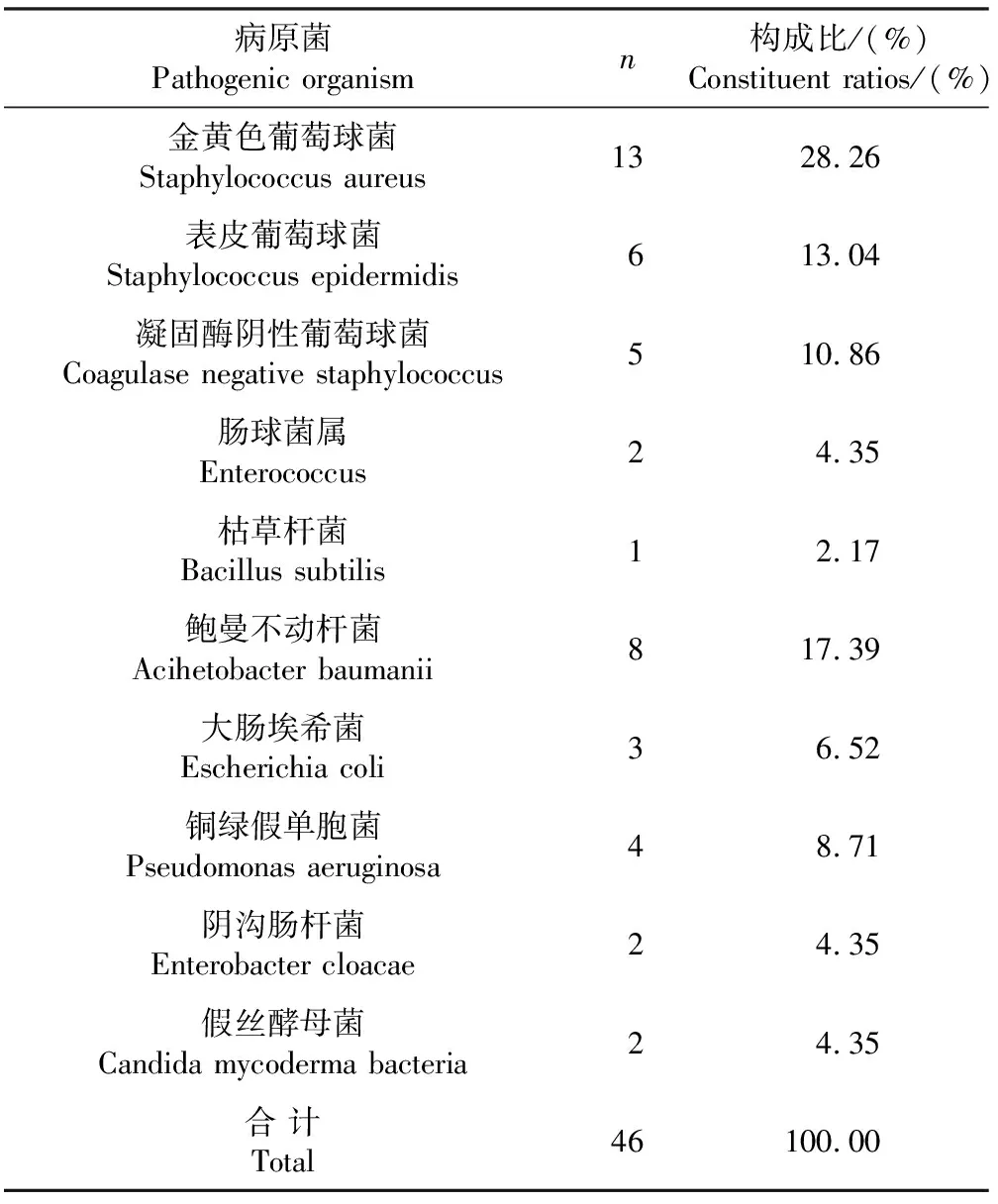
表1 感染患者组织培养病原菌分布构成比Tab.1 Constituent ratios of organisms cultured from postoperative infections
1.4 治疗方法
1.4.1 抗生素治疗
16例患者单纯予抗生素治疗,在脊柱术后手术部位感染中,病原菌以革兰阳性菌为主,通常予静脉注射喹诺酮类抗生素联合利福平治疗,待病原菌培养及药敏结果回报后调整抗生素,定期监测血常规、血沉、CRP以指导临床治疗,抗生素疗程4~6周,若CRP仍高,改口服抗生素至CRP下降至正常水平1个月以后。抗生素治疗过程中若各项指标无下降趋势,创面仍红肿,持续渗出,则进行外科处理。
1.4.2 清创开放引流及持续VSD
患者出现创口持续渗液、红肿、疼痛进行性加剧等表现,结合血液学检查提示感染后,应积极行清创术,术中取分泌物标本进行病原菌培养及药敏试验,彻底清理切口内的脓液、脓苔及坏死组织,3%过氧化氢溶液和10%聚维酮碘溶液及大量生理盐水反复冲洗切口,有椎体间植骨融合者反复冲洗其椎间隙。42例感染患者中给予14例患者持续VSD处理,7 d后拆除或更换VSD装置(术中取材再次进行组织病原菌培养),至创面清洁无引流物,拆除VSD装置,缝合切口,留置负压引流管1根,术后2 d拔除。12例患者予清创,术中发现感染范围相对表浅,局限于皮下浅筋膜,清理脓液,切除坏死组织,反复冲洗,缩小创面,通畅引流,每日换药2~3次,保持开放创面敷料干燥,引流通畅。上述患者同时给予抗生素治疗。
1.5 疗效评估
痊愈:患者局部疼痛等临床症状明显改善,体温恢复正常,手术区域无红肿、无皮温升高,无局部压痛,无渗液,各项化验指标血常规中白细胞计数和中性粒细胞数量正常,血沉、CRP恢复正常,细菌培养结果阴性。未愈:相关治疗后,未达到上述结果。
2 结 果
2.1 术后随访
42例均得到随访,随访时间24~36个月,平均30个月。
2.2 治疗效果
42例患者中,16例患者单纯予抗生素治疗,1例患者术后6个月感染再发,予清创及持续VSD后痊愈。12例患者给予清创开放引流换药处理,14例患者予清创持续VSD处理,取得痊愈,均未拆除内置物,无患者死亡,患者住院时间12~73 d,平均26 d。
3 讨 论
3.1 感染病原菌
脊柱手术部位感染临床上时有发生,而对于感染病原菌分布不同学者报道不同。Fang等[1]学者报道的48例脊柱术后感染患者,致病菌包括金黄色葡萄球菌(42%),表皮葡萄球菌(29%),肠球菌(17%),大肠杆菌(6%),铜绿假单胞菌(6%),肠杆菌(5%),链球菌(3%)等,其中25%~50%的患者为多种微生物混合感染。Osenbach等[2]报道255例脊柱术后感染病例中,金黄色葡萄球菌比例高达48%,革兰阴性菌和链球菌属分别占23%和9%。本组报道中革兰阳性菌占58.70%(27/46),金葡菌检出率最高,占28.26%(13/46),其中6例为MRSA,表皮葡萄球菌、凝固酶阴性葡萄球菌比例也较高,革兰阴性菌占36.96%(17/46),其中鲍曼不动杆菌比例最高达17.39%(8/46),且病原菌培养结果阳性患者中38.71%(12/31)的患者为多种微生物混合感染,总之,脊柱术后感染的病原菌以革兰氏阳性菌为主,其次为革兰阴性菌,且有相当部分的患者为混合感染。
3.2 临床表现
脊柱术后急性感染,患者主要有以下临床表现:①疼痛,感染早期表现,随着感染程度加重疼痛症状加重,对常规对症治疗效果不佳。②发热,体温常超过38.5℃,本组感染患者中,部分患者体温无明显升高,同样有学者报道,并不是每例感染患者都存在发热,常常不伴发热[3]。③手术部位组织红肿,皮温升高。④切口渗出。⑤局部压痛,肌肉痉挛或无力。⑥血液学检查,白细胞总数、中性粒细胞计数及比例,血沉,CRP升高,提示存在感染可能。一般情况下,CRP术后2~3 d达到最大值,2~3周内恢复正常,血沉术后5 d左右达到最大值,3~6周内逐渐恢复正常。术后3 d CRP及术后5 d血沉开始下降,若反而升高则应该警惕术后手术部位感染可能,当然,血沉、CRP在正常范围内也可以帮助我们排除术后感染可能[4-5]。 血沉,CRP术后出现升高的趋势提示感染的可能比术后某次测量数值升高更有临床意义,而且有学者认为,针对脊柱术后感染,血沉、CRP比白细胞总数更有诊断价值[6]。⑦影像学检查,早期X线片通常检查出内置物松动,椎间高度迅速丢失,软组织异常肿胀等感染的间接征象,而CT对于确定内固定位置及骨组织改变方面优于X线片,CT也可以检查出脓肿、血肿等包块,但敏感度不如MRI,MRI在诊断手术部位感染方面优势明显,患者MRI检查手术部位组织在T2加权像上多呈高信号,增强像信号强化。当然,MRI在区别无菌血肿及脓肿方面存在一定不足[7-9]。
3.3 感染的治疗
由于后果严重,一旦怀疑切口部位感染,必须进行积极的干预措施,组织病原菌培养及药敏试验,同时根据经验用药,待检查结果回报后,调整抗生素,并监测血沉、CRP、白细胞计数等指标,定期进行病原菌培养及药敏试验。对于切口局部红肿,少量或无明显渗出的患者,可多单纯给予抗生素治疗,若治疗效果不佳(各项指标无下降趋势,创口持续渗液、红肿、疼痛进行性加剧等),及时采取外科处理。本组抗生素使用4~6周,CRP仍高的,改口服抗生素至CRP下降至正常水平1个月以后,以防止感染复发,但是对于是否需要长期口服抗生素,各位学者意见不一,Kowalski等[10]认为对于术后急性感染,保留内置物情况下,长期口服抗生素治疗相比未进行此项治疗的患者彻底治愈的可能更大(80%vs. 33%),而有些学者研究认为抗生素治疗6~8周是必要的,而不必要常规进行长期口服抗生素治疗手术部位感染[11]。
如果感染范围表浅,程度较轻,未累及脊柱内固定装置,运用浅表清创联合冲洗,开放引流可以达到良好的临床疗效。本组12例患者经此方法治疗,效果良好,对于范围广泛,坏死组织较多,累及深部组织的感染采取清创及持续VSD治疗。多数学者一致认为,持续VSD是促进创面愈合,根治复杂脊柱术后感染的有效方法[12-13],Argenta等[14]和Venturi等[15]同样认为持续负压吸引可以减轻局部组织水肿,增加局部血流灌注,减少细菌定植,利于肉芽组织生长。本组14例采用上述方法均获得了痊愈。此外文献报道,持续VSD对于手术部位多种微生物混合感染,MRSA治疗效果较好[7,16],当然封闭持续负压吸引装置可能导致严重的并发症,如严重出血,难以控制的菌血症等,因此对使用VSD治疗的患者应密切监测生命体征[17]。
对于脊柱手术部位感染发生后,置入物保留与否的问题,一直存在争议,拆除内置物,减少细菌附着,增加了根治感染的可能,但会导致内固定不充分,稳定性下降,造成椎间高度和/或脊柱纠正角度丢失等问题,甚至需要再次手术,笔者认为对于手术部位急性感染,在及时诊治,感染得到较好控制的情况下,可保留内置物。Ahmed等[18]回顾分析了854例脊柱手术患者,术中均有内置物置入,其中17例发生术后感染,积极进行清创联合抗生素应用等治疗,在保留内置物情况下,所有感染患者均获治愈,平均随访2.1年,无患者感染再发。Falavigna等[19]回顾性研究了260例脊柱手术患者,其中8例发生术后感染,经过静脉注射抗生素及口服抗生素,创口冲洗等治疗,在未拆除内固定情况下,8例患者的感染全部得到治愈。
脊柱手术部位急性感染在脊柱外科手术中无法完全避免,早期的诊断和及时、合理的处理是治疗的关键,了解病原菌分布规律,指导经验用药,根据药敏结果及时调整用药,积极的外科处理,内置物可得以保留,并且远期效果良好。
参考文献
[1] Fang A,Hu SS,Endres N,et al. Risk factors for infection after spinal surgery[J]. Spine (Phila Pa 1976),2005,30(12):1460-1465.
[2] Osenbach RK,Hitchon PW,Menezes AH. Diagnosis and management of pyogenic vertebral osteomyelitis in adults[J]. Surg Neurol,1990,33(4):266-275.
[3] Pull ter Gunne AF,Mohamed AS,Skolasky RL,et al. The presentation,incidence,etiology,and treatment of surgical site infections after spinal surgery[J]. Spine (Phila Pa 1976),2010,35(13):1323-1328.
[4] Mok JM,Pekmezci M,Piper SL,et al. Use of C-reactive protein after spinal surgery:comparison with erythrocyte sedimentation rate as predictor of early postoperative infectious complications[J]. Spine (Phila Pa 1976),2008,33(4):415-421.
[5] Shim DM,Kim TK,Song HH,et al. Quantitation of C-reactive protein levels and erythrocyte sedimentation rate after spinal surgery[J]. Journal of Korean Society of Spine Surgery,1998,5(1):33-39.
[6] Mok JM,Guillaume TJ,Talu U,et al. Clinical outcome of deep wound infection after instrumented posterior spinal fusion:a matched cohort analysis[J]. Spine (Phila Pa 1976),2009,34(6):578-583.
[7] Ploumis A,Mehbod AA,Dressel TD,et al. Therapy of spinal wound infections using vacuum-assisted wound closure:risk factors leading to resistance to treatment[J]. J Spinal Disord Tech,2008,21(5):320-323.
[8] Atkins BL,Athanasou N,Deeks JJ,et al. Prospective evaluation of criteria for microbiological diagnosis of prosthetic-joint infection at revision arthroplasty[J]. J Clin Microbiol,1998,36(10):2932-2939.
[9] Beiner JM,Grauer J,Kwon BK,et al. Postoperative wound infections of the spine[J]. Neurosurg Focus,2003,15(3):E14.
[10] Kowalski TJ,Berbari EF,Huddleston PM,et al. The management and outcome of spinal implant infections: contemporary retrospective cohort study[J]. Clin Infect Dis,2007,44(7):913-920.
[11] Quiones-Hinojosa A,Jun P,Jacobs R,et al. General principles in the medical and surgical management of spinal infections: a multidisciplinary approach[J]. Neurosurg focus,2004,17(6):E1.
[12] Canavese F,Krajbich JI. Use of vacuum assisted closure in instru- mented spinal deformities for children with postoperative deep infections[J]. Indian J Orthop,2010,44(2):177-183.
[13] Canavese F,Gupta S,Krajbich JI,et al. Vacuum-assisted closure for deep infection after spinal instrumentation for scoliosis[J]. J Bone Joint Surg Br,2008,90(3):377-381.
[14] Argenta LC,Morykwas MJ. Vacuum-assisted closure: a new method for wound control and treatment:clinical experience[J]. Ann Plast Surg,1997,38(6):563-576.
[15] Richards BS,Emara KM. Delayed infections after posterior TSRH spinal instrumentation for idiopathic scoliosis:revisited[J]. Spine (Phila Pa 1976),2001,26(18):1990-1996.
[16] Labler L,Keel M,Trentz O,et al. Wound conditioning by vacuum assisted closure (V.A.C.) in postoperative infections after dorsal spine surgery[J]. Eur Spine J,2006,15(9):1388-1396.
[17] Jones GA,Butler J,Lieberman I,et al. Negative-pressure wound therapy in the treatment of complex postoperative spinal wound infections:complications and lessons learned using vacuum-assisted closure[J]. J Neurosurg Spine,2007,6(5):407-411.
[18] Ahmed R,Greenlee JD,Traynelis VC. Preservation of spinal instrumentation after development of postoperative bacterial infections in patients undergoing spinal arthrodesis [J]. J Spinal Disord Tech,2012,25(6):299-302.
[19] Falavigna A,Righesso Neto O,Fonseca GP,et al. Management of deep wound infections in spinal lumbar fusions[J]. Arq Neuropsiquiatr,2006,64(4):1001-1004.