单枚Z-Cage单侧椎弓根螺钉固定治疗退行性腰椎疾病的影像及临床观察
张 凯,赵长清,马振江,孙晓江,李 华,孙 伟,赵 杰
腰椎椎体间融合技术临床广泛应用,取得了良好的临床疗效。TLIF技术由Harms 和Rolinger[1]在1982年报道,该技术能够有效减少对椎管内结构的干扰,降低对神经根和硬脊膜的刺激和损伤;保留对侧椎板、关节突关节及后部张力带结构,通过单侧后外侧入路即可实现脊柱的前柱固定。脊柱坚强内固定系统置入会改变邻近节段椎间盘和关节突关节的载荷,可能引发邻近节段的椎间盘突出、关节突关节退变加速,融合节段的固定过分坚强,融合区域的应力遮挡而导致骨质疏松和植骨的吸收[2]。为降低脊柱内固定强度,国内外学者提出应用单侧椎弓根内固定方法有助于解决此问题[3-6]。
Cage在PLIF/TLIF中占有重要的作用。基于Bagby提出的“撑开-压缩”原理,脊柱界面固定应用于临床,Cage椎间融合器置入椎间隙恢复脊柱前柱、中柱的应力,提供足够的机械强度和即刻稳定性,避免植骨块塌陷、移位、脱出,为植骨的融合创造良好的力学环境[7]。Cage的发展体现在材料进步和形状设计的改良上。聚醚醚酮材料由于弹性模量低,能透X线方便评价植骨融合情况,目前在临床广为应用。融合器形状由带螺纹的中空圆柱体状发展为立方形、长方形、肾形、子弹头型[8]。子弹头形Cage(Capstone)不适用于L4/L5或L5/S1椎间隙过高或角度过大的解剖形态不匹配的病例[9-10]。
理想的融合器应该有足够的机械强度,相对大的与椎体间接触面积,维持有效的椎间盘高度,便于准确判断椎体间融合情况,减少脊柱软组织破坏,方便置入。为此本院设计了适合单侧固定单枚Cage置入的“Z”形融合器并应用于临床。本文目的是评估单枚Z-Cage单侧椎弓根螺钉固定治疗退行性腰椎病变的影像结果和临床疗效。
1 资料与方法
1.1 一般资料
2009年1月~2010年4月单枚Z-Cage单侧椎弓根螺钉固定治疗腰椎退变性疾病患者61例,获得随访资料的患者46例(75.4%),男26例,女20例,年龄平均53.1岁(22~72岁),症状持续时间6~240个月,平均56个月。腰椎椎管狭窄症(需要切除>50%关节突关节充分减压)21例,腰椎椎间盘突出伴腰椎不稳13例,腰椎椎间盘突出症术后原位复发7例,巨大型腰椎椎间盘突出5例。单节段39例,其中L3/L43例,L4/L520例,L5/S116例;双节段7例,其中L3/L4/L51例,L4/L5/S16例;总共53节段。所有病例必须同时符合临床及X线诊断标准并在正规非手术治疗3个月无效后再行手术治疗。
纳入标准:①较严重腰背痛、难以缓解的根性症状(下肢麻木感和放射性疼痛或症状以一侧为主),接受过3~6个月非手术治疗症状无明显缓解。②近3个月内腰椎MRI显示单节段或双节段中重度的椎间盘退变。③腰椎椎间盘突出症行单纯椎间盘髓核摘除术术后复发。④椎间盘造影诱发腰背痛。⑤腰椎侧位X线片显示病变节段过屈过伸侧位X线片相邻椎体水平移位>3 mm,或角度变化≥10°或严重腰痛(腰痛重于腿痛)伴腰椎终板及终板下骨质MRI信号改变I型 (Modic Ⅰ型)。CT和MRI检查证实病变节段椎间盘突出,且与临床症状、体征相符合。排除标准:腰椎滑脱;退变性侧凸;感染、肿瘤、孕妇、免疫性疾病、肝功异常、代谢性骨病等。
1.2 手术方法
Z-Cage(威高,聚醚醚酮材料,见图1),聚醚醚酮材料最接近人骨的弹性模量,透X线可观察植骨融合情况。Z型设计,易于打入,方便斜行置入,与终板解剖相匹配,表面齿状突起防止脱出。
手术方法:均由同一手术者完成。①麻醉、体位。全麻成功后,俯卧位,保持腰椎正常前凸,腹部悬空。②入路。后正中或Wiltse入路,单侧(症状侧或症状较重侧)显露至横突末端。③减压。④置入椎弓根钉棒。在拟融合间隙的上下椎弓根置入螺钉及连接棒。椎弓根螺钉及连接棒将在椎间盘切除、椎间逐级撑开以及置入Z-Cage的步骤中预锁紧而维持撑开。⑤逐级撑开椎间隙。从减压侧将最小号的融合器试模(7#)开始,逐级使用更大型号的试模(8#/9#/10#/11#……),直至椎间隙撑开到合适高度。椎间隙合适撑开高度的判断依据撑开器拔出时的阻力及相邻正常椎间隙的高度。⑥髓核和软骨终板切除。椎间隙撑开同时行髓核和软骨终板切除。⑦准备Z-Cage。根据椎间撑开过程中最后使用的融合器试模选择Z-Cage的型号。将Z-Cage放置于压实器盒内,把减压过程中切除的椎板骨粒填入Z-Cage植骨腔内,并用压实器压紧骨粒。⑧预植骨。将局部自体骨粒植入Z-Cage进入侧的椎间隙前方。⑨Z-Cage置入。用神经剥离子和金属吸引器头从Z-Cage上下两面遮挡植骨腔,防止骨粒漏出,置入方向略斜向对侧倾斜(约30°),置入深度以Z-Cage后缘略低于椎体后缘为准(约2 mm),然后敲击微调器使Z-Cage尾端向术侧倾斜,与矢状面成45°~60°角。X光透视观察Z-Cage位置,避免Z-cage过于靠前或偏向一侧。⑩椎弓根钉棒的最终锁紧。松开椎弓根螺钉的螺帽,手术节段在椎旁韧带张力作用下会自行略微回缩,然后完成钉棒系统的最终锁紧,透视确认所有置入物的位置正确。

图1 Z-cage
Fig.1 Z-cage
1.3 术后处理
常规使用抗生素24 h,术后第2天视引流量酌情拔除引流管,术后3~5 d酌情使用激素和神经营养药,以减轻术后神经水肿和促进神经功能恢复,术后卧床3 d后腰围保护下床活动,3个月内限制过度活动和剧烈运动。
1.4 观察指标及疗效评定方法
观察指标包括影像学及临床结果评估。
影像学评估:评估椎间高度及Cage沉降情况、植骨融合情况。术前行正侧位X线片,动力侧位X线片,CT,MRI检查。术后即刻(4周内)、3个月、6个月拍摄正侧位X线片,术后12个月及末次复查时拍摄正侧位X线片,动力位X线片并行CT检查。判定融合标准为融合区有连续的骨桥形成,过伸过屈位X线片椎体间角度活动域<5°,双节段者只有都达到融合标准方判定融合。融合器松动、移位、融合器表面出现>2 mm的透亮带或过伸过屈位X线片椎体间角度活动域>5°均判为融合失败。CT 以Bridwell标准[11]评价腰椎融合情况。
临床疗效评估:观察手术时间、术中出血量、术后卧床时间、手术并发症的情况。术前、术后即刻、3、6、12、24个月对患者采用腰腿痛疼视觉模拟量表(visual analog scale,VAS)评分[12], Oswestry功能障碍指数(Oswestry disability index,ODI)[13],36项简明健康量表(36-item short-form health survey,SF-36)[14]评价临床疗效。
1.5 统计学分析
使用SPSS12.0统计学软件包对结果进行t检验,P<0.05视差异有统计学意义。
2 结 果
本组病例全部获得随访,随访时间24~39个月,平均29.6个月。 手术时间100~180 min,平均124.8 min;术中出血量为150~560 mL,平均285 mL,术中采用自体血回输;住院时间平均7.5 d(4~15 d)。
2.1 影像学结果
2.1.1融合情况
共43例获得融合,3例为可疑融合,融合率93.4%。 椎间融合面积比率(49.8±14.2)% 。末次随访时根据Bridwell椎间融合评价标准,Ⅰ级和Ⅱ级为42例(91.3%),无螺钉断裂及松动发生。本组病例中无Cage松动移位病例发生。
2.1.2 融合节段椎间隙高度变化
融合节段椎间高度术前7.6 mm,术后即刻为12.4 mm,末次随访时为11.9 mm(其中前方椎间高度12.3 mm,后方椎间高度11.5 mm)。Z-Cage沉降情况:术后3个月平均沉降1.32 mm,至末次随访时平均沉降1.66 mm,沉降>3 mm者 5例。
典型病例影像学资料见图2。
2.2 临床结果
结果显示(见表1):术前腰痛VAS评分为7.3±1.6,末次随访时为2.4±1.2,术前下肢痛VAS评分为6.2±0.7,末次随访时为1.4±0.7,与术前比较差异有显著改善(P<0.01);ODI术前为(73.6±12.0)%,末次随访时为(15.0±6.4)%,与术前比较差异有统计学意义(P<0.01)。SF-36简明健康状况调查问卷生理功能评分及精神健康评分。88.2%患者恢复术前工作,91%患者对治疗结果满意。
2.3 并发症
术中1例出现硬膜囊撕裂(腰椎椎间盘突出症复发再次手术病例);术后2例发生切口浅表组织感染,1例伤口脂肪液化,经换药痊愈;本组有1例术后出现手术侧足下垂,术后4周完全恢复,术后无严重神经并发症;1例术后3 d发生冠脉综合征,无死亡及深部感染病例。
3 讨 论
国外学者为解决脊柱融合节段的固定过分坚固可能引发邻近节段的退变加速,融合区域的应力遮挡等问题,提出了脊柱融合节段单侧固定的方法,并在生物力学和临床应用上证明了其可行性。1991年Goel等[3]通过人体新鲜脊柱标本研究认为与双侧固定相比,单侧固定为非坚强固定,可能减少应力遮挡。1992年Kabins等[4]首先报告单侧内固定的临床应用,并证明单侧和双侧内固定单节段融合率相同。优势在于减少手术创伤、时间及费用,固定节段刚度降低,可能减少邻近节段退变的发生。Suk 等[15]和Chen 等[16]通过生物力学研究发现,单侧固定与单枚Cage组合能够提供可靠的稳定性。仅存在单侧神经根症状的双节段腰椎不稳,仅需单侧PLIF即能达到减压融合的治疗目的。近年来,腰椎融合技术的进步体现在保证有效减压及提高植骨融合率的基础上,关注于减轻软组织创伤及神经的牵拉。有研究指出术中保护骶棘肌、腰背肌的完整性及其神经支配是防止术后发生腰背衰弱综合征和脊柱不稳的重要预防措施[17-18]。单侧椎弓根螺钉固定术仅剥离一侧骶棘肌、椎旁肌,可以避免对无症状侧软组织的剥离和对关节突关节的破坏,减少软组织损伤,减少潜在的腰椎失稳。
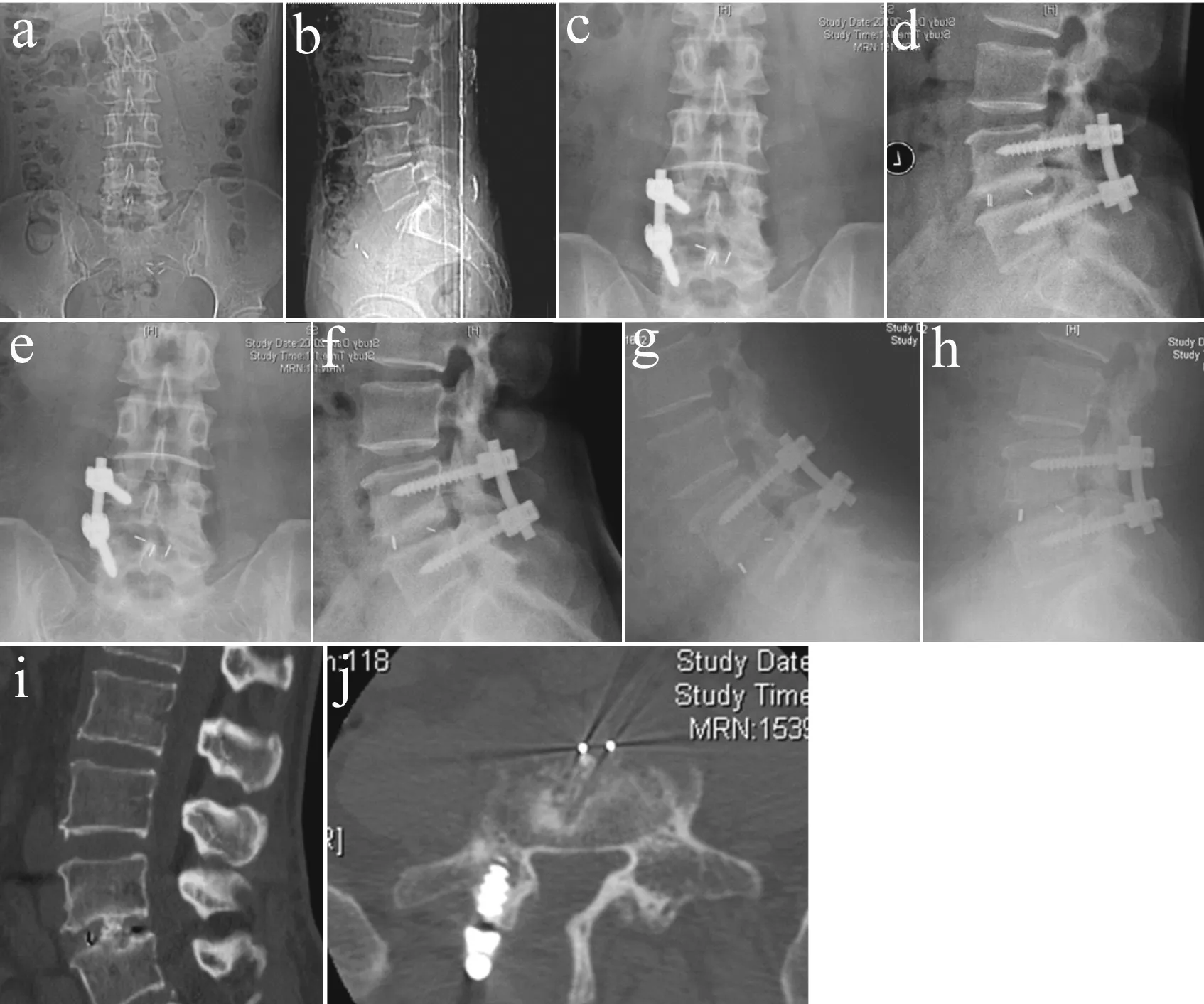
a,b: 术前正侧位X线片 c,d: 术后3个月正侧位X线片 e,f: 术后6个月正侧位X线片 g,h: 术后6个月动力位X线片 i: 术后12个月CT矢状位示植骨融合 j: 术后12个月CT横断面示Cage位置
a,b: Preoperative anteroposterior and lateral X-ray films c,d: Postoperative 3-month anteroposterior and lateral X-ray films e,f: Postoperative 6-month anteroposterior and lateral X-ray films g,h: Postoperative 6-month flexion-extension X-ray films i: Postoperative 12-month sagittal CT shows interbody fusion j: Postoperative 12-month cross CT show position of Cage
图2 典型病例影像学资料
Fig.2 Radiologic data of a typical patient
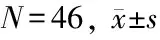
表1 术前术后VAS、ODI及 SF-36评分Tab.1 Pre- and postoperative results of VAS,ODI and SF-36 scores
因此本组手术采用单侧显露病变节段,保留棘突、对侧关节突关节及后部张力带结构,通过单侧后外侧入路即可实现脊柱的前柱固定。
椎体间植骨融合符合脊柱生物力学机制,保证有效的植骨面积和融合率,恢复和维持正常的椎间高度、增加椎间孔直径及重建腰椎前凸[19]。所以后路常规需置入双枚Cage,为达到充分的减压及增大置入Cage的有效空间,需要广泛切除脊柱后部结构,包括双侧小关节突、椎板及棘突等,但是这样也降低了融合器置入后的脊柱稳定性,尤其是屈曲刚度及旋转刚度。同时,在置入2个具有一定体积的Cage过程中,马尾神经等受到很大程度的牵拉,手术潜在的危险性较大[20-21]。部分患者由于椎间隙大小的限制、神经根的解剖变异、术后瘢痕等限制了神经根的牵拉,置入双枚Cage比较困难,甚至无法置入。长期随访显示应用单枚Cage能够达到相似的临床效果[22]。斜向置入单融合器的椎体间融合术只需切除单侧小关节突和一半椎板的侧后方,可以保留较多脊柱后部结构,从而增加了融合后的屈曲和旋转刚度[23]。本组前期的有限元模型分析结果显示单侧椎弓根螺钉固定不能很好地控制侧屈和旋转载荷,附加单枚融合器置入可以重建融合节段的稳定性,明显减少螺钉的应力[24]。因而,有必要设计一种适合单侧固定单枚置入的融合器,考虑到置入时的方便、减少对神经结构的骚扰以及置入后的方向调整,本组采取了“Z”形设计。
有效的椎间融合是手术成功的关键环节,需要保证置入Cage的位置良好及充分的植骨,这对于单枚Cage的置入显得尤为重要。生物力学实验研究发现椎间结构支撑物的面积要达到临近终板面积的30%~40%,腰椎植骨床面积可能要达到60%~80%,才能有效传递载荷(实验的椎间支撑物为聚甲基丙烯酸甲酯材料,其弹性模量比正常骨质要大[25-26]。增大Cage的宽度能够降低沉降率,但是更宽的Cage增加了置入的难度及潜在的神经损伤的危险性。长度选择取决于椎体的直径,使其能够覆盖终板外围,解剖学及生物力学研究显示终板中心部分薄弱,后外侧及外围最为坚强,与终板外围更多接触,能够更有效地传递载荷[27-28]。Cage的高度与撑开力相关,10~12 mm的高度能够在没有过度撑开的情况下达到间接减压恢复退变间隙的高度,过度的撑开可能导致沉降的增加。而椎间高度撑开不够、选择Cage型号过小是导致置入融合器失败的重要原因[29]。直接增加椎间隙高度,能使小关节复位,并增加神经根管容积,达到间接神经减压的目的[30]。因此本组选择后外侧斜行置入,Cage的规格高度为12 mm或14 mm,长度32 mm或36 mm。
融合器的主要作用是将椎间隙撑开并提供一个有利于成骨的稳定融合界面。当Cage内的植骨面积小于临近终板面积50%时对传递生理载荷是不足的,建议增加椎间隙植骨量[26]。增加植骨床接触面积减少了固定界面单位面积所承受的载荷,降低Cage陷入椎体的可能,同时为椎体和Cage之间提供了更大的接触面积以利于骨的长入提高融合率。骨性终板中央区有较丰富的微血管通道,具有较好的通透性,能给植骨区提供较充足的血液循环,为中空的Cage置入的骨粒提供了条件[31]。Cage下沉的一个重要因素为骨密度情况,Lim等[32]发现在保留终板完整的情况下,与融合界面的抗压强度密切相关的是骨密度,骨密度降低Cage下沉的危险增加,而在退行性腰椎管狭窄的患者中很多合并有骨密度降低的情况,为减少下沉发生率增加植骨量就更为重要。因此本组在侧前方可以放入更多的骨粒。加长的单枚Cage斜行置入可以提供足够的融合后生物力学强度;Cage长度的增加,增大了与上下椎体接触处植骨床的面积,另外在置入Cage前,在其侧前方可以安全地放入更多的植骨块而不必担心植骨块的移位,也防止了后期长入椎管的危险。
椎间融合器中植骨已从最初的自体松质骨、异体骨、骨替代材料等,缓释材料复合重组人骨形态发生蛋白-2(recombinant human bone morphogenetic protein-2,rhBMP-2)置入椎间融合器中促进椎体间融合。取骨手术并发症和骨量不足,是自体骨移植应用受限的主要原因,髂骨取骨严重并发症如出血、术后疼痛、疝形成、严重感染、瘢痕化、血肿形成、血管神经损伤等的发生率高达25%[33]。据国外资料显示,临床应用rhBMP-2引起的常见并发症有椎体骨溶解吸收(44%)、异位骨形成(25%)、软组织水肿(5.8%)等,其安全性越来越引起脊柱外科医师关注[34]。因此本组植骨来源为椎管减压切除的骨质(椎板、关节突等),去除软骨及纤维组织咬成骨粒,只有植骨量不足时方才考虑异体骨、骨替代材料等。
经侧后方行椎间单枚Z-Cage斜向置入,结合TLIF技术在保留大部分椎体后部张力带结构的前提下完成椎管减压,术中避免了过度牵拉硬脊膜和神经根,降低了损伤神经的风险。与传统的双侧椎弓根螺钉固定手术相比时间短、创伤小、出血少,住院费用低。单枚Z-Cage能有效地维持椎间隙的高度和节段的稳定,手术时需注意置入椎弓根螺钉的位置良好及选择的融合器规格合适。
参考文献
[1] Harms J,Rolinger H. A one-stager procedure in operative treatment of spondylolistheses: dorsal traction-reposition and anterior fusion[J]. Z Orthop Ihre Grenzgeb,1982,120(3):343-347.
[2] Shah RR,Mohammed S,Saifuddin A,et al. Radiologic evaluation of adjacent superior segment facet joint violation following transpedicular instrumentation of the lumbar spine[J]. Spine (Phila Pa 1976),2003,28(3):272-275.
[3] Goel VK,Lim TH,Gwon J,et al. Effects of rigidity of an internal fixation device. A comprehensive biomechanical investigation[J]. Spine (Phila Pa 1976) ,1991,16(3 Suppl):S155-161.
[4] Kabins MB,Weinstein JN,Spratt KF,et al. Isolated L4-L5 fusions using the variable screw placement system: unilateral versus bilateral[J]. J Spinal Disord,1992,5(1):39-49.
[5] Zhang K,Sun W,Zhao CQ,et al. Unilateral versus bilateral instrumented transforaminal lumbar interbody fusion in two-level degenerative lumbar disorders: a prospective randomised study[J]. Int Orthop,2014 ,38(1):111-116.
[6] 董健文,冯丰,赵卫东,等. 双节段后路腰椎椎体间融合术单侧椎弓根钉固定的生物力学稳定性[J]. 中华外科杂志,2011,49(5): 436-439.
[7] Kuslich SD,Ulstrom CL,Griffith SL,et al. The Bagby and Kuslich method of lumbar interbody fusion. History,techniques,and 2-year follow-up results of a United States prospective,multicenter trial[J]. Spine (Phila Pa 1976) ,1998,23(11):1267-1278.

[9] Aoki Y,Yamagata M,Nakajima F,et al. Examining risk factors for posterior migration of fusion cages following transforaminal lumbar interbody fusion: a possible limitation of unilateral pedicle screw fixation[J]. J Neurosurg Spine,2010,13(3):381-387.
[10] Kimura H,Shikata J,Odate S,et al. Risk factors for cage retropulsion after posterior lumbar interbody fusion: analysis of 1070 cases[J]. Spine (Phila Pa 1976),2012,37(13):1164-1169.
[11] Bridwell KH,Lenke LG,McEnery KW,et al. Anterior fresh frozen structural allografts in the thoracic and lumbar spine. Do they work if combined with posterior fusion and instrumentation in adult patients with kyphosis or anterior column defects?[J]. Spine (Phila Pa 1976), 1995, 20(12):1410-8.
[12] Huskisson EC. Measurement of pain[J]. Lancet,1974,2 (7889):1127-1131.
[13] Fairbank JC. Use and abuse of Oswestry Disability Index[J].Spine (Phila Pa 1976),2007,32(25):2787-2789.
[14] 李鲁,王红妹,沈毅. SF-36健康调查量表中文版的研制及其性能测试[J]. 中华预防医学杂志,2002,36(2):109-113.
[15] Suk KS,Lee HM,Kim NH,et al. Unilateral versus bilateral pedicle screw fixation in lumbar spinal fusion[J]. Spine (Phila Pa 1976) ,2000,25(14):1843-1847.
[16] Chen HH,Cheung HH,Wang WK,et al. Biomechanical analysis of unilateral fixation with interbody cages[J]. Spine (Phila Pa 1976),2005,30(4):E92-96.
[17] Asano S,Kaneda K,Umehara S,et al. The mechanical properties of the human L4-5 functional spinal unit during cyclic loading. The structural effects of the posterior elements[J]. Spine (Phila Pa 1976),1992,17(11):1343-1352.
[18] Brown SH,McGill SM. Muscle force-stiffness characteristics influence joint stability: a spine example[J]. Clin Biomech (Bristol,Avon),2005,20(9):917-922.
[19] Groth AT,Kuklo TR,Klemme WR,et al. Comparison of sagittal contour and posterior disc height following interbody fusion: threaded cylindrical cages versus structural allograft versus vertical cages[J]. J Spinal Disord Tech,2005,18(4):332-336.
[20] Ghanayem AJ,Rapiff AJ,Zdeblick TA. Biomechanical analysis of intervertebral fusion cages with respect to point of insertion and posterior element deficiencies[C]//International Society for the Study of the lumbar Spine,1996: 25-29.
[21] Lin PM. Radiographic evidence of posterior lumbar interbody fusion with an emphasis on computed tomographic scanning[J]. Clin Orthop Relat Res,1989 (242):158-163.
[22] Zhao J,Hou T,Wang X,et al. Posterior lumbar interbody fusion using one diagonal fusion cage with transpedicular screw/rod fixation[J]. Eur Spine J,2003,12(2):173-177.
[23] Abumi K,Panjabi MM,Kramer KM,et al. Biomechanical evaluation of lumbar spinal stability after graded facetectomies[J]. Spine (Phila Pa 1976),1990,15(11):1142-1147.
[24] 陈志明,马华松,赵杰,等. 腰椎单侧椎弓根螺钉固定的三维有限元分析[J]. 中国脊柱脊髓杂志,2010,20(8): 684-688.
[25] Closkey RF,Parsons JR,Lee CK,et al. Mechanics of interbody spinal fusion. Analysis of critical bone graft area[J]. Spine (Phila Pa 1976),1993,18(8):1011-1015.
[26] Lee JH,Jeon DW,Lee SJ,et al. Fusion rates and subsidence of morselized local bone grafted in titanium cages in posterior lumbar interbody fusion using quantitative three-dimensional computed tomography scans[J]. Spine (Phila Pa 1976),2010,35(15):1460-1465.
[27] Grant JP,Oxland TR,Dvorak MF. Mapping the structural properties of the lumbosacral vertebral endplates[J]. Spine (Phila Pa 1976),2001,26(8):889-896.
[28] Lowe TG,Hashim S,Wilson LA,et al. A biomechanical study of regional endplate strength and cage morphology as it relates to structural interbody support[J]. Spine (Phila Pa 1976),2004,29(21):2389-2394.
[29] McAfee PC,Cunningham BW,Lee GA,et al. Revision strategies for salvaging or improving failed cylindrical cages[J]. Spine (Phila Pa 1976),1999,24(20):2147-2153.
[30] Chen D,Fay LA,Lok J,et al. Increasing neuroforaminal volume by anterior interbody distraction in degenerative lumbar spine[J]. Spine (Phila Pa 1976),1995,20(1):74-79.
[31] Oki S,Matsuda Y,Shibata T,et al. Morphologic differences of the vascular buds in the vertebral endplate: scanning electron microscopic study[J]. Spine (Phila Pa 1976),1996,21(2):174-177.
[32] Lim TH,Kwon H,Jeon CH,et al. Effect of endplate conditions and bone mineral density on the compressive strength of the graft-endplate interface in anterior cervical spine fusion[J]. Spine (Phila Pa 1976),2001,26(8):951-956.
[33] Younger EM,Chapman MW. Morbidity at bone graft donor sites[J]. J Orthop Trauma,1989,3(3):192-195.
[34] Bridwell KH,Anderson PA,Boden SD,et al. What’ew in spine surgery[J]. J Bone Joint Surg Am,2004,86-A(7):1587-1596.