过伸体位下经皮椎体后凸成形术治疗骨质疏松性Kümmell病的临床疗效
黄益奖,汤呈宣,彭茂秀,何少奇,戴鸣海,陈维善
1895年Kümmell[1]首次报道1例椎体轻微骨折患者经过几周至几个月不等的无症状期后出现胸腰背疼痛,椎体逐渐塌陷和进行性后凸畸形。这是一种少见的骨质疏松性椎体骨折不愈合病,称作Kümmell病。Kümmell病可因椎体逐渐塌陷与进行性后凸畸形引起患者长期背痛.甚至出现脊髓神经损伤乃至瘫痪[2-3]。随着微创脊柱外科的发展,创伤较小的经皮椎体成形术常被用于治疗这类患者,以达到稳定椎体,消除疼痛的目的。但有较高的骨水泥渗漏率。与椎体成形术相比较,经皮球囊扩张椎体后凸成形术治疗骨质疏松性椎体骨折具有降低骨水泥渗漏与矫正后凸畸形的作用[4]。本院2007年1月~2012年6月应用球囊扩张椎体后凸成形术于过伸体位下治疗21例骨质疏松性Kümmell病患者,并取得了较好临床效果,报告如下。
1 资料与方法
1.1 一般资料
18例患者中,男6例,女12例;年龄62~86岁,平均69.5岁。均表现为顽固性腰背痛,改变体位可诱发或加重疼痛,均无神经损伤体征。5例无明显外伤史,13例有轻微外伤史,其中拖地、洗衣服、搬运东西时扭伤6例,平地摔倒4例,2米高处摔伤1例,汽车轻微碰撞致伤l例,l例患者无明显外伤史但有长期慢性阻塞性肺疾病伴乳腺癌癌切除术后。背部疼痛病史1个月~ 3年,平均3.5个月。卧床休息与内科药物治疗均不能使疼痛缓解。由肿瘤引起的Kümmell病以及骨质疏松性Kümmell病伴有神经受压症状者均排除在外。术前所有患者均行X线片、CT及MRI检查。X线片上可见椎体明显压缩,椎体内有透亮区,呈“裂隙征”改变;CT检查可见椎体内真空样改变。压缩椎体在MRI T1加权像上呈低信号,T2加权像及脂肪抑制序列像呈界限清晰高信号区域。均为单节段病变,T51例,T72例,T116例,T124例,L12例,L22例,L41例。根据Li等[5]的分期标准,Ⅰ期3例,Ⅱ期15例。采用双能X线骨密度仪测定骨密度T值为-5.8~-2.8,平均-3.76。
1.2 手术方法
根据患者全身情况,选择采用局部麻醉或全身麻醉,使用专用海绵垫将胸骨及髂部垫高,联合调整手术床使患者呈过伸俯卧体位。C形臂X线机透视定位,调整C形臂球管以病椎为中心,使其终板成像为一线影,同时两侧椎弓根的形状对称并与棘突的间距相同。常规消毒铺单,在C形臂X线机引导下将穿刺针准确的置入椎弓根后,再继续钻入椎体2~3 mm后停止。抽出穿刺针的内芯,置入导针。拔出穿刺针,按序沿导针置人扩张套管和工作套管,使工作套管的前端位于椎体后缘皮质前方2~3 mm处。用骨水泥推杆处理骨通道后建立球囊工作通道,放入可扩张球囊,其理想位置是在侧位显示位于病椎的前3/4处,穿刺针多需要平行于相邻椎体终板方向。同样方法完成另一侧的穿刺和球囊的放置。连接注射装置,同时扩张球囊,当压力达到50 psi(1 psi=6.895 kPa)时,取出球囊的内芯导丝,逐渐增加压力至球囊扩张满意,一般不超过300 psi。当球囊已扩张达预计的椎体复位效果时即停止增加压力。调制骨水泥至拉丝后期时,将其灌入骨水泥推入管。抽出球囊内液体,取出球囊,将骨水泥缓慢置人椎体的空腔内,观察骨水泥分布情况。骨水泥固化时间为15 min,等待足够时间并确认骨水泥固化后,转动、拔出管道。术后常规使用抗骨质疏松等药物治疗,术后第2天在支具保护下下床活动。
1.3 疗效评价
测量术前、术后2 d、末次随访时侧位X线上受累节段矢状面Cobb角(病椎上位椎体的上终板垂线与下位椎体的下终板垂线的交角),并采用视觉模拟量表(visual analog scale,VAS)[6]评分及Oswestry功能障碍指数(Oswestry disability index,ODI)[7]综合评估手术疗效。术前与术后数据、术后与末次随访时数据分别采用配对t检验,应用SAS 8.0软件进行统计分析。P<0.05为差异有统计学意义。
2 结 果
所有患者均顺利完成手术,手术时间26~56 min,平均42 min;术中出血量5~16 mL,平均10 mL;骨水泥注入量为3.5~8.0 mL,平均5.40 mL;住院时间2~7 d,平均4.5 d。发生骨水泥椎间盘内渗漏1例,但未出现临床症状。其余患者骨水泥位于椎体内。无一例出现静脉渗漏、椎管内渗漏及肺栓塞,无其他并发症发生。随访12~36个月,平均15.8个月,术后患者腰背部疼痛症状均明显缓解,日常生活能力改善。Cobb角由术前的32.60°±3.82°改善至术后2 d的7.60°±1.68°,VAS评分及ODI由术前平均8.7分、88.6%改善至术后2d平均2.6分、28.6%,差异均有统计学意义(P<0.01);末次随访时Cobb角为(9.60°±2.06°),VAS和ODI分别为2.2分和26.4%,与术后2 d时比较差异均无统计学意义(P>0.05)。典型病例影像学资料见图1。
3 讨 论
3.1 Kümmell病的发生机制
Steel[8]于1951年报道提出Kümmell病发生机制,认为其发生过程可能源于脊柱微小创伤引发骨性结构及韧带结构多发性微小损伤,从而引起松质骨断裂及小血肿形成,进而造成骨坏死,以至于椎体塌陷。此后许多学者从不同角度提出不同的假说,以解释Kümmell病发生机制,但主要以椎体缺血性坏死假说和骨质疏松性骨折后椎体内假关节形成假说为主[9]。
目前大多数研究认为Kümmell病系椎体缺血性坏死所致。Benedek等[10]报道将Kümmell病发生过程分为2个阶段,第1阶段椎体受到轻微外伤,出现骨小梁微骨折,但骨小粱微骨折引起骨强度降低程度轻微,尚未达到致使塌陷性骨折的程度,且正常情况下骨小梁微骨折较易愈合,故X线片检查无明显表现;第2阶段椎体营养血管受到微骨折损伤,骨小梁发生缺血性坏死,导致微骨折修复受阻,而反复的轻微外力作用使微骨折进一步进展,最终导致椎体塌陷骨折。Stojanovic等[11]经脊柱血管造影术检查Kümmell病患者,发现患者病变椎体供血动脉出现闭塞。据此认为Kümmell病引起的椎体塌陷系椎体血供不足的缘故。Kümmell病病变椎体病理活检结果同样支持椎体缺血性坏死假说。Yu等[12]报道对15例Kümmell病患者术后标本进行病理检查,结果均显示典型的椎体缺血性坏死,即坏死性小骨块伴反应性纤维增生。本病例组中部分病例行病理活检可见部分坏死组织,支持上述理论。
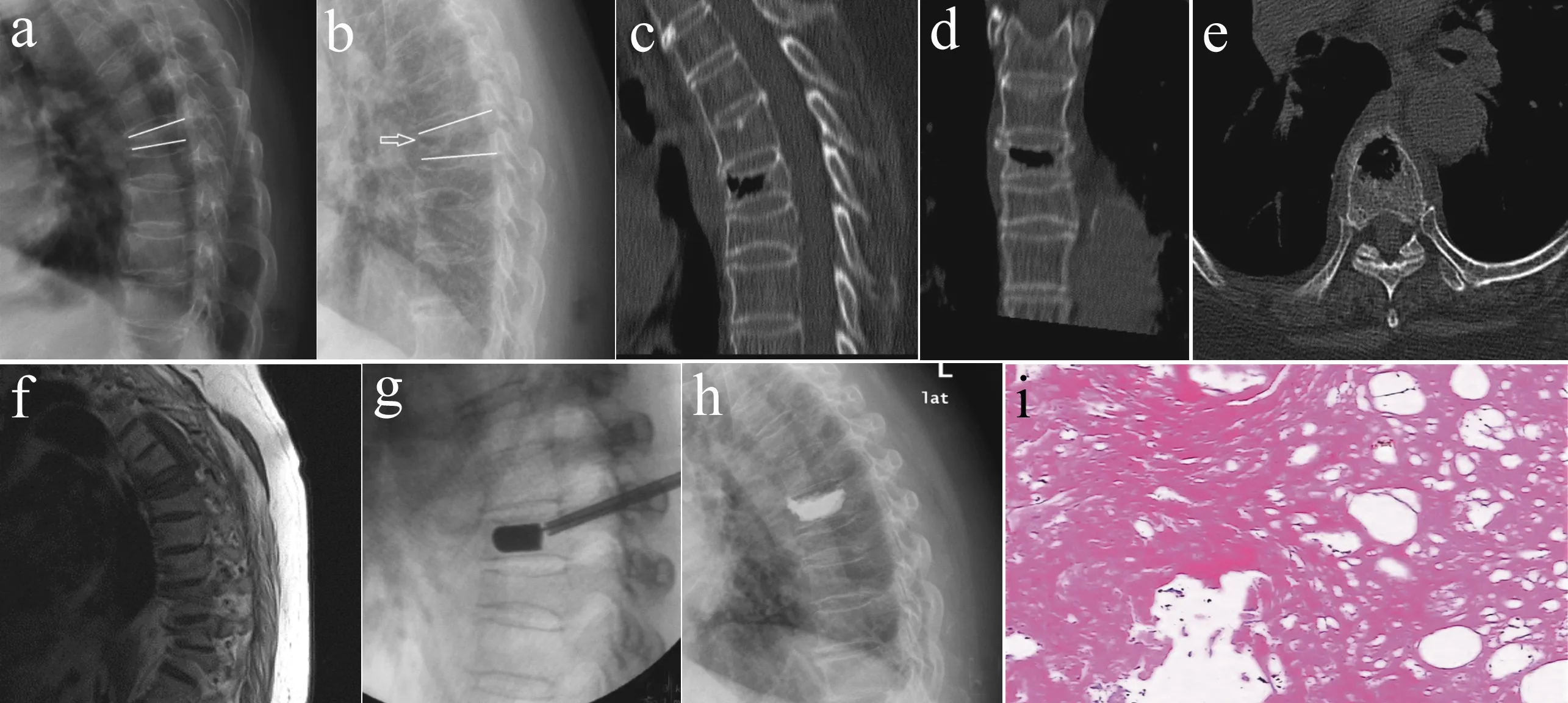
a: 术前侧位X线片示T5椎体压缩性骨折 b: 术前卧位侧位X线示椎体内有透X线区,呈“裂隙征”改变 c~e: 术前CT扫描可见T5椎体内真空样改变 f: 术前MRI示T5椎体骨折,坏死区域T1加权像呈低信号 g: 术中X线示球囊扩张,椎体高度复位 h: 球囊扩张椎体后凸成形术后X线可见骨水泥充填椎体内空隙 i: 病椎活检可见坏死组织(×400)
a: Preoperative lateral X-ray film shows T5vertebral compression fractures b: Preoperative supine lateral X-ray film shows a vertebral body through X-ray region of “fissure sign ”change c-e: Preoperative CT scan show T5vertebral vacuum-like change f: Preoperative MRI shows T5vertebral fractures and necrotic area T1-weighted image with low signal g: Intraoperative X-ray shows balloon expansion and vertebral height reset h: Balloon kyphoplasty postoperative X-ray film shows vertebral bone cement filling voids i: Vertebral biopsy visible shows necrotic tissue(×400)
图1 典型病例影像学资料
Fig.1 Radiologic data of a typical patient
然而,Kim等[13]研究认为,Kümmell病发生机制可能为骨质疏松性骨折后椎体内假关节形成而非椎体缺血性坏死,因为椎体内裂隙表明微骨折断端骨不连,并存在假关节动态活动,而椎体内出现真空裂隙则提示骨修复失败,并可引起骨坏死和椎体塌陷而非缺血性骨坏死口。Kim等[14]最近报道1例Kümmell病并发慢性硬膜外血肿,分析认为椎体内假关节活动在慢性血肿过程中起重要作用。
3.2 Kümmell病的影像学特点
Kümmell病与一般的陈旧性骨质疏松性椎体压缩骨折不同。陈旧性骨质疏松性椎体压缩骨折如果已经愈合。Kümmell病在影像学检查上,X线片和CT重建图像可见到椎体中央近上终板有大片透亮区。MRI可见T1相椎体低信号;STIR相见到椎体高信号;T2相MRI表现具有特征性:即椎体近上终板区域线状高信号区(高信号为血清样液体和颗粒状坏死组织),周围为低信号硬化区所包围。Freedman[15]认为,站立位和动力位的X线片以及MRI是诊断Kümmell病的重要检查,而CT并非必要。除了椎体中的真空征和气体表现外,如果在动力位片上发现经椎体水平的活动性假关节,也可认为是Kümmell病的表现之一。Ma等[16]认为,X线片和重建的CT图像上见到真空裂隙征或气体积聚是Kümmell病的特征性表现。而MRI除了有助于排除转移性肿瘤以外,还有助于将Kümmell病与陈旧性椎体压缩性骨折相鉴别,前者具有典型的“双线征”,而后者的表现一般为T1和T2的低或等信号。本组18例患者,受累椎体为胸椎、胸腰段和腰椎,无严重外伤史,病程较长,X线片可见椎体内明显的水平裂隙,CT证实为椎体前方靠近上终板透亮区,MRI检查T2显示上终板区域线状高信号区,周围为低信号硬化区所包围,符合骨坏死的“双线征”表现,根据以上临床特点及影像学表现可以确诊为Kümmell病。动力位X线片由于患者的疼痛,想摆出理想体位得出阳性结果的概率不高,但根据笔者经验,可在拍动力位X线片前给予患者止痛对症治疗,可让患者耐受部分的疼痛而得到相应的阳性结果。
3.3 经皮球囊椎体后凸成形术技术治疗Kümmell病的技术要点及并发症的预防
不愈合的椎体骨折因其结构上的特殊,在使用经皮球囊椎体后凸成形术时应注意防止并发症的出现。首先应明确患者多为老年人且合并有多种内科疾患,由于骨折后没有及时合理治疗,长时间卧床后身体素质下降很快,耐受常规麻醉、手术能力下降。本组组18例患者均采用了局麻,大大降低了麻醉风险,局麻最主要的优势在于便于手术中术者和患者间的交流和配合,在椎弓根穿刺、球囊扩张及骨水泥灌注等关键步骤,术者能够得到患者及时、准确的反馈。从而调整穿刺方向和深度,避免损伤神经根等,掌握球囊扩张复位的幅度并及时发现骨水泥灌注过程中有无渗漏等,最大程度地保证手术的安全性[17]。不愈合的椎体在过伸体位下复位。球囊牵开后椎体内留有较大空腔、椎体结构不完整,骨水泥比较容易灌注,灌注的量也比较大,通常腰椎的灌注量能达到6~8 mL,胸椎的灌注量能达到3~5 mL。但骨水泥的灌注只能以低压方式灌注,压力过高容易发生椎体周围骨水泥的泄漏。而低压灌注则可利用椎体周围软组织建立的屏障,椎体在球囊复位后椎体周围软组织与骨碎片形成有一定限制作用的囊。此时骨水泥低压灌注可形成坚固的类似椎体外形结构的骨水泥充填。由于该木式在局麻下进行创伤小,是治疗Kümmell病的首选手术方式。
并发症最常见原因是穿刺失误引起的神经系统损伤,经皮球囊椎体后凸成形术虽然在透视下进行,有明确的穿刺方法,但是术中由于患者高度骨质疏松,肥胖,患者术中不配合,体位变动等因素影向穿刺的成功率,即使非常熟练的操作人员也可能出现失误,本组病例中有1例患者胸腰段后凸畸形明显伴椎体旋转,局麻下患者术中因疼痛反复扭动身体不配合,致穿刺定位困难,出现1例穿刺过程中有神经根刺激,立即与患者沟通,有右下肢一过性麻木,术后出现右下肢放射痛,1周后症状缓解。骨水泥渗漏也是常见的并发症,因椎体骨折不愈合椎体结构不完整。同时骨水泥的灌注量较大致骨水泥部分膨出椎体外,特别是椎体前方,骨水泥漏出后有可能导致严重的神经系统并发症,在胸段可能导致脊髓损伤,在胸腰段可能导致马尾圆锥损伤,腰段可导致神经根损伤[18]。
本组Kümmell病患者均在过伸体位下实施椎体成形术。得到了良好的止痛效果,并且椎体塌陷及后凸畸形也得到显著纠正,考虑与Kümmell病椎体内不稳定、过伸体位使塌陷区域重新张开有关。本组仅1例出现椎间隙内骨水泥渗漏,考虑与术前终板骨折有关。无一例出现静脉内、椎管内渗漏,考虑与Kümmell病受累椎体内存在空腔、注射压力低、注人缓慢有关。
总之,经皮球囊扩张椎体后凸成形术具有创伤小,安全性较高及止痛效果好的优点,且无内固定松动之虞,适合于无明显神经压迫症状的Kümmell病患者。
参考文献
[1] Kümmell H. Die rarefizierende ostitis der Wirbelkorper [J].Dentache Med,1895,21(1):180-181.
[2] Lee SH,Cho DC,Sung JK. Catastrophic intramedullary hematoma following Kümmell’s disease with large intravertebral cleft[J]. Spine J,2008,8(6):1007-1010.
[3] Young WF,Brown D,Kendler A,et al. Delayed post-traumatic osteonecrosis of a vertebral body (Kummell’s disease)[J]. Acta Orthop Belg,2002,68(1):13-19.
[4] Cloft HJ,Jensen ME. Kyphoplasty: an assessment of a new technology[J]. AJNR Am J Neuroradiol,2007,28(2):200-203.
[5] Li KC,Li AF,Hsieh CH,et al. Another option to treat Kümmell’s disease with cord compression[J]. Eur Spine J,2007,16(9):1479-1487.
[6] Huskisson EC. Measurement of pain[J]. Lancet,1974,2(7889):1127-1131.
[7] Fairbank JC. Use and abuse of Oswestry Disability Index[J].Spine (Phila Pa 1976),2007,32(25):2787-2789.
[8] Steel HH. Kümmell’s disease[J]. Am J Surg,1951,81(2):161-167.
[9] Mirovsky Y,Anekstein Y,Shalmon E,et al. Vacuum clefts of the vertebral bodies[J]. AJNR Am J Neuroradiol,2005,26(7):1634-1640.
[10] Benedek TG,Nicholas JJ. Delayed traumatic vertebral body compression fracture; part II: pathologic features[J]. Semin Arthritis Rheum,1981,10(4):271-277.
[11] Stojanovic J,Kovac V. Diagnosis of ischemic vertebral collapse using selective spinal angiography[J]. Rofo,1981,135(3):326-329.
[12] Yu CW,Hsu CY,Shih TT,et al. Vertebral osteonecrosis: MR imaging findings and related changes on adjacent levels[J]. AJNR Am J Neuroradiol,2007,28(1):42-47.
[13] Kim DY,Lee SH,Jang JS,et al. Intravertebral vacuum phenomenon in osteoporotic compression fracture: report of 67 cases with quantitative evaluation of intravertebral instability[J]. J Neurosurg,2004,100(1 Suppl Spine):24-31.
[14] Kim HS,Lee SK,Kim SW,et al. Chronic Spinal Epidural Hematoma Related to Kummell’s Disease[J]. J Korean Neurosurg Soc,2011,49(4):231-233.
[15] Freedman BA,Heller JG. Kummel disease: a not-so-rare complication of osteoporotic vertebral compression fractures[J]. J Am Board Fam Med,2009,22(1):75-78.
[16] Ma R,Chow R,Shen FH. Kummell’s disease: delayed post-traumatic osteonecrosis of the vertebral body[J]. Eur Spine J,2010,19(7):1065-1070.
[17] 薛峰,陈兵乾,盛晓文,等. 经皮椎体后凸成形术治疗骨质疏松性椎体骨折[J].脊柱外科杂志,2010,8(1):44-46.
[18] Wang G,Yang H,Chen K. Osteoporotic vertebral compression fractures with an intravertebral cleft treated by percutaneous balloon kyphoplasty[J]. J Bone Joint Surg Br,2010,92(11):1553-1557.

