绿贻贝贝壳的微结构特征及光谱分析
鲍林飞,高 鹏,赵鲁苹,徐焕志,陈 东,廖 智
(1.浙江海洋学院海洋科学与技术学院,海洋生物资源及分子工程实验室,浙江舟山 316022;2.浙江海洋学院石油与能源工程学院,浙江舟山 316022)
绿贻贝贝壳的微结构特征及光谱分析
鲍林飞1,高 鹏1,赵鲁苹1,徐焕志1,陈 东2,廖 智1
(1.浙江海洋学院海洋科学与技术学院,海洋生物资源及分子工程实验室,浙江舟山 316022;2.浙江海洋学院石油与能源工程学院,浙江舟山 316022)
贻贝贝壳是一种由碳酸钙晶体和少量有机质形成的高度有序的天然纳米复合材料,历来是生物材料、组织工程以及仿生学研究的重要对象。利用扫描电子显微镜、傅里叶红外光谱分析以及X射线衍射分析等,对绿贻贝贝壳的微观结构、碳酸钙晶体构型以及有机质结构特征进行分析。绿贻贝贝壳主要包含珍珠质(Nacre)层和肌棱柱层;两者的碳酸钙晶体构型均采取了文石构型;在后闭壳肌-贝壳连接部位,肌肉与贝壳碳酸钙晶体之间由一层有机质膜连接且该膜质地明显区别于珍珠质层表面的膜。绿贻贝各层结构中的蛋白质均以β-折叠为优势构象,但是肌棱柱层中蛋白质的β-折叠含量较珍珠质层高。
绿贻贝;贝壳;扫描电子显微镜;傅里叶红外光谱;X射线衍射
双壳贝类的贝壳以其优异的力学性能以及良好的生物相容性历来是仿生学与生物材料的研究热点之一[1-2]。贝壳的主要成分为碳酸钙晶体(占95%以上),以及少量蛋白质(主要为贝壳基质蛋白)、几丁质等有机质成分[3-5],上述物质通过有机相-无机相之间的分子识别与组装,形成一种天然的分子或纳米聚合体并由此赋予了贝壳超强的韧性和强度[6]。
双壳贝类的贝壳通常包含两部分,分别为贝壳外表面的角质层(Periostracum,主要成分为贝壳硬蛋白)以及贝壳内部的碳酸钙晶体层。其中,碳酸钙晶体层为贝壳的主体部分。碳酸钙晶体的构型主要有三种,分别为文石(Aragonite)、方解石(Calcite)和球霰石(Vaterite);组成贝壳的碳酸钙晶体主要表现为文石构型和方解石构型[7]。不同贝类物种其贝壳中的碳酸钙晶体会呈现不同的微结构形态以及层次排列特征[8]。CARTER等人对双壳贝类贝壳结构中的各种碳酸钙晶体微结构进行了分类,根据其外貌形态和晶体构型的不同,可以分为珍珠质层(Nacre)、肌棱柱层(Myostracum)、斜棱柱层(Fibrous prismatic)、球棱柱层(Spherulitic prismatic)、均质层(Homogeneous)、复杂交叉状层(Complex crossed lamellar)以及交叉板状层(Intersected crossed platy)等七类。
目前,对贝壳的结构研究主要集中在珍珠质层,包括其结构形貌、生物矿化机制、力学性能以及仿生应用研究等。研究对象多集中在产珍珠的贝类以及紫贻贝等。绿贻贝Perna canaliculus又称新西兰贻贝或青口[9],属于贻贝科Mytilidae、股贻贝属Perna,是一种体型较大的贻贝,其贝壳具有较好的强度和韧性,但有关其贝壳结构的研究目前报道尚不多见。本研究以绿贻贝为研究对象,利用扫描电子显微镜(SEM),傅里叶红外光谱(FTIR)以及X射线衍射(XRD)等技术手段,对其贝壳的微观结构特征以及光谱特征开展分析,重点比较了后闭壳肌-贝壳连接部位的肌棱柱层(Myostracum,M)与非肌肉连接部位的珍珠质层(Nacre,N)的微结构与光谱特征,为深入了解肌肉-贝壳连接界面的分子连接机理奠定基础。
1 材料与方法
1.1 贝壳样品处理
成年绿贻贝由广东海洋大学水产学院梁海鹰教授鉴定并馈赠。新鲜绿贻贝去除软组织,获取其完整贝壳,以5%NaOH处理去除贝壳的角质层和附着的各种污染物后以去离子水清洗、晾干,-20℃冰箱保存。贝壳的脱钙采用酸溶法[10],将贝壳样品浸入5%醋酸溶液,至pH为4.2并稳定不变时表明脱钙完成;贝壳的脱蛋白采用碱溶法[10],将贝壳样品浸入20%NaOH溶液,在65℃水浴1 h。经脱钙或脱蛋白处理的贝壳样品以去离子水清洗干净后晾干备用。
1.2 SEM观察
贝壳样品沿后闭壳肌痕部位(Adductor muscle scar,AMS)生长轴中线断开(图1a),横断面以去离子水清洗后,置于超声波清洗仪,超声处理10min以清洁断面。扫描电子显微镜为捷克TESCAN大扫描室VEGA3型,电压为20 kV。
1.3 FTIR分析
以不锈钢手术刀从贝壳内表面不同部位刮取表层粉末。其中,肌棱柱层从后闭壳肌痕部位表层刮取,后闭壳肌痕前具珍珠色泽区域表层为珍珠质层。所刮取的粉末样品在玛瑙研钵中进一步研磨至粒径200目。粉末样品和磨细的KBr粉末按质量比约1∶100在玛瑙研钵中研磨混合均匀,采用透射模式测量;分析仪器为美国Nicolet Nexus 670 FTIR分光光度计,扫描范围400~4 000 cm-1,扫描次数32,分辨率为4 cm-1。红外谱图采用仪器附带的Omnic软件(版本8.2.387)进行分析处理。
1.4 XRD分析
X射线衍射分析采用日本RIGAKU Ultima IV型XRD仪。采取原位分析,扫描区域分别为珍珠质层区和后闭壳肌痕部位的肌棱柱层,电压为40 kV,扫描范围10°~80°,扫描速度2°/min。
2 结果
2.1 绿贻贝贝壳断面结构特征
通过扫描电镜观察,绿贻贝贝壳断面结构主要包含两种类型的层次结构,分别为珍珠质层(Nacreous layer)和肌棱柱层(Myostracum layer)。两者具有明显不同的外部形貌特征,其中珍珠质层呈典型的“板砖结构”,由整齐堆叠的片层(Tablet)构成,其片层厚度为0.4~0.5 μm(图1b);肌棱柱层为垂直于贝壳内表面的柱状结构,其高度约为3 μm(图1c);在后闭壳肌痕部位,肌肉组织直接与肌棱柱层相连接,在肌棱柱层下方为珍珠质层。在后闭壳肌痕前端(anterior side apart from AMS,AMS-A)无肌肉连接部位,可观察到肌棱柱层包埋于珍珠质层内部(图1b);而在后闭壳肌痕后端贝壳边缘部位(posterior side apart from AMS,AMS-P),仅观察到珍珠质层,肌棱柱层消失(图1d)。

图1 绿贻贝贝壳后闭壳肌痕(AMS)及其附近部位(包括后闭壳肌痕前端和后端,分别为AMS-A和AMS-P)断层的扫描电子显微镜图谱(a)绿贻贝贝壳内表面,粗线示断裂位置;(b)-(d)分别展示绿贻贝AMS-P,AMS和AMS-A区域的断面结构。“N”代表珍珠质层(Nacre);“M”代表肌棱柱层(Myostracum);“AM”代表后闭壳肌(adductor muscle).Fig.1 The photograph of interior surface and SEM images of cross-section of P.canaliculus shell including AMS area(a)the photograph of inner surface of an adult P.canaliculus.Thick line denotes the cutting plane;(b)the SEM image of section of the posterior side apart from AMS (AMS-P);(c)the SEM image of section of central AMS;(d)the SEM image of section of the anterior side apart from AMS (AMS-A).“N”,”M”,and“AM”represent Nacre,Myostracum,and Adductor muscle,respectively.
2.2 绿贻贝贝壳内表面结构特征
绿贻贝贝壳内表面肉眼可明显观察到两种不同质地的表面结构,包括颜色较浅且具珍珠质光泽的区域(N)、颜色较深不具珍珠质光泽的后闭壳肌痕区域(AMS)(图1a,图2a)。结合图1b-d,可判断N区为珍珠质层表面,AMS区为肌棱柱层表面。在扫描电镜下,珍珠质层表面和后闭壳肌痕区表面均可观察到一层有机质膜,但两者质地明显不同,珍珠质层区表面较为粗糙,并散布有白色无定形结构(图2b);后闭壳肌痕区则表面较为光滑,可观察到少量纳米级孔穴分布于表面(图2c);在后闭壳肌痕边缘部位,即珍珠质层与肌棱柱层相连部位,可观察到两种不同质地的表面结构的过渡区域(图2d);而在后闭壳肌痕肌肉连接部位,可观察到后闭壳肌的肌纤维与贝壳内表面的有机质膜连为一体,形成一种紧密的连接(图2e)。

图2 绿贻贝贝壳内表面扫描电子显微镜图谱.(a)绿贻贝贝壳内表面,“N”,“TZ””AMS”和“AM”分别代表珍珠质层区表面,过渡区,后闭壳肌痕区表面和后闭壳肌.(b)珍珠质层表面结构;(c)后闭壳肌痕区表面结构;(d)过渡区表面结构;(e)后闭壳肌与贝壳的连接界面.Fig.2 Surface image of internal surface of P.canaliculus shell(a)the inner surface image of natural shell of P.canaliculus;“N”,“TZ”,“AMS”,and“AM”represent Nacre,Transition zone,Adductor Muscle Scar,and Adductor muscle,respectively;(b)the SEM image of surface of nacre surface;(c)the SEM image of surface of AMS;(d)the SEM image of surface of Transition zone;(e)the SEM image of junction between adductor muscle and shell.
2.3 绿贻贝贝壳各层的FTIR光谱特征
从绿贻贝贝壳内表面分别刮取各层粉末样品经FTIR分析,结果如图3所示。绿贻贝珍珠质层、肌棱柱层的FTIR光谱类似,其碳酸钙晶体特征峰明显。根据DAUPHIN等[11]的描述,波数值1 082 cm-1代表CO32-的对称伸缩振动峰(υ1);854 cm-1代表CO32-的面外弯曲振动峰(υ2);1 442 cm-1代表CO32-的反对称伸缩振动峰(υ3);714 cm-1和699 cm-1代表CO32-的面内弯曲振动峰(υ4)。上述波数值均可在珍珠质层和肌棱柱层样品的FTIR光谱中找到,表明碳酸钙晶体是该两层机构的主体部分。此外,珍珠质层的肌棱柱层均在波数值1 650 cm-1和1 784 cm-1处出现吸收峰(图3a),该区域代表N—H面内弯曲振动和C—N伸缩振动模式,分别属于酰胺一带和酰胺二带的振动频率范围,表明肌棱柱层和珍珠质层均含有少量蛋白质成分。比较不同层次的碳酸晶体特征峰,我们发现,珍珠质层和肌棱柱层样品的FTIR光谱存在部分差异(图3a)。例如珍珠质层的υ1(1 085.21)和υ2(857.19)与肌棱柱层相比发生了微量蓝移;此外,肌棱柱层的样品在2 399.80和2357.43 cm-1处出现明显吸收峰,推测为少量几丁质成分造成的特征吸收峰。

图3 绿贻贝贝壳珍珠质层和肌棱柱层粉末样品的FTIR光谱(a)以及原位XRD图谱(b)星号代表酰胺二带,双星号代表酰胺一带Fig.3 FTIR(a)and XRD(b)spectra of nacreous layer(N)and myostracum layer(M)from P.canaliculus shell. "*"and double"*"represent amide II,and amide I,respectively
进一步对绿贻贝各层样品的FTIR光谱进行解析和归属,参照SUREWICZ等[12]以及DONG等[13]的方法,选取FTIR光谱中的酰胺一带(1 600~1 700 cm-1),经两点基线校正及平滑处理后,通过去卷积和二阶导数进行分峰,计算各子峰的峰位和半峰宽,手动选定峰位和峰宽,采用Gausse函数拟合,根据各子峰的积分面积计算各种二级结构的相对百分含量。傅里叶去卷积分峰图如图4,分析结果见表1。由表1可见,肌棱柱层在蛋白质的二级结构分布上与珍珠质层存在差异,其中,肌棱柱层样品α-螺旋以及β-折叠的含量均高于珍珠质层样品,但其β-转角含量较低,这表明珍珠质层与肌棱柱层在蛋白质组成方面有明显差别。

图4 绿贻贝贝壳珍珠质层(a)和肌棱柱层(b)样品FTIR光谱酰胺一带傅里叶去卷积分峰图Fig.4 Fourier self-deconvolved FT-IR spectra of amide I bands of the intracrystalline proteins obtained from each shell layer:(a) Nacre layer;(b)Myostracum layer.The experimental spectra(dotted line)and individual Gaussian components(solid line)are depicted.
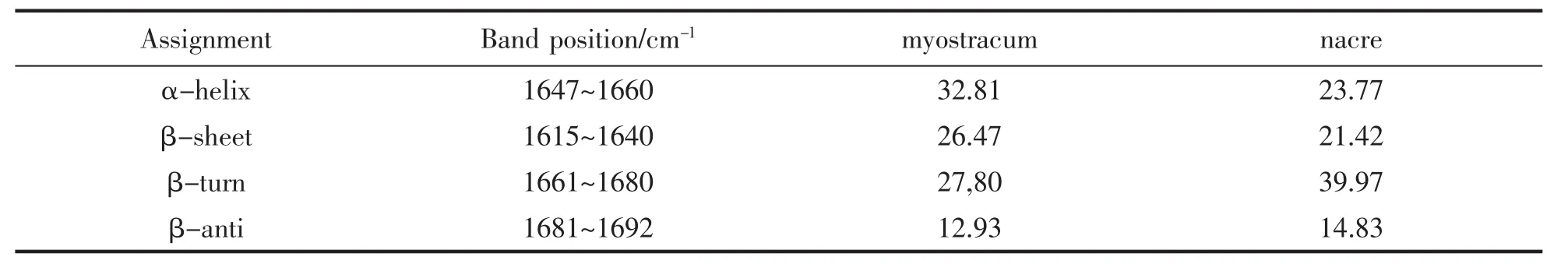
表1 绿贻贝珍珠质层和肌棱柱层蛋白质二级结构含量分析Tab.1 Secondary structure of the intracrystalline proteins of each layer in vitro:"N"and"M"represent Nacre and Myostracum layer,respectively
2.4 绿贻贝各层粉末样品的XRD分析
绿贻贝各层经XRD原位分析,结果如图3 b。由图可见,绿贻贝贝壳中珍珠质层和肌棱柱层的XRD谱峰形尖锐,表明其结晶度良好。两者谱图类似,均在(002)、(012)、(004)、(014)等晶面出现与标准文石碳酸钙晶体(PDF#41-1475)具基本吻合的特征衍射峰,表明珍珠质层和肌棱柱层的碳酸钙晶体采取了文石晶型。
3 讨论
绿贻贝属双壳贝类贻贝科,通过扫描电子显微镜观察,绿贻贝贝壳微结构主要包括珍珠质层和肌棱柱层两种类型。其排列次序由内至外分别为珍珠质层-肌棱柱层-珍珠质层,但在后闭壳肌痕部位,微结构排列次序由内至外分别为肌棱柱层-珍珠质层;而在贝壳边缘部位,肌棱柱层消失,仅留下珍珠质层。根据DAUPHIN等的描述,结合绿贻贝贝壳的FTIR分析结果,绿贻贝贝壳的珍珠质层和肌棱柱层的FTIR光谱中出现典型的文石型碳酸钙晶体的特征峰(υ1:1 082 cm-1;分裂的υ4:712 cm-1和699 cm-1)(图3),表明绿贻贝贝壳的珍珠质层和肌棱柱层的碳酸钙晶体构型主要为文石型 (Aragonite);XRD分析结果进一步确认了上述各层微结构的碳酸钙晶体构型(图5)。
研究表明,不同属的贻贝贝壳的微结构存在较大差别,例如,贻贝属的紫贻贝Mytilus edulis以及地中海贻贝M.galloprovincialis的贝壳微结构中含有大量方解石构型的斜棱柱层(Fibrous prismatic layer)结构[14-15];而股贻贝属的翡翠贻贝贝壳微结构中则不含斜棱柱层[16-17],且贝壳中不含方解石构型的碳酸钙晶体。绿贻贝为股贻贝属,其贝壳微结构与翡翠贻贝类似,而与紫贻贝、地中海贻贝等有明显区别,这表明不同属间的贻贝贝壳在微结构以及碳酸钙晶体组成方面存在较大差异,但两属贝壳在力学性能上的差异尚需进一步研究。
贝壳碳酸钙晶体的形成主要由贝壳内的有机物,特别是贝壳基质蛋白所控制[18]。贝壳中的有机质成分控制了碳酸钙晶体的成核和生长方向,并赋予贝壳足够的韧性和强度[19-20]。从绿贻贝各层样品的FTIR光谱特征来看,其有机质主要包含蛋白质成分。贝壳蛋白质成分通常可分为可溶性蛋白(通常指可溶于醋酸或者EDTA溶液)与不可溶性蛋白两部分。其中,可溶性蛋白被认为与碳酸钙晶体的物相转换和生长定向有关,而不溶性蛋白则作为贝壳形成的框架,为贝壳中碳酸钙晶体的成核、生长提供结构支持[21,22]。FTIR在定量蛋白质二级结构方面具有高灵敏度和高准确度的优势[23-24]。利用FTIR光谱结合去卷积和二阶导数分析,可对贝壳中不同微结构样品中的蛋白质二级结构进行含量分析[12-13]。分析结果表明,绿贻贝贝壳肌棱柱层蛋白质α-螺旋和β-折叠的含量较高,但β-转角含量较珍珠质层低。不同物种的贝类贝壳在蛋白质二级结构含量方面差异较大,例如,牡蛎Crassostrea gigas贝壳中各层次蛋白质二级结构中,肌棱柱层蛋白质二级结构中β-折叠的含量为最高,超过50%[25]。此前,人们已经注意到贝壳基质蛋白中酸性氨基酸含量较高。LWAIS等[24]提出,富含酸性氨基酸的蛋白质多肽链倾向于形成β-折叠结构。对不同贝类的贝壳基质蛋白研究均发现,贝壳基质蛋白高含量的β-折叠结构不仅使得其序列中的酸性氨基酸形成规则性排列从而有利于与Ca2+离子的结合,同时有利于对碳酸钙晶体的生长施加影响。
贝类中贝壳与闭壳肌的连接涉及到无机相-有机相的相互作用,但其连接机理目前尚不清楚。TOMPA等[26]采用透射电镜对对鹦鹉螺的中柱肌-壳连接界面(columellar muscle-shell attachment)进行观察,认为在肌肉细胞与壳之间存在一层肌腱细胞(tendon cell),而肌腱细胞通过有机质纤维(organic fibers)与壳连接,且该有机质纤维可插入壳内部。NAKAHARA等[27]研究了射肋珠母贝Pinctada radiata的闭壳肌-贝壳连接界面,发现在肌肉细胞与壳之间存在一层有机质膜,在此基础上,并提出了肌肉-膜-壳连接模型(muscle-membrane-shell)。此后,SHIMEK等[28]对蜗牛Nautilus pompilius的中柱肌-壳连接界面进行了透射电镜观察,提出了类似的连接模型。双壳贝类的闭壳肌与贝壳之间的连接极为牢固,例如,GALTSOFF等[29]报道,太平洋牡蛎CRASSOSTREA VIRGINICA的贝壳在紧闭状态时,需要超过10 kg的拉力才能使其分开,这种牢固的连接力不仅来自于闭壳肌强大的收缩力,同时也与闭壳肌和贝壳之间强大的连接作用力有关。目前对于双壳贝类中贻贝科闭壳肌-贝壳连接机理的研究尚不多见,仅SONG等[15]对地中海贻贝的后闭壳肌痕区域进行过扫描电镜观察并提出在后闭壳肌与贝壳之间存在纤维状有机物质连接。通过对绿贻贝贝壳后闭壳肌痕部位的扫描电镜观察,我们发现后闭壳肌与肌棱柱层相连;肌棱柱层所采取的文石型晶体构型(较方解石构型更为稳定)以及垂直于贝壳表面的柱状排列赋予了肌肉-贝壳连接界面更强的抗拉伸力和连接强度;同时,在肌棱柱层表面可观察到一层光滑的有机质膜存在,且该层膜结构与非肌肉连接区域珍珠质层表面的膜结构在质地上有明显区别(图2),后闭壳肌肌纤维直接与该膜状物相连,推测该层膜参与了肌肉-贝壳的连接。此外,FTIR分析也表明,在后闭壳肌痕部位的肌棱柱层在有机质组成以及蛋白质二级结构含量方面与非肌肉连接部位的珍珠质层有较明显的区别,预示着肌棱柱层中可能存在其所特有的参与肌肉-贝壳连接的的蛋白质;在上述研究基础上,我们认为绿贻贝后闭壳肌-贝壳连接界面可能也采取了肌肉-膜-壳连接模型,但该层有机质膜的具体分子组成以及在介导无机相-有机相连接界面过程中的机理尚需进一步研究。
[1]ALBECK S,ADDADI L,WEINER S.Regulation of calcite crystal morphology by intracrystalline acidic proteins and glycoproteins[J].Connective Tissue Research,1996,35:365-370.
[2]SELLINGER A,WEISS P M,NGUYEN A,et al.Continuous selfassembly of organic-inorganic nanocomposite coatings that mimic nacre[J].Nature,1998,394:256-260.
[3]LEE S W,JANG Y N,RYU K W,et al.Mechanical characteristics and morphological effect of complex crossed structure in biomaterials:fracture mechanics and microstructure of chalky layer in oyster shell[J].Micron,2011,42:60-70.
[4]WEINER S,TRAUB W.X-ray diffraction study of the insoluble organic matrix of mollusk shells[J].FEBS Lett,1980,111:311-316.
[5]CURREY J D.The design of mineralised hard tissues for their mechanical functions[J].J Exp Biol,1999,202:3 249-3 285.
[6]CHECA A G,RODRIGUEZ-NAVARRO A B.Self-organisation of nacre in the shells of Pterioida(Bivalvia:Mollusca)[J].Biomaterials,2005,26:1 071-1 079.
[7]MANN S.Biomineralization Principles and Concepts in Bioinorganic Materials Chemistry[M].New York,NY,USA:Oxford University Press,2001.
[8]TAYLOR J D,REID D G.Shell microstructure and mineralogy of the Littorinidae:ecological and evolutionary significance[J]. Hydrobiologia,1990,193:199-215.
[9]CARTER J G.Shell microstructural data for the Bivalvia[M].New York:Van Nostrand Reinhold and Co,1990.
[10]SILVIA M D P,MARINA S.Studies on molluscan shells:Contributions from microscopic and analytical[J].Methods Micron, 2009,40:669-690.
[11]DAUPHIN Y.Infrared spectra and elemental composition in recent biogenic calcites:relationships between the υ4 band wavelength and Sr and Mg concentrations[J].Appl Spectrom,1999,53:184-190.
[12]SUREWICZ W K,MANTSCH H H.New insight into protein secondary structure from resolution-enhanced infrared spectra[J]. Biochim Biophys Acta,1988,952:115-130.
[13]DONG A,HUANG P,CAUGHEY W S.Protein secondary structures in water from second-derivative amideI infrared spectra [J].Biochemistry,1990,29:3 303-3 308.
[14]TAYLOR J D,KENNEDY W J,HALL A.The shell structure and mineralogy of the Bivalvia[M].Bulletin of the British Museum(Natural History),1969.
[15]SONG Y F,LU Y,DING H B,et al.Structural Characteristics at the Adductor Muscle and Shell Interface in Mussel[J].Appl Biochem Biotechnol,2013,171:1 203-1 211.
[16]张刚生,汪 港,张伟钢.翡翠贻贝贝壳文石的FTIR光谱研究[J].光谱实验室,2007,24(5):890-901.
[17]李青梅,黄增琼,李浩璇,等.翡翠贻贝贝壳的微结构研究[J].广西大学学报:自然科学版,2011,36:882-886.
[18]SARIKAYA M,AKSAY I A.Biomimetics:design and processing of materials[M].New York AIP Press,1995.
[19]LOWENSTAM H A.Minerals formed by organisms[J].Science,1981,211:1 126-1 131.
[20]MANN S.Molecular recognition in biomineralization[J].Nature,1988,332:119-124.
[21]STUPP S I,BRAUN P V.Molecular manipulation of microst ructures:biomaterials,ceramics,and semiconductors[J].Science, 1997,277:1 242-1 248.
[22]BELCHER A M,WU X H,CHRISTENSEN R J,et al.Control of crystal phase switching and orientation by soluble mollusk shell proteins[J].Nature,1996,381:56-58.
[23]HARIS P I,CHAPMAN D.Analysis of polypeptide and protein structures using Fourier transform infrared spectroscopy[J]. Methods Mol Biol,1994,22:183-202.
[24]LEWIS P N.MOMANY F A,SCHERAGA H A.Folding of polypeptide chains in proteins:a proposed mechanism for folding [J].Proc Natl Acad Sci,1971,68:2 293-2 297.
[25]CHOI C S,KIMY W.A study of the correlation between organic matrices and nanocomposite materials in oyster shell formation[J].Biomaterials,2000,21:213-222.
[26]TOMPA A S,WATABE N.Ultra-structural investigation of the mechanism of muscle attachment to the gastropod shell[J]. Jounal of Morphology,1976,149:339-352.
[27]NAKAHARA H,BEVELANDER G.An electron microscope study of the muscle attachment in the mollusk Pinctada radiate[J]. Texas Report on Biology and Medicine,1970,28:279-286.
[28]SHIMEK R L,STEINER G.Scaphopoda.Microscopic Anatomy of Invertebrates,Mollusca II[M].New York:Wiley-Liss,1997.
[29]GALTSOFF P A.The American oyster.Fish and Wildlife Service.U.S.Government Printing Office.1964.
Microstructural Characteristics and FTIR Analysis of the Shell from Green Mussel(Perna canaliculus)
BAO Lin-fei,GAO Peng,ZHAO Lu-ping,et al
(Laboratory of Marine Biological Resources and Molecular Engineering,Marine Science and Technology School Zhejiang Ocean University,Zhoushan 316022,China)
For understanding the microstructural characteristics of mussel shell correlating to muscle-shell attachment,the microstrcuture,polymorph,and organic matrix of adductor muscle attached scar(AMS)and non-muscle attached zone in the adult Perna canaliculus shell were investigated and compared.The adductor muscle scar has a hierarchically complex multilayer composed of organic matrix and two distinct mineral layers,including nacre and myostracum layer.Fourier Transform Infrared Spectroscopy(FTIR)and X-Ray Diffraction (XRD)results showed that the inorganic compounds of both nacre and myostracum layer are composed of aragonite.The adductor muscle attaches to the myostracum layer through an organic film and forms a musclefilm-shell junction.The film adheres firmly to the myostracum layer surface and shows a very smooth texture,which is deferent with the film on nacre surface.The amide region of FTIR spectra from decalcified shell samples was analyzed and we showed that the shell proteins in vivo are in the higher structural ordered state,and β-parallel structure was predominant in both shell layer.
Perna canaliculus;shell;SEM;FTIR;XRD
TB332;O657.33
A
1008-830X(2014)04-0347-07
2014-04-20
浙江省自然科学基金项目(LY14C100001)
鲍林飞(1988-),男,研究方向:海洋生物活性蛋白质结构域功能.
廖智.E-mail:liaozhi@zjou.edu.cn

