柱前衍生高效液相色谱法测定食品接触用纸制品中乙二醛含量
朱晓艳,吴 倩,史红兰,肖道清,曹国洲
(宁波检验检疫科学技术研究院,浙江宁波 315012)
柱前衍生高效液相色谱法测定食品接触用纸制品中乙二醛含量
朱晓艳,吴 倩,史红兰,肖道清,曹国洲
(宁波检验检疫科学技术研究院,浙江宁波 315012)
建立了柱前衍生-高效液相色谱法测定食品接触用纸制品中乙二醛含量的方法。纸制品中的乙二醛用水溶液萃取后与5,6-二氨基脲嘧啶(DDP)反应生成2,4-二氧四氢蝶。该反应简单、快速、且无副反应。衍生产物通过高效液相色谱法分离荧光检测器(激发波长330nm,发射波长460 nm)测定。通过对衍生化条件的优化,反应可在40℃,15 min的碱性介质中完成。在给定条件下,乙二醛衍生物的保留时间为7.0 min,在质量浓度0.1~20 mg/L内呈良好线性关系,回收率在90.3%~105.8%之间,检出限(S/N=3)为0.01 mg/L。应用此法测定食品接触用纸中的乙二醛迁移量取得满意的结果。
柱前衍生;高效液相色谱法(HPLC);食品接触用纸制品;乙二醛
由于食品用纸具有绿色环保、品种性能丰富等特点,其应用日益广泛,因而越来越受到人们的关注。在某些发达国家,纸包装材料占总包装材料总量的40%~50%,我国占23.50%左右[1]。乙二醛作为原料在造纸工业中应用非常广泛,可提高纸张的湿强度和抗张强度,可作为交联剂提高纸张的表面抗水和耐水性能。国外生产的乙二醛主要应用于高级纸张和餐巾纸、包装纸与商标纸等生产过程中,以提高其防潮性能及增加光泽,其用量约占乙二醛总需求量的40%[1]。但乙二醛具有中等毒性,对眼和鼻粘膜有刺激作用。可引起动物剧吐,慢性中毒可引起胰腺损害[2],也有报道称乙二醛且具有致癌性、致突变等遗传毒性[3]。
因为乙二醛的危害,各国家和地区对乙二醛在不同产品中的限量进行规定。欧盟《成员国关于化妆产品的近似于法律的指令》中规定了化妆品中乙二醛的限量为100 mg/kg[4]。欧盟2009年7月发布的2009/568/EC[5]生活用纸生态标签指令中对生活用纸安全评价做出了明确规定,限制乙二醛含量为1.5 mg/ dm2。德国联邦风险评估(BFR)规定食品接触用纸制品中乙二醛单体的含量不得超过1.5 mg/dm2[6],我国目前还未对食品接触用纸制品中乙二醛的含量进行限定,也无相关的方法来测定食品接触用纸制品中的乙二醛含量。
目前,测定乙二醛的分析方法主要有紫外分光光度法[7-12],高效液相色谱法[3,13-18],容量法[19-20]和化学发光法[21]。这之中常用的是紫外分光光度法和高效液相色谱法。但乙二醛本身无发色基团,因此在使用紫外分光光度法和高效液相色谱法时,需要利用衍生试剂与乙二醛反应生成带发色基团的乙二醛衍生物。常用的衍生试剂有2,4-二硝基苯肼[5,11,14,18]、羟胺[16,22]和2-亚肼基-2,3-二氢-3-甲基苯并噻唑盐(HMBT)[7]。2,4-二硝基苯肼,乙二醛与之反应生成乙二醛腙。但此反应副反应多,产物易相互转化而不易定量。羟胺与乙二醛可生产乙二醛二肟,但产物仅有紫外吸收,不能满足低检出限要求。DIN54603中用2-肼基-2,3-二氢-3-甲基苯并噻唑盐酸进(HMBT)作为衍生试剂,用紫外分光光度法测定,分析步骤繁琐,不适合批量检测。因此寻找一种合适的衍生化试剂和检测方法是解决乙二醛检测问题的关键。本文拟用DDP为衍生试剂用于纸制品中乙二醛的测定,反应速度快,产物单一易于定量,且操作便捷。整个检测分析流程可在半小时内完成,适用于样品的快速分析。
1 材料与方法
1.1 仪器与试剂
1.1.1 主要仪器
高效液相色谱仪,Waters 2695e,美国沃斯特公司;恒温震荡器,SHA-C,国华企业;电子天平,AL104,梅特勒托利多仪器上海有限公司;pH计,S40,梅特勒托利多仪器上海有限公司。
1.1.2 试剂
乙二醛标准品(39.9%,Chemservice);2,4-二氧四氢喋啶标准品(98%,Aldrich化学公司);5,6-二氨基脲嘧啶(简称DDP,分析纯,Sigma-Aldrich);乙腈(HPLC,天津迪马公司);氯化铵(分析纯,国药集团化学试剂有限公司);柠檬酸(分析纯,国药集团化学试剂有限公司);氢氧化钠(分析纯,国药集团化学试剂有限公司);氨水(分析纯,国药集团化学试剂有限公司);除非另作说明,所用试剂均为色谱纯,水为超纯水。
1.2 实验方法
1.2.1 试剂配制
乙二醛标准储备液(1 000 mg/L):准确称取1.253 1 g(±0.5 mg)乙二醛标准溶液于50 mL烧杯,用水稀释转移入500 mL容量瓶,摇匀,定容。此溶液浓度为1 000 mg/L。用水逐级稀释该储备液,可得各级标准溶液。
氯化铵缓冲盐(0.5 mol/L,pH=10):准确称取2.67 g氯化铵(NH4Cl),加超纯水定容至100 mL容量瓶中,再用氨水调节pH至10。
柠檬酸缓冲盐(0.01 mol/L,pH=6):准确称取1.050 g的柠檬酸,加超纯水溶解用氢氧化钠调pH至6,定容至500 mL容量瓶中,再过0.45 μm滤膜过滤,超声。
5,6-二氨基脲嘧啶衍生试剂(下称DDP衍生试剂,400 mg/L):准确称取0.04 g的DDP,移入100 mL棕色容量瓶中,用超纯水溶解,超声,摇匀并定容至刻度,现用现配。
1.2.2 反应原理
乙二醛和过量的5,6-二氨基脲嘧啶(DDP)在碱性介质中进行衍生化反应如图1,形成高荧光二氧四氢喋啶衍生物。乙二醛衍生产物二氧四氢喋啶在高效液相色谱上分离,荧光检测。检测的二氧四氢喋啶即相应的乙二醛的含量。

图1 反应方程式Fig.1 The reaction equation
1.2.3 乙二醛的衍生化方法
取萃取后的样品溶液或乙二醛标准溶液1 mL于25 mL容量瓶中,随后加入0.125 mL的氯化铵盐缓冲溶与400 mg/L的DDP衍生试剂,置于一定温度的水浴锅中进行衍生化反应。反应一段时间后将溶液迅速冷却,加柠檬酸缓冲盐定容至25 mL,过滤,备用。
1.2.4 纸制品中乙二醛的萃取方法
根据EN 645[23]标准将纸剪切成大约1~2 cm2的纸碎片,然后称取10 g(±0.1 g)的纸碎片,随后移入500 mL的磨口锥形瓶,加入200 mL的超纯水于瓶中,置于23±2℃的恒温振荡24 h后将溶液倾倒出,用超纯水清洗留有纸碎片的锥形瓶数次,过滤,将滤液移入250 mL的容量瓶,用超纯水定容至刻度。
1.2.5 色谱条件
色谱柱:Shim-Pak C18柱,250 mm×4.6 mm(内径)×5.0 μm(粒径);
检测器:荧光检测器(Waters 2475),激发波长330 nm,发射波长460 nm;
流动相:乙腈+柠檬酸缓冲盐=3+97;等度洗脱;
肉眼观察并比较各组大鼠牙龈的增生情况,并拍照。然后分离所有大鼠的双侧上颌磨牙及其牙周组织,将样本置于新鲜配制的40 g/L多聚甲醛中固定48 h后,100 g/L乙二胺四乙酸二钠溶液中脱钙30 d,流水下冲洗12 h;依次用700、800、900、950、1 000 mL/L乙醇分别脱水1 h,然后用1 000 mL/L 乙醇再脱水2次,1 h/次;二甲苯透明,石蜡包埋;最后沿牙体长轴按颊舌向作左侧上颌第一磨牙5 μm的连续切片,组织切片烤片30 min后备用。
流速:1.0 mL/min;
柱温:40℃;
进样量:10 μL。
2 结果与讨论
2.1 色谱条件的确定
根据ESPINOSA-MANSILLA等[15]的文献,流动相柠檬酸缓冲溶液:水=(97:3),Zorbax Eclipse XDBC18柱,可分离DDP与2,4-二氧四氢喋啶,实验中发现用Shim-Pak C18柱(250 mm×4.6 mm,5 μm)分离效果更好。故选择Shim-Pak C18柱,改变流动相中乙腈和柠檬酸缓冲盐的的比例发现乙腈越少分离效果越好。但是纯水相对柱子不利,因此选择乙腈:柠檬酸为3:97,在选定的分离条件下,目标峰和衍生试剂DDP可充分分离。目标峰出现时间6.5 min左右。
2.2 衍生化反应介质的pH
取5组10 mg/L的乙二醛标准溶液各吸取1.0 mL至25 mL容量瓶中,分别加入pH值为7、8、9、10、 11的氯化铵缓冲溶液0.125 mL,随后分别加入400 mg/L的DDP试剂1.0 mL,摇匀30 s。在60℃放置100 min后迅速在冰水中冷却。最后用柠檬酸缓冲溶液稀释至刻度并摇匀,过膜,取样品注入高效液相色谱仪。以衍生化后峰面积为指标选择缓冲溶液的pH。
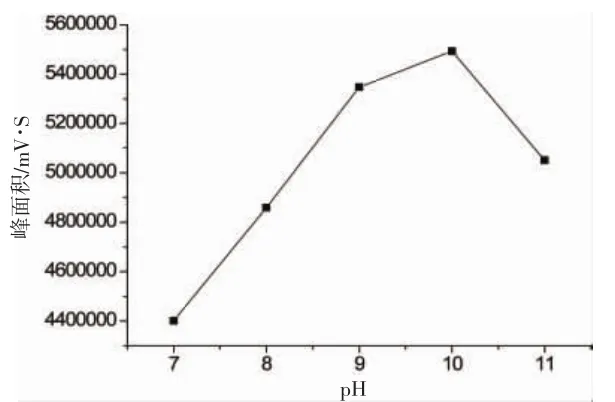
图2 pH对衍生化反应的影响Fig.2 The effect of pH to derivatization
2.3 衍生化反应温度和时间选择
取一系列25 mL容量瓶,分别加入1.0 mL的10 mg/L的乙二醛标准溶液再加入pH为10.0的氯化铵缓冲溶液0.125 mL,随后分别加入400 mg/L DDP试剂1.0 mL,摇匀。分别在5、20、30、40、50℃下各反应1、5、10、15、20、30、40、50、60 min后迅速在冰水中冷却。按方法“1.2.3”操作,所得溶液注入高效液相色谱仪。衍生化反应中温度与时间对衍生化反应的影响如下:以衍生化后峰面积为指标选择衍生化温度和时间。从图3可以看出温度是影响反应的一个重要指标。温度低于20℃时,加热时间在10 min以下,转化率变化明显,加热时间大于20 min以后,反应向趋于稳定,但在选定条件下并不能完全反应,即使反应12 h,转化率还是不能达到100%。30~50℃,衍生反应非常快1 min即可使转化率达97%以上。一方面考虑到反应充分又能快速完成反应,另一方面考虑到乙二醛沸点为50.4℃,过高的温度对精密度有影响。因此本课题选用衍生温度为40℃,衍生化时间为15 min。
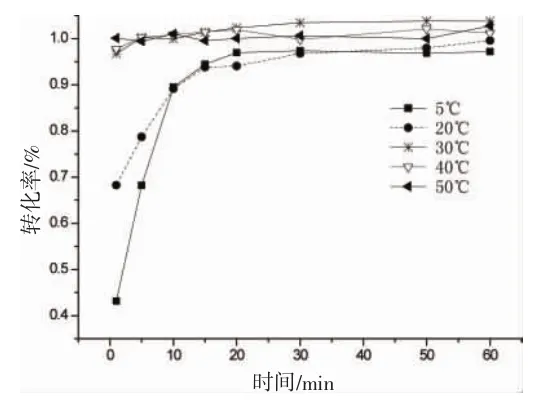
图3 不同温度下乙二醛转化率与加热时间的关系Fig.3 The relationship between conversion rate of glyoxal and heat time under diverse temperature
2.4 乙二醛与DDP的摩尔比
取9组10 mg/L的乙二醛标准溶液各吸取1.0 mL至25 mL容量瓶中,分别加入0.04 mg/L的DDP衍生试剂0.125 mL,0.250 mL,0.500 mL,1.00 mL,1.25 mL,1.50 mL,2.00 mL,2.50 mL,3.75 mL。,随后加入pH值为10的氯化铵缓冲溶液0.125 mL,摇匀30 s,在40℃放置15 min后迅速在冰水中冷却。按方法“1.2.3”操作后,所得溶液注入高效液相色谱仪。在此条件下DDP与乙二醛的摩尔比分别约为1:1,2:1,4:1,8:1,11:1,13:1,17:1,22:1,32: 1。以DDP与乙二醛的摩尔比为X轴,乙二醛衍生物峰面积为Y轴,作图。摩尔比对乙二醛峰面积的影响如图4。
从图4可知随着摩尔比的变大,峰面积快速变大,在4:1到11:1之间达到一个平,随后略有变小。说明随着DDP含量增加,衍生产物变多。但是DDP本身是荧光性物质,过多的DDP可能对产物有淬灭作用,因此在达到平台后,衍生产物峰面积变小。摩尔比在4:1,8:1,11:1时,乙二醛的转化率分别为98.2%、100%、和99.7,说明摩尔比在4:1时已经足够快速反应,考虑到反应的稳定性,本课题选用摩尔比为8:1,即反应时加入400 mg/L的DDP衍生试剂1 mL。
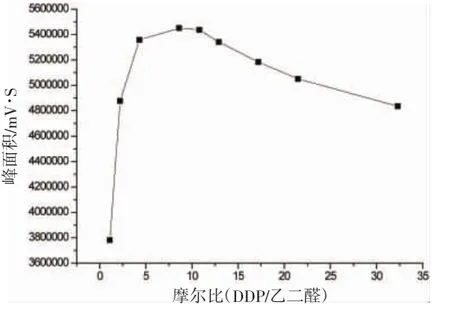
图4 摩尔比(DDP/乙二醛)与乙二醛衍生物峰面积关系Fig.4 The relationship between mole ration(DDP/glyoxal)and peak area of glyoxal derivative
2.5 线性关系与方法学考察
2.5.1 线性范围、检出限及稳定性
移取0.1、1.0、2.0、4.0、10、20 mg/L的乙二醛系列标准溶液。在优化的条件40℃,15 min,pH10下,按方法“1.2.3”进行衍生化,在最佳色谱分离检测条件下测定,乙二醛的线性范围和检出限(S/N=3)如表1所示。标准色谱图如图5所示。
通过连续测定10 mg/L的乙二醛衍生后的产物8次,每次检测间隔为1小时,来评估方法的稳定性。实验表明本方法稳定性好。8次测定的RSD为2.13%。

图5 最佳条件下,10 mg/L乙二醛标准溶液衍生后产物2,4-二氧四氢蝶色谱图Fig.5 Typical chromatogram of lumazine derivatived from 10 mg/L glyoxal standard solution under optimized condition.

表1 线性范围、重现性及检出限Tab.1 Linear range,reproducibility and detection limit
2.5.2 加标回收率试验和精密度
对各种样品萃取液,分别加入低、中、高三个不同含量的乙二醛,进行加标回收率和精密度的试验,结果见表2和表3。由表可知,乙二醛的加标回收率在90.3%~105.8%,精密度在0.7%~3.6%。
3 结论
本方法操作简单,可以用于食品接触用纸制品中乙二醛的快速批量检测,一般纸盘10 g样品的最小面积0.1 dm2,根据本方法操作换算,检出限可达0.025 mg/dm2,最低定量限为0.25 mg/dm2,能满足德国联邦风险评估(BFR)规定食品接触用纸制品中乙二醛单体的含量不得超过1.5 mg/dm2的检测要求。
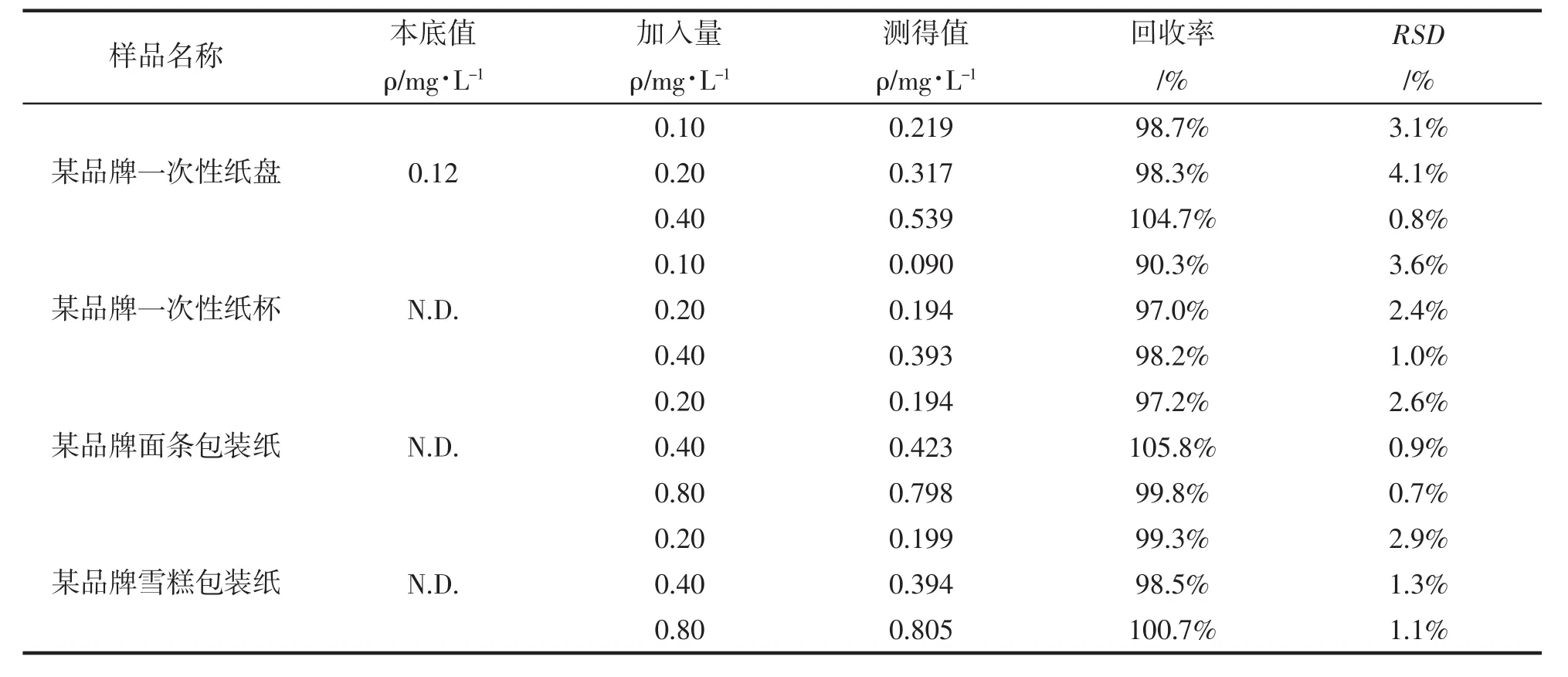
表2 样品的回收率(n=3)Tab.2 Recovery of samples
[1]宋成剑,苏文强.乙二醛在造纸工业中的应用[J].造纸化学品,2009(6):19-23.
[2]张志虎,邵 华.工作场所空气中乙二醛测定方法研究[J].中国公共卫生,2006,22(1):87-88.
[3]王 路,范来富,王迎春,等.乙二醛遗传毒性的研究进展[J].中国工业医学杂志,2004,17(1):43-45.
[4]THE COUNCIL OF THE EUROPEAN COMMUNITIES.COUNCIL DIRECTIVE of 27 July 1976 on the approximation of the laws of the Member States relating to cosmetic products(76/768/EEC).[EB/OL].(2010.3.1)[2014.6.10].http://eur-lex.europa.eu/ LexUriServ/LexUriServ.do?uri=CONSLEG:1976L0768:20100301:en:PDF.
[5]THE COMMISSION OF THE EUROPEAN COMMUNITIES.COMMISSION DECISION of 9 July 2009 establishing the ecological criteria for the award of the Community Eco-label for tissue paper(notified under document number C(2009)4596)(Text with EEA relevance)(2009/568/EC).[EB/OL].(2009.7.29)[2014.6.10].http://eur-lex.europa.eu/legal-content/EN/TXT/PDF/? uri=CELEX:32009D0568(01)&from=EN
[6]Bundesinstitut für Risikobewertung.XXXVI.Paper and board for food contact.[EB/OL].(2013.6.1)[2014.6.10].http://bfr.zadi. de/kse/faces/resources/pdf/360-english.pdf.
[7]NA 074-02-01 AA-Chemisch-technische Prüfverfahren für Papier,Pappe,Faserstoff und Chemiezellstoff.Testing of paper, paperboard and board-Determination of glyoxal content DIN 54603-2008[S].Berlin:DIN Deutsches institute für Normung e. V..:2008.
[8]徐嘉凉,王诚瑜,汤晓东,等.紫外分光光度法测定乙二醛含量的研究[J].分析试验,1998,17(5):41-44.
[9]宋海英,赵地顺,赵 莹,等.紫外分光光度法测定乙二醛溶液中乙二醛的含量[J].河北工业科技,2007,24(5):281-283.
[10]刘树彬,杨建一,张星辰,等.紫外分光光度法同时测定乙醛和乙二醛[J].河北科技大学学报,2010,31(1):22-24.
[11]范富龙,施耀曾,杨士英,等.在乙醛酸等化合物存在下乙二醛测定方法研究[J].南京大学学报,1989,5(2):308-313.
[12]浙江三元纺织有限公司.HG/T 4450-2012纺织染整助剂树脂整理剂中游离乙二醛的测定[S].北京:化工出版社,2013.
[13]ZHANG Zhiyong,ZHAO Dishun,XU Baoyun.Analysis of Glyoxal and Related Substances by Means of High-Performance Liquid Chromatography with Refractive Index Detection[J].Journal of Chromatographic Science 2012:1-6.
[14]UCHIYAMA S,MATSUSHIMA E,TOKUNAGA H,et al.Determination of orthophthalaldehyde in air using,4-dinitrophenylhydrazine-impregnated silica cartridge and high-performance liquid chromatography[J].Journal of Chromatography A,2006,1 116: 165-171.
[15]ESPINOSA-MANSILLA A,DURÁN-MERÁS I,CAÑADA F C,et al.High-performance liquid chromatographic determinationof glyoxal and methylglyoxal in urine by prederivatization to lumazinic rings using in serial fast scan fluorimetric and diode array detectors[J].Analytical Biochemistry,2007,371:82-91.
[16]王依春,黄 健,马继红.高效液相色谱法测定化妆品中乙二醛的方法研究[J].香料香精化妆品,2009(1):6-8.
[17]朱鸭梅,崔 群,王海燕.高效液相色谱法测定乙醛溶液中的乙二醛和乙醛酸[J].色谱,2010,28(1):59-63.
[18]NAKAJIMA K,OHTA K,TOUfiK A,et al.Glyoxal sample preparation for high-performance liquidchromatographic detection of 2,4-dinitro-phenylhydrazone derivative:Suppression of polymerization and mono-derivative formation by using methanol medium[J].Journal of Chromatography A,2007,1 161:338-341.
[19]徐嘉凉,赵 怡,陈 亚,等.乙二醛容量测定法的改进[J].石油化工,1999,28(9):620-631.
[20]全国化学标准化技术委员会.GB 6324.5-2008有机化工产品中羰基化合物含量的测定-容量法[S].北京:中国标准出版社,2008.
[21]方卢秋.高锰酸钾一硫酸体系流动注射化学发光法测定乙二醛的含量[J].重庆师范大学学报,2006,23(1):58-60.
[22]陈红梅,朱春华,杨文杰.分光光度法测定树脂吞整理剂中游离乙二醛[J].印染,2010,23:39-41.
[23]92/39054 DC.BS EN 645:1994 Paper and board intended to come into contact with foodstuffs-preparation of a old water extract.[S].London:Brithish Standard Institution,1994.
Determination of Glyoxal in Food Contact Paper by Highperformance Liquid Chromatography with Precolumn Derivatization
ZHU Xiao-yan,WU Qian,SHI hong-lan,et al
(Ningbo Academy of Inspection and Quarantine,Ningbo 315012,China)
A new method for determining the glyoxal content in food contact paper by HPLC with precolumn derivatization was developed.The glyoxal in the paper extracted by water react with 5,6-diamino-2,4-hydroxypyrimidine sulfate(DDP)to form highly fluorescent lumazine derivatives.The reaction is simple,fast with no byproduts.The glyoxal derivative was separated by HPLC and was determined fluorimetrically at 460 nm (exciting at 310 nm).Under optimized conditions,the reaction was finished with the reagent in alkaline medium,for 15 min at 40℃,and the retention time of the derivatization of glyoxal was 7.0 min,the detector response was found to be linear in the concentration rang 0.05-20.0 mg/L.Recoveries of the glyoxal were in the range of 90.3%-105.8%,limits of detection(S/N=3)was 0.01 mg/L.The proposed method was successfully applied to analyze glyoxal in food contact paper with satisfactory results.
pre-column derivatization;HPLC;food contact paper;glyoxal
TS207.3;O657.7+2
A
1008-830X(2014)04-0358-06
2014-03-25
国家质监总局项目(2011IK036);浙江省分析测试项目(2012C37075)
朱晓艳(1978-),女,高级工程师,硕士研究生,研究方向:食品接触材料检测方法.E-mail:Zhuxy@nbiq.gov.cn

