三维动脉自旋标记诊断环形强化的高级别胶质瘤与脑单发转移瘤
丁芳芳DING Fangfang
全冠民1QUAN Guanmin
袁 涛1YUAN Tao
杨素君2YANG Sujun
三维动脉自旋标记诊断环形强化的高级别胶质瘤与脑单发转移瘤
丁芳芳1DING Fangfang
全冠民1QUAN Guanmin
袁 涛1YUAN Tao
杨素君2YANG Sujun
目的探讨三维动脉自旋标记(3D-ASL)灌注成像鉴别诊断环形强化的高级别胶质瘤(HGG)与脑单发转移瘤的价值,提高两者的鉴别诊断水平。资料与方法48例HGG与38例脑单发转移瘤患者均行常规MRI平扫、3D-ASL灌注成像及MRI增强扫描,测量肿瘤实性区、近瘤周区及镜像区脑血流量(CBF),计算肿瘤实性区及近瘤周区相对CBF(rCBF),比较两组肿瘤实性区及近瘤周区rCBF,确定最佳阈值及其鉴别两种肿瘤的敏感度、特异度。结果HGG与脑单发转移瘤实性区rCBF中位数(四分位数间距)分别为3.612(2.10)、3.123(5.99)(P>0.05)。HGG与脑单发转移瘤近瘤周区rCBF中位数(四分位数间距)分别为1.101(0.90)、0.720(0.28)(P<0.05)。ROC曲线分析显示,当近瘤周区rCBF阈值为0.895时,鉴别HGG与脑单发转移瘤的敏感度与特异度分别为70.8%与84.2%。结论3D-ASL测量肿瘤实性区rCBF对区分环形强化的HGG与脑单发转移瘤无价值,而近瘤周区的rCBF值有助于鉴别两种肿瘤。
脑肿瘤;神经胶质瘤;肿瘤转移;磁共振成像;灌注成像;动脉自旋标记;局部血流;诊断,鉴别
高级别胶质瘤(high grade glioma,HGG)与转移瘤是颅内最常见的恶性肿瘤,两者病程、治疗原则及预后明显不同,常规MRI均可表现为环形强化伴瘤周水肿,30%的脑转移瘤以单发为首发表现[1],缺乏原发瘤病史时,两者鉴别较困难。磁共振灌注成像(MR perfusion weighted image,PWI)作为一种评估脑组织灌注的成像技术,能较敏感地检测组织的血流灌注信息,对脑肿瘤微血管分布及密度情况进行评估,反映病变微结构特性,为脑肿瘤深层评估开辟了新思路。动脉自旋标记(arterial spin labeling,ASL)是一种MR灌注成像方法,利用动脉血中水的氢质子作为内源性示踪剂,采用半定量参数相对脑血流量(relative cerebral blood fow,rCBF)为研究指标,具有安全、无创、可重复性好的优点,在脑肿瘤方面的应用价值已得到初步证实[2],但是其临床应用价值及应用仍处于研究阶段。ASL通过灌注值脑血流量(CBF)间接反映肿瘤微血管密度及分布等微观信息,有可能为影像学鉴别HGG和脑转移瘤提供新途径[1,3]。本文对表现为环形强化的48例脑HGG和38例脑单发转移瘤进行ASL研究,以提高两者的鉴别诊断水平。
1 资料与方法
1.1 研究对象 收集2012-10~2013-12河北医科大学第二医院及邯郸市中心医院经病理检查确诊的48例HGG和38例脑单发转移瘤患者,均符合2007年WHO神经系统肿瘤分类标准[4]。纳入标准:CT或MRI检查均表现为环形强化的单发肿瘤,经手术病理证实诊断,排除坏死、出血及伪影明显者。48例HGG中,男22例,女26例;年龄11~79岁,平均(50.19±15.05)岁;间变性星形细胞瘤(III级)22例,胶质母细胞瘤(IV级)26例。38例脑单发转移瘤中,年龄33~78岁,平均(50.47±15.38)岁;肺癌14例,乳腺癌8例,结肠癌6例,食管癌4例,肾癌6例。两组患者年龄差异无统计学意义(P>0.05)。主要临床症状:头痛78例,呕吐41例,视物模糊37例,偏身感觉障碍及言语不清18例。病理学检查由1名主任医师和1名副主任医师按照2007年WHO神经系统肿瘤组织学分类标准[4]独立做出评价,诊断意见不一致时协商后统一。所有患者均行常规MRI平扫、三维动脉自旋标记(3D-ASL)灌注成像及增强扫描。本研究经医院伦理委员会批准,检查前所有患者均签署知情同意书。
1.2 仪器与方法 采用3.0T MRI扫描仪(GE Discovery MR 750),标准8通道头颅相控阵线圈,行常规MRI平扫及3D-ASL扫描后,经肘静脉团注对比剂钆喷酸葡胺,剂量15 ml,流速1.5 ml/s,注射完毕后5 min行T1WI增强扫描。
常规MRI扫描参数:轴位T1WI(T1-FLAIR序列):TR 1750 ms,TE 25.0 ms,TI 780 ms。轴位T2WI(FSE序列):TR 4257 ms,TE 103.8 ms。轴位T2-FLAIR:TR 8400 ms,TE 148.5 ms,TI 2100 ms,层厚5.0 mm,层间隔1.0 mm,矩阵512×256,视野(FOV)24 cm× 24 cm,激励次数(NEX)1。矢状位T2WI(FRFSE序列):TR 3260 ms,TE 93.2 ms,层厚5.0 mm,层间隔1.0 mm,矩阵384×384,FOV 24 cm×24 cm,NEX 2。增强扫描:轴位、矢状位与冠状位T1WI(3D-FSPGR序列):TR 8.2 ms,TE 3.2 ms,TI 450 ms,层厚1.2 mm,矩阵256×256,FOV 24 cm×24 cm,NEX 1。
3D-ASL(3D Spiral):TR 4632 ms,TE 10.5 ms,TI 1525.0 ms,FOV 24 cm×24 cm,矩阵512×8,层厚4 mm。扫描层数40层,NEX 3,扫描时间4 min 29 s。为保证图像质量,扫描前均行ASSET序列匀场处理。扫描范围包括全脑。
1.3 图像分析 3D-ASL原始图像经ADW 4.5工作站采用Functool软件进行后处理,构建每一层面的CBF伪彩图像。实性区最大rCBF:根据肿瘤各层面CBF伪彩图,在同一层面依据色阶确定肿瘤实性CBF最大区域(红色),采用公认的热点法放置ROI,避开坏死、出血、大血管及伪影明显区域,面积约为30 mm2,每个ROI测量3次,取平均值为肿瘤实性区最大CBF;再复制ROI测量同层面对侧正常脑组织的CBF,获得肿瘤实性区rCBF,计算公式:rCBF=肿瘤实性区最大CBF/同层面对侧正常脑组织CBF。近瘤周区相对CBF:瘤周区定义为常规MR瘤体周围不强化、T2表现为高信号区域[5],由于越邻近实体组织越容易受到肿瘤组织的污染,血管增殖越明显[6],故本研究根据增强T1WI-CBF融合图像,采用热点法选取距离肿瘤强化边缘1 cm处放置瘤周区ROI,即近瘤周区,同上述方法获得近瘤周区rCBF。
1.4 统计学方法 采用SPSS 13.0软件,rCBF数据不符合正态分布,采用中位数及四分位数间距表示,使用非参数检验进行比较,P<0.05表示差异有统计学意义。采用ROC曲线分析确定不同截断点对应的灵敏度和特异度,并选择两者之和最大截断点作为最佳阈值。
2 结果
2.1 HGG与脑单发转移瘤实性区及近瘤周区ASL-rCBF值比较 秩和检验结果显示,HGG与脑单发转移瘤实性区rCBF差异无统计学意义(Z=-0.526,P>0.05);两组肿瘤近瘤周区rCBF差异有统计学意义(Z=-2.776,P<0.05)。见表1及图1、2。

表1 HGG与脑单发转移瘤实性区及近瘤周区rCBF值比较
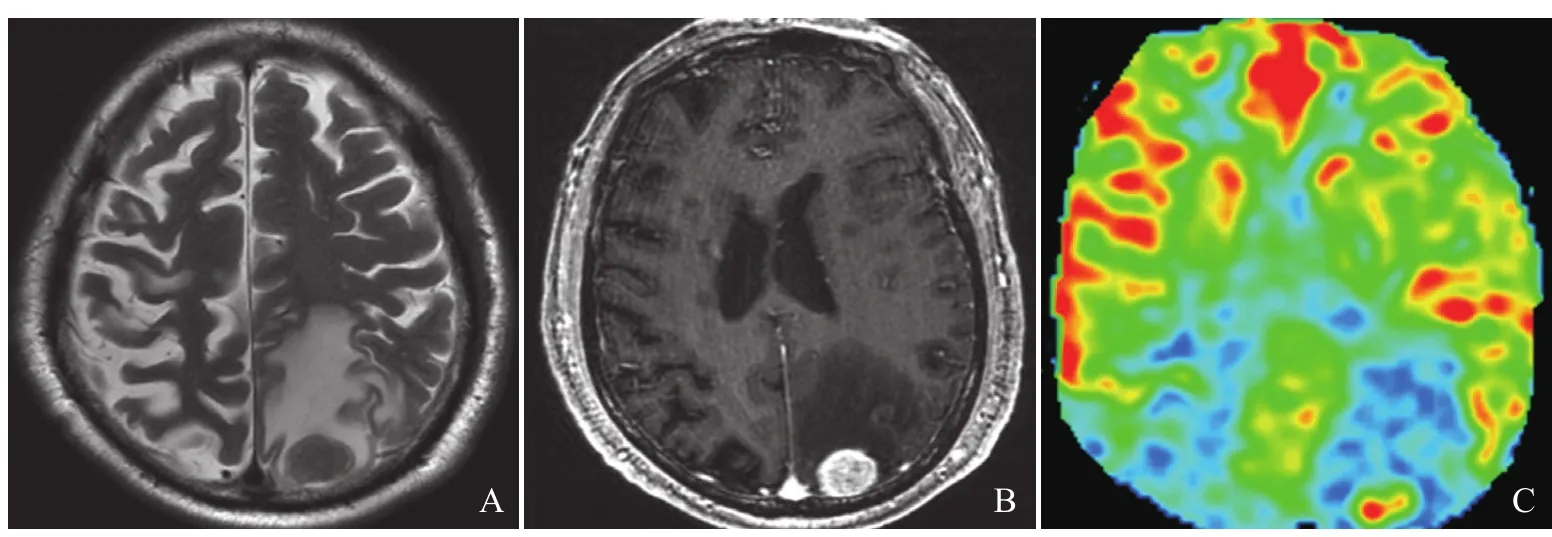
图1 男,69岁,肺癌单发脑转移。T2WI示左顶叶类圆形等信号病灶伴周围高信号(A);增强T1WI示病灶均匀明显强化(B);3D-ASL CBF伪彩图示一类圆形明显高灌注区,周围灌注未见明显增高,rCBF实性为4.98,rCBF瘤周为1.20(C)
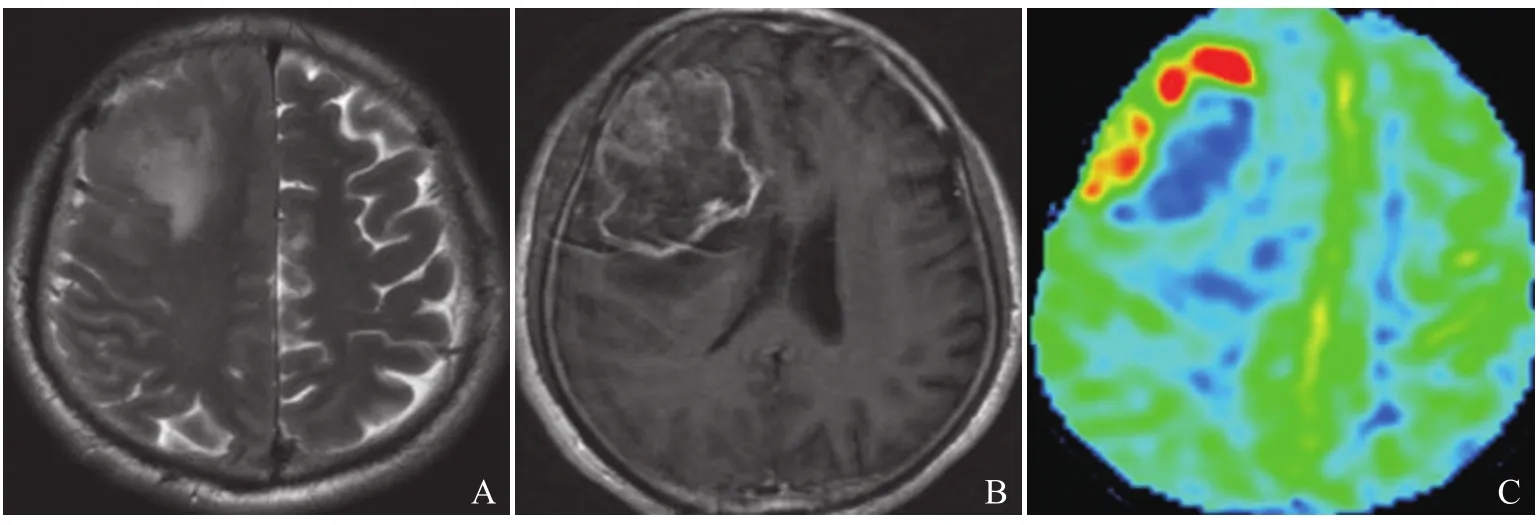
图2 女,42岁,左侧额叶-胼胝体膝部胶质母细胞瘤(IV级)。T2WI示不规则混杂信号病灶伴周围高信号(A);增强T1WI示病变呈明显斑片状强化(B);3D-ASL CBF伪彩图示斑片状明显高灌注,rCBF实性区为4.26,rCBF瘤周区为2.29(C)
2.2 HGG近瘤周区ASL-rCBF的ROC曲线分析 ROC曲线分析结果显示,当rCBF阈值为0.895时,鉴别两种肿瘤的敏感度及特异度分别为70.8%与84.2%,ROC曲线下面积为0.749,见图3。
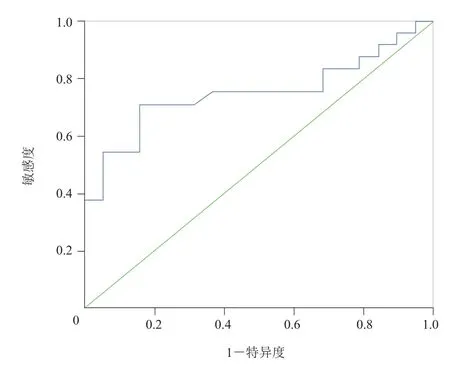
图3 近瘤周区ASL-rCBF值鉴别HGG与脑单发转移瘤的ROC曲线。曲线下面积为0.749,当rCBF阈值为0.895时,鉴别两种肿瘤的敏感度及特异度分别为70.8%及84.2%
3 讨论
ASL从微观层面为HGG及脑单发转移瘤评估微血管密度(microvessel density,MVD),反映肿瘤实性及瘤周血流灌注信息,为鉴别两者开辟了新思路。本组资料显示,根据ASL测定的肿瘤实性区rCBF难以鉴别HGG与脑单发转移瘤,但两种肿瘤近瘤周区rCBF值存在明显差异。
3.1 HGG与脑单发转移瘤的病理基础及常规MRI的局限性 HGG和脑单发转移瘤是脑内最常见的恶性肿瘤,常规MRI均可表现为环形强化,两者均伴不同程度的瘤周水肿,呈长T1、长T2信号[6-8]。肿瘤血管生成及增殖是导致HGG和脑单发转移瘤生长及浸润最重要的因素[5],肿瘤MVD及血管内皮生长因子(vascular endothelial growth factor,VEGF)是评价血管增殖的重要指标。MRI灌注成像血流动力学参数CBF与MVD及VEGF表达具有较好的相关性,为活体影像学检查推测MVD及VEGF表达提供了可能性[9]。MRI灌注包括动态磁敏感对比增强(dynamic susceptibility contrast,DSC)和ASL,DSC法在肿瘤诊断、鉴别及预后评估中的价值已得到广泛认可。Cha等[10]研究证实,DSC鉴别胶质母细胞瘤与脑转移瘤的敏感度可达100%,但是这种灌注成像需要注射外源性对比剂,且必须在对比剂首过时采集数据,不能在短时间内重复检查,对比剂注射受患者肾功能的影响。而ASL灌注以无创性及可重复性强等独特的优势逐渐受到关注,但其价值仍处于研究阶段。目前已有研究探讨了DSC与ASL在肿瘤诊断方面的相关性,并初步证实ASL方法评估脑肿瘤灌注的可行性[11,12]。Järnum等[13]采用ASL和DSC技术对28例脑肿瘤rCBF进行研究,发现两种方法rCBF对脑肿瘤血管灌注评估有很好的相关性(r=0.82,P<0.01)。Lehmann等[14]利用脉冲动脉自旋标记(pulsed arterial spin labeling,pASL)和DSC对27例不同种类脑肿瘤患者进行研究,结果显示,pASL可与DSC一样评价肿瘤血流灌注,两种方法rCBF密切相关(r=0.97,P<0.01)。然而目前关于ASL灌注成像对肿瘤鉴别的研究较少。
3.2 实性区rCBF对HGG与脑单发转移瘤的鉴别诊断本研究采用ASL观察HGG和脑转移瘤rCBF的差异,发现HGG与脑转移瘤实性区中位rCBF值分别为3.612与3.123(P>0.05),与既往DSC研究结论一致。Brandão等[8]采用DSC检查发现HGG与转移瘤实性区灌注程度无明显差异,其原因是HGG具有较多的血管增殖及内皮细胞增生[15-17],新生血管较多,肿瘤新生血管程度与血流灌注呈正相关;脑转移瘤通过血管途径侵入脑内,在播散和生长过程中同样会诱导大量新生血管形成,其新生血管结构类似原发肿瘤,也表现为高灌注,因此两者微血管结构无明显差异,仅依靠实性区rCBF值难以鉴别HGG与脑单发转移瘤。
3.3 近瘤周区rCBF对HGG与脑转移瘤的鉴别诊断HGG与脑转移瘤的瘤周区发生机制存在差异,近瘤周区所见更能反映肿瘤的病理特征。Brandão等[8]研究发现,HGG组CBF伪彩图高灌注区域明显大于常规MRI强化范围,而转移瘤高灌注区域与常规MRI增强区域基本一致,提示两者瘤周区病理基础不同。瘤周区又称为瘤周水肿,包括血管源性水肿与浸润性水肿,发生机制复杂,可能与肿瘤大小、部位、血管密度、VEGF表达和组织类型等因素有关,其中近瘤周区(距强化外缘<1 cm处)更能反映肿瘤的病理特点。Weber等[18]研究证实VEGF表达与近瘤周区水肿形成关系较为密切。本研究中HGG近瘤周区中位rCBF值(1.101)明显高于单发脑转移瘤(0.720)(P<0.05)。Weber等[18]采用DSC对35例HGG与7例单发转移瘤近瘤周区进行研究,结果证实HGG近瘤周区灌注明显高于脑转移瘤组(P<0.001),其原因可能是HGG呈侵袭性生长,瘤周区除血管源性水肿外还有瘤细胞浸润,瘤细胞沿新生血管、神经纤维束及扩张的血管周围间隙向瘤周浸润,造成瘤周血管通透性增加及血管源性水肿[19,20]。因此,HGG瘤周水肿的形成是瘤细胞浸润与血管源性水肿综合作用的结果[21]。转移瘤呈膨胀性生长,主要推压周围脑组织而不是浸润,其瘤周水肿发生机制是瘤细胞代谢产物及分泌的生物活性因子造成血-脑屏障通透性异常所致,与HGG的本质区别在于其近瘤周区无明显瘤细胞浸润及血管异常增殖,这些原因造成两种肿瘤的近瘤周区rCBF明显不同。
本研究取rCBF最佳阈值为0.895时,近瘤周区rCBF鉴别两种肿瘤的敏感度及特异度分别为70.8%与84.2%。Weber等[18]采用DSC对35例HGG与7例脑转移瘤近瘤周水肿进行研究,取rCBF阈值为0.5,鉴别两者的敏感度及准确度分别为100%及71%,与本研究结果有一定的差异。这种DSC与ASL之间阈值及敏感度、特异度不同的病理基础是:①肿瘤部位不同,rCBF值也可能会受到一定的影响。Grossman等[21]证实11例健康志愿者双侧背侧丘脑、豆状核及尾状核CBF值分别为(44.7±5.7)ml/(100 g·min)、(42.6±7.1)ml/(100 g·min)、(38.5±7.0)ml/(100 g·min),各组差异有统计学意义(P<0.05)。②不同级别HGG(III级与IV级)血管化程度不同[22,23],在病理异质性及浸润方式上存在差异,影响rCBF测量的准确性。③瘤周水肿的发生机制及影响因素复杂,感兴趣区瘤细胞浸润程度及方式难以与病理检查逐点对照证实[22,23]。
总之,ASL灌注对HGG与脑转移瘤实性区rCBF无明显差异,但是近瘤周区rCBF评估可以为鉴别两者提供重要信息。ASL可以作为常规MRI的有效补充,有助于提高HGG与脑转移瘤的鉴别诊断水平。
[1] Hygino da Cruz LC Jr, Vieira IG, Domingues RC. Diffusion MR imaging: an important tool in the assessment of brain tumors. Neuroimag Clin N Am, 2011, 21(1): 27-49.
[2] Haris M, Husain N, Singh A, et al. Dynamic contrast-enhanced (DCE) derived transfer coefficient (k-trans) is a surrogate marker of matrix metalloproteinase 9 (MMP-9) expression in brain tuberculomas. J Magn Reson Imaging, 2008, 28(3): 588-597.
[3] Shibuya M. Brain angiogenesis in developmental and pathological processes: therapeutic aspects of vascular endothelial growth factor. FEBS J, 2009, 276(17): 4636-4643.
[4] 占传家, 朱文珍, 王承缘. 2007年世界卫生组织对于中枢神经系统肿瘤的分类. 放射学实践, 2008, 23(2): 29-35.
[5] Thomas RP, Xu LW, Lober RM, et al. The incidence and signifcance of multiple lesions in glioblastoma. J Neurooncol, 2013, 112(1): 91-97.
[6] Fayed N, Dávila J, Medrano J, et al. Malignancy assessment of brain tumours with magnetic resonance spectroscopy and dynamic susceptibility contrast MRI. Eur J Radiol, 2008, 67(3): 427-433.
[7] Essig M, Shiroishi MS, Nguyen TB, et al. Perfusion MRI: the five most frequently asked technical questions. Am JRoentgenol, 2013, 200(1): 24-34.
[8] Brandão LA, Shiroishi MS, Law M. Brain tumors: a multimodality approach with diffusion-weighted imaging, diffusion tensor imaging, magnetic resonance spectroscopy, dynamic susceptibility contrast and dynamic contrast-enhanced magnetic resonance imaging. Magnetic Resonance Imaging Clinics of North America, 2013, 21(2): 199-239.
[9] 韩彤, 张云亭, 刘力, 等. 星形细胞肿瘤磁敏感加权成像和灌注成像测量指标与肿瘤内微血管密度和血管内皮细胞生长因子的相关性研究. 中华放射学杂志, 2013, 47(12): 1086-1091.
[10] Cha S, Lupo JM, Chen MH. Differentiation of glioblastoma multiforme and single brain metastasis by peak height and percentage of signal intensity recovery derived from dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging. Am J Neuroradiol, 2007, 28(6): 1078-1084.
[11] 陈耿, 宦怡. 动脉自旋标记技术在颅脑疾病诊断中的临床应用. 实用放射学杂志, 2008, 24(10): 1418-1420.
[12] Bokkers RP, Hernandez DA, Merino JG, et al. Whole-brain arterial spin labeling perfusion MRI in patients with acute stroke. Stroke, 2012, 43(5): 1290-1294.
[13] Järnum H, Steffensen EG, Knutsson L, et al. Perfusion MRI of brain tumours: a comparative study of pseudo-continuous arterial spin labelling and dynamic susceptibility contrast imaging. Neuroradiology, 2010, 52(4): 307-317.
[14] Lehmann P, Monet P, De Marco G, et al. A comparative study of perfusion measurement in brain tumours at 3 Tesla MR: arterial spin labeling versus dynamic susceptibility contrastenhanced MRI. Eur Neurol, 2010, 64(1): 21-26.
[15] Bates DO. Vascular endothelial growth factors and vascular permeability. Cardiovasc Res, 2010, 87(2): 262-271.
[16] Chow LM, Endersby R, Zhu XY, et al. Cooperativity within and among Pten, p53, and Rb pathways induces high-grade astrocytoma in adult brain. Cancer Cell, 2011, 19(3): 305-316.
[17] Pereira-Filho NdeA, Soares FP, Chemale Ide M, et al. Peritumoral brain edema in intracranial meningiomas. Arq Neuropsiquiatr, 2010, 68(3): 346-349.
[18] Weber MA, Zoubaa S, Schlieter M, et al. Diagnostic performance of spectroscopic and perfusion MRI for distinction of brain tumors. Neurology, 2006, 66(12): 1899-1906.
[19] 王萍,翟昭华,唐光才,等. 扩散加权成像鉴别诊断恶性胶质瘤与单发脑转移瘤的b值优化. 中国医学影像学杂志2014, 22(7) : 487-490.
[20] 李香营, 战跃福, 韩向君. 脑肿瘤瘤周水肿的功能成像新进展. 国际医学放射学杂志, 2010, 33(1): 18-22.
[21] Grossman EJ, Zhang K, An J, et al. Measurement of deep gray matter perfusion using a segmented true-fast imaging with steady-state precession (True-FISP) arterial spin-labeling (ASL) method at 3T. J Magn Reson Imaging, 2009, 29(6): 1425-1431. [22] Seidel C, Dörner N, Osswald M, et al. Does age matter? - A MRI study on peritumoral edema in newly diagnosed primary glioblastoma. BMC Cancer, 2011, 11(1): 127-135.
[23] Behawy JF. Perioperative steroids for perituinoral intracranial edema: a review of mechanisms, efficacy, and side effects. J Neurosurg Anesthesiol, 2012, 24(3): 173-177.
(本文编辑 张春辉)
Differentiation of High Grade Glioma and Solitary Metastatic Brain Tumor in Ring-like Enhancement Using Three-dimensional Arterial Spin Labeling
PurposeTo probe into the value of three-dimensional arterial spin labeling (3D-ASL) in the differential diagnosis of high grade glioma (HGG) and solitary metastatic brain tumor in ring-like enhancement, so as to improve the diagnosis.Materials and MethodsForty-eight patients with HGG and 38 patients with metastatic brain tumors underwent conventional MRI, 3D-ASL and enhanced MRI scan, and the cerebral blood flow (CBF) in the solid region, immediate peritumoral region and mirror region was measured respectively. Then the relative CBF (rCBF) was calculated in the solid region and immediate peritumroal region for each patient and compared between the two groups. Then the cutoff value of rCBF that combined best sensitivity and specifcity for distinguishing between HGG and solitary metastatic brain tumors was analyzed.ResultsThe median rCBF values (interquartile range) of 3D-ASL in the solid region of 48 HGG cases and 38 cases of metastatic brain tumors were 3.612 (2.10) and 3.123 (5.99) respectively (without statistic signifcance, P>0.05). Those in the immediate peritumoral region were 1.101 (0.90) and 0.720 (0.28) respectively (with statistic significance, P<0.05). According to ROC curve analysis, a cutoff value of 0.895 for the immediate peritumoral rCBF value generated the best combination of sensitivity (70.8%) and specifcity (84.2%) for distinguishing between HGG and solitary metastatic brain tumor.ConclusionThe rCBF value in the immediate peritumoral region measured by 3D-ASL is helpful in differentiating HGG from solitary metastatic brain tumor, while that in the solid region cannot provide enough information in the differential diagnosis.
Brain neoplasms; Glioma; Neoplasm metastasis; Magnetic resonance imaging; Perfusion imaging; Arterial spin labeling; Regional blood flow; Diagnosis, differential
1. 河北医科大学第二医院影像科 河北石家庄050000
2.河北省邯郸市中心医院 河北邯郸 056001
全冠民
Department of Radiology, the Second Hospital of Hebei Medical University, Shijiazhuang
050000, China
Address Correspondence to: QUAN Guanmin E-mail: quanguanmin@163.com
R739.41;R730.42
2014-07-12
修回日期:2014-12-02
中国医学影像学杂志
2014年 第22卷 第12期:899-903
Chinese Journal of Medical Imaging 2014 Volume 22(12): 899-903
10.3969/j.issn.1005-5185.2014.12.005

