大鼠体外循环后小肠黏膜基质金属蛋白酶9及其组织型抑制剂1表达与肠屏障功能的关系
商宏伟,李 岚,孙盛斌,肖颖彬,刘 梅
·基础研究·
大鼠体外循环后小肠黏膜基质金属蛋白酶9及其组织型抑制剂1表达与肠屏障功能的关系
商宏伟,李 岚,孙盛斌,肖颖彬,刘 梅
目的 探讨大鼠体外循环(CPB)后小肠黏膜基质金属蛋白酶9(MMP-9)及其组织型抑制剂(TIMP-1)表达与肠屏障功能的关系,为CPB后肠屏障功能保护提供新靶点。方法 健康成年雄性清洁级SD大鼠40只随机分为CPB组(n=20)和假手术组(SH组,n=20)。另取10只作为正常对照组(N组)。分光光度法测定CPB后血浆二胺氧化酶(DAO)活性,转录酶-逆转录聚合酶链反应及蛋白质斑迹法检测肠黏膜MMP-9,TIMP-1的mRNA和蛋白表达变化,明胶酶谱法测定肠黏膜MMP-9活性变化,并进行统计学分析。结果 CPB组血浆中DAO活性比SH组和N组显著增高(P<0.05);RT-PCR显示CPB组小肠黏膜MMP-9 mRNA表达水平较N组和SH组明显增加(P<0.01);CPB组TIMP-1 mRNA表达水平与N组和SH组无显著差异(P>0.05);Western blot显示CPB组MMP-9蛋白表达显著高于SH组和N组(P<0.01);三组之间TIMP-1蛋白表达无明显差异(P>0.05)。凝胶成像系统分析结果显示,CPB组小肠黏膜组织中MMP-9、MMP-2活性与SH和N组比较,均显著增强(P<0.01);线性回归及相关分析结果显示:CPB后肠黏膜组织MMP-9活性和血浆DAO活性呈显著正相关(r=0.821,P<0.01)。结论 CPB后小肠黏膜MMP-9表达上调及其酶活性增加导致MMP-9/TIMP-1失衡在肠屏障功能障碍发生发展中起重要作用。调控MMP-9活性有可能成为CPB过程中肠屏障功能保护新靶点。
体外循环;大鼠;基质金属蛋白酶;肠黏膜屏障
肠道是应激反应的中心器官和重要靶器官。研究表明体外循环(cardiopulmonary bypass,CPB)后早期即可出现肠黏膜屏障功能的损害,是造成CPB后全身性炎症反应(systemic inflammatory response syn⁃drome,SIRS)发生发展的重要原因之一[1-2]。CPB引起肠黏膜细胞外基质(extracellular matrix,ECM)各成分,如基底膜层粘连蛋白(LN)、Ⅰ、Ⅲ和Ⅳ型胶原等含量下降、结构破坏也是肠屏障功能损害的重要因素[3-4]。但是造成ECM损害的具体机制尚不清楚。基质金属蛋白酶(matrix metalloproteinases,MMPs)是一组锌离子和钙离子依赖的内源性蛋白水解酶,是降解ECM的主要酶系。金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinases,TIMPs)是MMPs的内源性特异性组织抑制剂[5]。本研究拟通过观察大鼠CPB后肠源性MMP-9/TIMP-1表达情况,探讨其与肠屏障功能的关系,进一步阐明肠屏障损害发生机制,为肠屏障功能保护提供新靶点。
1 材料与方法
1.1 大鼠CPB模型[6]
1.1.1 实验动物 成年健康雄性清洁级SD大鼠由第三军医大学实验动物中心提供,体重350~500 g。术前6 h禁食水。
1.1.2 手术方法 同参考文献[4]。
1.2 实验分组 随机分为CPB组(n=20)、假手术组(SH组,仅在各部位进行插管操作,不转流,n=20)和正常对照组(N组,n=10)。
1.3 标本留取及处理 CPB结束后2 h处死动物,无菌条件下取肠系膜上静脉血分离血浆-70℃保存待测;取距回盲部5 cm的回肠肠段2 cm,按黎君友[7]方法进行肠组织匀浆,-70℃保存;另取肠段2 cm,作病理分析。
1.4 血浆二胺氧化酶(DAO)活性 按照黎君友[7]等建立的分光光度法测定;由于CPB使用的血液稀释对各指标浓度的影响,用以下公式校正:校正值=测定值×转流前红细胞比容(Hct)/测定时Hct。
1.5 逆转录聚合酶链反应(RT-PCR) Tripure RNA提取试剂盒(Roche公司,美国)提取小肠黏膜组织总RNA,RT-PCR试剂盒(TaKaRa,日本)行PCR扩增反应,GAPDH引物(退火温度:61.4℃,231 bp):正义5'-ACG GCA AAT TCA ACG GCA CAG TCA-3';反义5'-TGG GGG CAT CGG CAG AAG G-3';MMP-9引物(退火温度:66.9℃,545 bp):正义5'-GAA GAC TTG CCG CGA GAC GTG ATC GAT G-3';反义5'-GCA CCA GCG ATA ACC ATC CGA GCG AC-3';TIMP-1引物(退火温度:59.8℃,219 bp):正义5'-AAT GCC ACA GGT TTC CGG TTC-3';反义5'-ACA CCC CAC AGC CAG CAC TAT-3'。按以下条件进行PCR反应:MMP-9/TIMP-1/GAP⁃DH(磷酸甘油醛脱氢酶):94℃ 变性2 min,然后按照下列循环条件进行扩增:94℃变性1 min-66℃/59℃/61℃退火1 min-72℃延伸1 min,循环32次。最后在72℃延伸10 min,取出反应管置4℃10 min,即可进行电泳。用引物扩增cDNA片段,并与内参照(GAPDH)同时扩增。PCR扩增完毕后,进行琼脂糖凝胶电泳(1.5%加入0.6 μg/ml EB),确定PCR反应产物。电泳结果扫入凝胶成像系统并照相进行分析,结果以光密度值比值(OD ratio,目的片段/GAPDH)表示。
1.6 蛋白质斑迹法(Western blot) RIPA裂解液抽提小肠黏膜组织总蛋白;BCA法测定蛋白浓度;按照十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDSPAGE)凝胶试剂盒(碧云天公司)说明书进行SDSPAGE凝胶电泳;转膜;封闭;加兔抗鼠一抗体,摇床4℃孵育过夜;洗膜;加HRP标记的羊抗兔IgG二抗,室温摇动1 h;洗膜;双抗体(DAB)显色5~10 min,出现清晰条带。凝胶扫描成像系统进行分析,蛋白表达量结果以光密度(Odu∗mm2)比值(OD ra⁃tio,目的片段/GAPDH)表示。
1.7 明胶酶谱分析(Gelatin Zymography)[8]
1.7.1 小肠组织液提取 液氮中取出小肠肠段,冰生理盐水冲洗3次,平皿中刮取肠黏膜组织25 mg,移入玻璃匀浆器,加入蛋白质匀浆缓冲液2 ml;冰上研磨,10 000 rpm,4℃离心5 min;取上清液,用0.1M的Tris缓冲液调节pH值至7.6;于试管中加入考马斯亮蓝染液 3 ml和蛋白上清液5 μl,混匀后用Beckmann紫外分光光度计测定蛋白浓度;上清液转移至另一个EP管(100~200 μl/管),-70℃冻存。
1.7.2 明胶酶谱法测定 配制12%非还原性SDS-聚丙烯酰胺凝胶,其中含0.1%明胶;在上述混合液中加入APS和四甲基乙二胺(TEMED),室温下聚合,灌注分离胶;然后4%无酶底物聚丙烯酰胺灌注积层胶;取5 μl上样(上样缓冲液中不应用DTT以免使得蛋白变性无法复性)进行SDS-PAGE电泳。以胰蛋白酶、蛋白酶抑制剂(PMSF)作阳性和阴性对照,样品不经过预热处理直接在凝胶上加样;4℃,50 V下电泳5 h,电泳液为甘氨酸缓冲液;电泳结束后,将凝胶置于洗脱液中振荡洗脱45 min×2,去除凝胶中的SDS,然后用漂洗液漂洗20 min×2,以上各步均在4°C进行;将凝胶置于孵育液中37°C孵育42 h,使得蛋白酶活化;孵育结束后经染色液染色3 h,及脱色液A、B、C分别脱色0.5 h、1 h、2 h,直至显示出蓝色背景下的透亮带;扫入凝胶成像系统进行图像分析,明胶酶活性用光密度值(OD值)重复3次;此凝胶经成像并以反转模式打印,使酶解活性表现为白色背景上的黑色条带,经图像分析系统读取条带面积和灰度。条带酶解量=条带面积×(条带灰度-背景灰度),以“比活”(比活=酶解量/样品蛋白浓度,单位为灰度面积×g/L)反映酶的含量。
2 结 果
2.1 DAO活性变化 见图1。
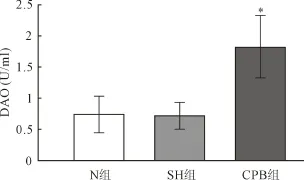
图1 实验结束时DAO活性
2.2 小肠黏膜组织MMP-9、TIMP-1 mRNA表达变化 RT-PCR结果显示:CPB组MMP-9 mRNA表达水平(2.26±0.19)较 N组(0.28±0.02)和SH组(0.34±0.04)明显增加(P<0.01),见图2;CPB组TIMP-1 mRNA表达水平(0.46±0.07)与N组(0.33±0.05)和SH组(0.41±0.03)无显著差异(P>0.05),见图3。

图2 实验结束时小肠黏膜组织MMP-9 mRNA表达变化
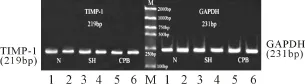
图3 实验结束时小肠黏膜组织TIMP-1mRNA表达变化
2.3 小肠黏膜组织MMP-9、TIMP-1蛋白表达Western blot结果显示,CPB后大鼠小肠黏膜MMP-9蛋白表达显著高于SH组和N组(P<0.01);三组之间TIMP-1蛋白表达无明显差异(P>0.05),见图4和图5。这一结果与mRNA水平的结果相一致。

图4 实验结束时小肠黏膜组织MMP-9蛋白表达变化

图5 实验结束时小肠黏膜组织TIMP-1蛋白表达变化
2.4 小肠黏膜组织MMP明胶分解活性的改变 凝胶成像系统分析结果显示:CPB组小肠黏膜组织中MMP-9、MMP-2活性与SH和N组比较,均显著增强(P<0.01);并与MMP-9/TIMP-1变化相一致,见图6。

图6 实验结束时小肠黏膜组织MMP明胶分解活性变化
2.5 小肠黏膜MMP-9活性变化与血浆DAO活性的相关性 线性回归及相关分析结果显示:CPB后肠黏膜组织MMP-9活性和血浆DAO活性呈显著正相关(r=0.821,P<0.01,t=6.112),见图7。

图7 实验结束时小肠黏膜组织MMP-9活性变化与血浆DAO活性的相关性
3 讨 论
研究证实,CPB过程可以造成肠屏障功能的损害,这种损害在CPB后肠源性感染和SIRS的发生发展中起重要作用[2-3]。但是目前对于这种损害的机制缺乏深入系统的研究。肠黏膜屏障的重要基础是肠上皮细胞和基底膜结构与功能的完整性和稳定性。肠黏膜ECM主要有肠黏膜上皮基底膜和间质性基质组成。基底膜的主要成分是层粘连蛋白(LN)和Ⅳ型胶原;基底膜之下的间质性ECM则富含Ⅰ、Ⅲ型胶原,纤维粘连蛋白和多种糖蛋白等。MMPs是一组锌离子和钙离子依赖的内源性蛋白水解酶,是降解ECM的主要酶系。TIMPs是MMPs的内源性特异性组织抑制剂。正常情况下组织MMPs和TIMPs处于动态平衡状态。有观点认为:肠黏膜损伤之后的愈合与重构需要MMPs/TIMPs动态平衡发生改变使得任何坏死组织降解和基质重建[5]。因此,MMPs在小肠黏膜损伤后愈合重构中可能起重要作用。临床研究表明CPB可引起血清中MMP-9水平升高[8]。本研究通过观察CPB过程中肠源性MMPs/TIMPs系统变化情况,分析探讨其与肠屏障功能的关系。
前期研究表明CPB后大鼠小肠黏膜ECM各成分如LN、Ⅰ、Ⅲ、Ⅳ型胶原含量下降、并且与血浆DAO活性呈显著的负相关。证实CPB后肠黏膜ECM的破坏可导致肠屏障功能损害[9]。MMPs是降解间质Ⅰ、Ⅲ型胶原和基底膜LN、Ⅳ型胶原等成分的主要酶系。正常小肠组织中MMPs/TIMPs的动态平衡状态参与ECM的正常代谢与更新过程。TIMPs是组织MMPs活性的重要的内源性抑制剂,TIMPs以1:1摩尔比例与MMPs形成复合物,阻断MMPs与底物的结合,从而直接降低MMPs的生物学活性,其中TIMP-1主要对MMP-9有抑制作用。MMP-9是又称明胶酶B,主要来源于炎症细胞、内皮细胞和成纤维细胞等,对明胶、胶原片段和纤维粘连蛋白等ECM均有降解作用[10]。本实验结果显示,CPB后小肠黏膜组织MMP-9基因表达和蛋白合成明显增加,明胶酶谱法证实黏膜组织明胶酶MMP-9、MMP-2的明胶分解活性显著增强,TIMP-1蛋白表达水平无明显改变,MMP-9/TIMP-1平衡状态破坏,有利于MMP-9、MMP-2持续激活,参与ECM降解、细胞凋亡、炎症反应和肠屏障功能障碍过程。由此推测CPB后肠黏膜ECM含量下降是通过胶原降解增加而不是合成减少来实现的。本研究显示CPB后小肠黏膜MMP-9表达上调及其酶活性增加与血浆DAO活性显著正相关,说明MMP-9的激活在CPB后小肠黏膜损害和功能障碍发生发展中起重要作用。
综上所述,笔者认为采取相应措施抑制MMP-9的表达和活化程度,对于改善CPB后肠屏障功能,减轻全身炎症反应,降低手术并发症和改善临床效果均具有重要意义。调控MMPs活性有可能成为CPB过程中肠屏障功能保护的新靶点。
[1] Basson MD.Invited research review:cell-matrix interaction in the gut epithetlium[J].Surgery,2003,133(3):263-267.
[2] 商宏伟,肖颖彬,陈林,等.体外循环对大鼠肠黏膜屏障功能的影响[J].中华胸心血管外科杂志,2005,21(2):108-110.
[3] Grootjans J,Lenaerts K,Derikx JP,et al.Human intestinal is⁃chemia-reperfusion-induced inflammation characterized:experi⁃ences from a new translational model[J].Am J pathol,2010,176(5):2283-2291.
[4] 商宏伟,孙盛斌,肖颖彬,等.大鼠体外循环后血浆二胺氧化酶与小肠黏膜基质蛋白变化的相关性研究 [J].中国体外循环杂志,2013,11(2):111-115.
[5] Garg P,Vijay-Kumar M,Wang L,et al.Matrix metalloprotein⁃ase-9-mediated tissue injury overrides the protective effect of ma⁃trix metalloproteinase-2 during colitis[J].Am J Physiol Gastroi⁃ntest Liver Physiol,2009,296(2):G175-184.
[6] 商宏伟,肖颖彬,刘梅,等.大鼠非经胸体外循环模型的建立[J].中华实验外科杂志,2005,22(3):370-371
[7] 黎君友,于燕,郝军,等.分光光度法测定血和小肠组织二胺氧化酶活性[J].氨基酸和生物资源,1996,18(4):28-30.
[8] Chen H,Inocencio R,Alam HB,et al.Differential expression of ex⁃tracellular matrix remodeling genes in rats model of hemorrhagic shock and resuscitation[J].J Surg Res,2005,123(2):235-244.
[9] Marson BP,Lacchini R,Belo V,et al.Functional matrix metal⁃loproteinase(MMP-9)genetic variants modify the effects of he⁃modialysis on circulating MMP-9 levels[J].Clin Chim Acta,2012,414:46-51.
[10] Helmersson-Karlqvist J,Akerfeldt T,Gunningberg L,et al.Ser⁃um MMP-9 and TIMP-1 concentrations and MMP-9 activity during surgery-induced inflammation in humans[J].Clin Chem Lab Med,2012,50(6):1115-1119.
Expression of matrix metalloproteinase-9 and tissue inhibitor of metalloprotein⁃ase-1 in gut mucosa and its relationship to intestinal barrier function in rats af⁃ter cardiopulmonary bypass
Shang Hong-wei,Li Lan,Sun Sheng-bin,Xiao Ying-bin,Liu Mei
Department of Thoracic and Cardiovascular Surgery,PLA 254th Hospital,Tianjin300142,China
Objective To explore the expression of matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1(MMP-9/TIMP-1)in gut mucosa and its relationship to intestinal barrier function in rats after cardiopulmonary bypass(CPB).Methods CPB model in rats was established.40 SD rats were randomly divided into CPB group(n=20)and sham-operation(SH)group(n=20),another 10 SD rats were taken as normal control(N)group.The serum diamine oxidase(DAO)activity was measured with spectrophotometry.The changes of mRNA and protein expression of MMP-9,TIMP-1 in the intestinal mucosa were detected by RT-PCR and Western blot respectively.The changes of MMP-9 activity were detected by Gelatin Zymography.Statistical analysis was performed by using software SPSS 16.0.Results The plasma DAO activity in CPB group(1.817±0.359 U/ml)was significantly high⁃er than those in SH group and N group(P=0.018),and the expression of MMP-9 mRNA in intestinal mucosa detected by RT-PCR was enhanced more significantly than those in the other two groups.Meanwhile no significant difference was observed in expression of TIMP-1 mRNA in three groups.Expression of MMP-9 protein in intestinal mucosa analysed by Western blot was increased more sig⁃nificantly in CPB group than those in the other two groups,and no significant difference was observed in expression of TIMP-1 protein in three groups.The gelatinlytic activity of MMP-9 and MMP-2 enhanced more significantly in CPB group than those in SH group and N group.The activity of MMP-9 protein in gut mucosa in CPB group was significantly positively correlated with the activity of plasma DAO by linear correlative analysis.Conclusion Unbalance of MMP-9/TIMP-1 caused by the upregulated expression and enhanced activity of MMP-9 in intestinal mucosa after CPB play important role in the pathogenesis of intestinal barrier dysfunction.Regulating of the activity of MMP-9 may be a new target for the pretection of intestinal barrier function during CPB.
Cardiopulmonary bypass;Rats;Matrix metalloproteinases;Intestinal barrier function
2013⁃12⁃20)
2014⁃02⁃18)
10.13498/j.cnki.chin.j.ecc.2014.02.14
300142天津,天津市解放军第二五四医院心胸外科(商宏伟、孙盛斌),麻醉科(李 岚);400037重庆,第三军医大学新桥医院心血管外科(肖颖彬、刘 梅)
——体外循环质量控制的基石

