鲢鱼各部位磷脂组分及脂肪酸组成分析
邹 舟,王 琦,2,3,*,于 刚,张维农,2,3,王海滨,3
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.武汉轻工大学油脂及植物蛋白工程技术研发中心,湖北 武汉 430023;3.农产品加工湖北省协同创新中心,湖北 武汉 430023;4.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东 广州 510300)
鲢鱼各部位磷脂组分及脂肪酸组成分析
邹 舟1,王 琦1,2,3,*,于 刚4,张维农1,2,3,王海滨1,3
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.武汉轻工大学油脂及植物蛋白工程技术研发中心,湖北 武汉 430023;3.农产品加工湖北省协同创新中心,湖北 武汉 430023;4.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东 广州 510300)
应用Bligh-Dyer法、硅胶柱层析和薄层层析(thin layer chromatography,TLC)分析比较鲢鱼头部、眼部、背肌、腹肌、内脏、尾部的磷脂含量与组成,气相色谱-质谱联用技术分析鲢鱼各部位磷脂的脂肪酸组成。结果表明:各部位磷脂种类有磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)、磷脂酰丝氨酸(phosphatidyelserine,PS)及一未知组分,鲢鱼各部位的PE、PC明显高于其他磷脂组分。鱼头磷脂中饱和脂肪酸的总量最高,其次是内脏中含量,鱼眼中含量最低。单不饱和脂肪酸的含量也在鱼头中最丰富,明显高于背肌、鱼眼、腹肌、鱼尾,后三者间差异性不显著(P>0.05),内脏中含量最低。多不饱和脂肪酸的含量在鱼眼中最多,与腹肌、鱼尾中的含量差异不显著,都在49%以上,但明显高于鱼头、背肌内脏中的含量。各部位间内脏中二十碳五烯酸和二十二碳六烯酸的含量明显高于其他部位,其次是鱼眼。鱼眼磷脂中C22∶6的含量最丰富,C20∶5在内脏磷脂中含量最多。
鲢鱼;磷脂;薄层层析;脂肪酸组成;气相色谱-质谱
磷脂是含磷的脂类物质的统称,具有通过磷酸根相连的取代基团(氨、碱或醇等)构成的亲水头部和脂肪酸链构成的疏水尾部,因此具有亲水和疏水双重性,可以提高免疫功能,激活巨噬细胞活力,增强机体抵抗疾病能力,其生物活性功能引起了广泛关注[1-5]。
中国是世界上淡水渔业最发达国家之一,淡水鱼年产量达1 500万 t以上;而鲢鱼(Silver carp,Hypophthalmichthys molitrix)作为我国主要养殖淡水鱼品种之一,适应性强,生长快,年产量达到300万 t左右,但由于受国际、国内市场对淡水鱼消费习惯的限制[6]及鱼本身的加工特性、风味口感等因素影响,其市场价值较低,有待进一步开发利用。有研究[7]发现匈牙利地区的包括鲢鱼在内的5 种鱼的脑部磷脂的二十碳五烯酸(eicosapntemacnioc acid,EPA)含量平均值为(1.8±0.4)%,二十二碳六烯酸(docosahexaenoic acid,DHA)为(21.1±2.5)%,其中主要DHA磷脂的分子类型为18∶1/22∶6、18∶0/22∶6及16∶0/22∶6型二酰基磷脂酰胆碱(phosphatidylcholine,PC)和磷脂酰乙醇胺(phosphatidylethanolamine,PE)。本实验探讨鲢鱼各部位磷脂的提取分离及其脂肪酸组成分析,对其功能成分进行研究分析,为将来提取其有效成分,对水产副产物进行精深加工和开发高附加值产品提供依据。
1 材料与方法
1.1 材料与试剂
鲢鱼 市售;正己烷、甲醇(色谱纯) 天津市科密欧化学试剂有限公司;BF3-甲醇 上海Aladdin公司;GF254薄层色谱硅胶板、GF254柱层析硅胶(100~200 目) 青岛海洋化工厂;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
RE-52CS旋转蒸发器、SHZ-Ⅲ型循环水真空泵 上海亚荣生化仪器厂;HH-2数显恒温水浴锅 上海维诚仪器有限公司; GZX-9140MBE数显鼓风干燥箱 上海博迅实业有限公司医疗设备厂;CP214电子分析天平 奥豪斯国际贸易(上海)有限公司;7890A-5975C气相色谱-质谱联用仪(配数据处理系统Chemstatain,标准质谱谱库NIST 11) 美国Agilent公司。
1.3 方法
1.3.1 鲢鱼磷脂的提取分离
采用改进的Bligh-Dyer法[8]进行鲢鱼总脂质提取。鲢鱼各部位组织,切碎后取100 g,加入100 mL氯仿和200 mL甲醇,匀浆搅拌20 min,抽滤再加100 mL氯仿洗残渣,合并滤液,向滤液中加100 mL 0.88% KCl溶液,混匀后倒入分液漏斗,静置分层3 h,取下层氯仿层,于55 ℃真空旋转蒸发去除氯仿得鲢鱼总脂质。
取0.2 g鲢鱼总脂质上硅胶层析柱,依次用200 mL氯仿、100 mL丙酮、200 mL甲醇先后洗脱,将甲醇洗脱液收集,于55 ℃真空旋转蒸发去除甲醇得鲢鱼磷脂[9-10]。
1.3.2 薄层色谱分析磷脂
将上述所得的磷脂加入氯仿溶解,配制成100 mg/mL的溶液进行薄层色谱分离,展开剂为氯仿、甲醇、水体积比65∶25∶4,显色剂分别为3%醋酸铜-磷酸、Ditmmer-Leser试剂、Dragendorff试剂、茚三酮试剂,薄层扫描后,Scion Image软件处理图像并分析结果[11-15]。
1.3.3 脂肪酸甲酯化[16-20]
称取鲢鱼磷脂50 mg于10 mL试管中,加入2 mL 0.5 mol/L NaOH-甲醇溶液,在65 ℃皂化30 min后,加入2 mL的BF3-甲醇(1∶3,V/V)溶液,加热反应3 min,冷却至室温,加入2 mL正己烷进行萃取,摇匀后静置分层,取上层有机相,离心备用。
1.3.4 气相色谱(gas chromatography,GC)条件
色谱柱:HP-FFAP石英毛细柱(30 m×0.25 mm,0.25 øm);升温程序:140 ℃保持1 min,以5 ℃/min升至190 ℃,再以3 ℃/min升至220 ℃,保持10 min;载气(He)流速1.0 mL/min,压力88 kPa,进样量1 øL,分流比10∶1。
1.3.5 质谱(mass spectrometry,MS)条件
电子电离源;电子能量70 eV;传输线温度250 ℃;离子源温度230 ℃;扫描周期3.21 次/s;质量扫描范围m/z 10~460。
1.4 数据分析
实验数据用SPSS 17.5统计软件分析处理,利用单因素方差分析(One-Way ANOVA)检验不同部位间的差异显著性,并用最小显著差法(least-significant difference,LSD)进行了多重比较,描述性统计值使用平均值±标准差表示,P<0.05为具有显著性差异。
2 结果与分析
2.1 柱层析分离鲢鱼各部位磷脂
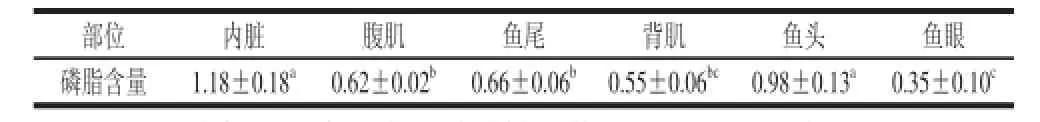
表1 鲢鱼各部位磷脂的含量Table 1 phospholipid contents in different parts of silver carp %
从表1可知,内脏中磷脂含量最高,其次是鱼头,都在0.9%以上,明显高于腹肌、鱼尾、背肌、鱼眼中的含量,鱼眼中磷脂含量最低仅为0.35%。这可能和磷脂作为细胞膜的主要组成成分有关,在内脏器官中各种组织细胞分布较比较丰富,磷脂含量较高;而在肌肉中主要为肌细胞,磷脂含量相对低一些;鱼眼中水分含量高,组织成分含量低,磷脂含量也偏低。
2.2 鲢鱼各部位磷脂薄层色谱分析
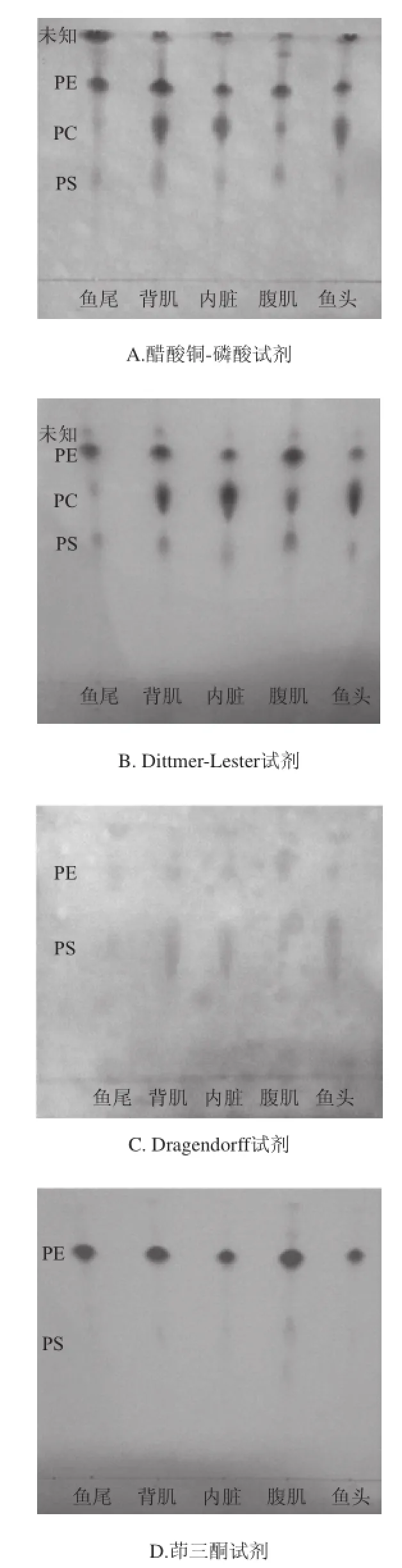
图1 不同显色剂磷脂的薄层色谱图Fig.1 Thin layer chromatography of phospholipids
使用Dittmer-Lester试剂时,磷脂能显现出蓝色斑点(图中颜色未显示),Dragendorff试剂可以含有胆碱的磷脂显现出橙色斑点(图中颜色未显示),茚三酮试剂对含有氨基的脂质显现红紫色斑点(图中颜色未显示),醋酸铜-磷酸试剂使脂质显现黑色,则由图1可以看出,薄层图从下往上依次是:磷脂酰丝氨酸(phosphatidyelserine,PS)、PC、PE、未知磷脂组分,从图1大致可以看出磷脂组成分布,各部位磷脂中PC、PE的含量相对较高。
表2 磷脂各组分的比移值Table 2 Transfer values of phospholipid components
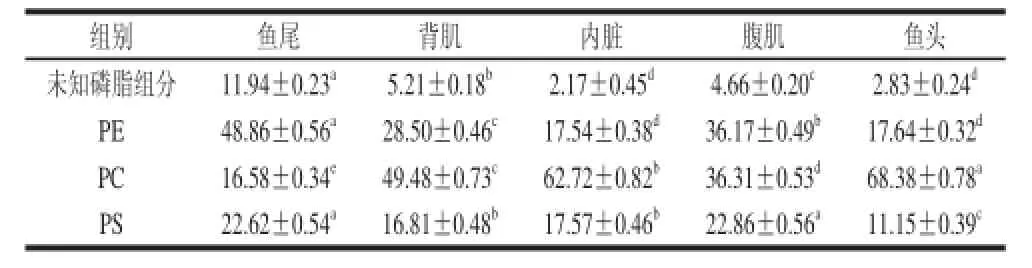
表3 磷脂各组分含量Table 3 Composition of phospholipids %
各部位磷脂组分的迁移值和相对含量,见表2、3。各部位间磷脂分子种类相同,都有4 种,但不同部位间各磷脂分子含量差异显著,同一部位除鱼尾外,各组分含量依次是PC> PE> PS>未知磷脂组分,鱼尾中含量最高的是PE达48.86%,其次是PC。不同部位间同一磷脂组分含量差异显著(P<0.05),PC在鱼头中最高,达68.38%,其次是内脏,明显高于腹肌、背肌和鱼尾。鱼头和内脏中的PE含量接近,达17%,明显低于其他部位。腹肌和鱼尾的PS含量接近大约在22.7%,明显要高于背肌、内脏,后两者含量接近,而鱼头中PS含量最低,仅为11.15%。鱼尾中未知磷脂组分含量最高为11.94%,其他部位的未知磷脂组分含量都较低。
2.3 鲢鱼各部位磷脂脂肪酸组成分析
鲢鱼各部位磷脂的脂肪酸组成,见表4。鲢鱼不同部位的磷脂间分别检测出17~24 种脂肪酸,其中饱和脂肪酸(saturated fatty acid,SFA)6~9 种,单不饱和脂肪酸(monounsaturated fatty acid,,MUFA)4~5 种,多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)7~10 种,就PUFA而言,鱼眼和内脏中C22∶6(docosahexaenoic acid,DHA)的含量最高,达15%以上。鱼头、腹肌、鱼尾中C20∶4(花生四烯酸)的含量最高,达8%以上。而背肌中含量最高的是C20∶5(eicosapntemacnioc acid,EPA),达15.52%。鱼眼、腹肌、鱼尾的PUFA接近达50%左右,明显高于鱼头、背肌、内脏,且后两者PUFA含量接近。鱼头中MUFA含量最高,达27.05%,其次是背肌,明显高于其他部位。在检测到的MUFA中C18∶1(油酸)含量最高,在鱼头、鱼眼、背肌、腹肌、内脏、鱼尾中分别为16.69%、13.47%、15.20%、13.71%、13.93%、13.03%。饱和脂肪酸中C16∶0的含量最为丰富,占总脂肪酸含量的10%~22%左右。各部位间EPA+DHA的总量,内脏中明显高于其他部位,其次是鱼眼。比较各类脂肪酸总量可知,鱼头中SFA的总量最高,其次是内脏中含量,鱼眼中含量最低。MUFA的含量也是在鱼头中最丰富,明显高于背肌、鱼眼、腹肌、鱼尾,后三者间差异不显著(P>0.05),内脏中含量最低。PUFA的含量在鱼眼中最多,达51.76%,与腹肌、鱼尾中的含量差异不显著,但明显高于鱼头、背肌、内脏中的含量。

表4 鲢鱼各部位磷脂脂肪酸组成Table 4 Fatty acid composition of phospholipids in different parts %
3 讨 论
磷脂在人体生命活动中发挥着非常重要的作用,经常食用富含磷脂的物质能够促进脂肪的新陈代谢,改善大脑的机能,对心脑血管疾病、肝病、糖尿病、神经性疾病、阿尔茨海默症(老年痴呆症)等病的预防和治疗都很有利。同时磷脂能显著提高免疫功能,激活巨噬细胞的活力,增强机体抵抗疾病的能力[21-23],鲢鱼各部位的脂质组成中,内脏、鱼头中的磷脂比例明显高于其他部位,因此在鲢鱼的加工过程中,其鱼头和内脏作为加工副产物,可以用来提取磷脂,再进一步分离纯化后,运用于医药保健等方面,生产高附加值产品。得到的鲢鱼各部位磷脂均有4 个分子种,包括PC、PE、PS及一未知组分。陈文娟等[24]采用薄层层析法结合分光光度法分析测定大黄鱼鱼卵磷脂含PC、PE、磷脂酰肌醇(phosphatidylinositol,PI)、神经鞘磷脂、溶血磷脂酰胆碱5 种组分,相对含量分别为69.38%、4.14%、8.52%、7.24%、10.72%。与本实验结果有一定差异,可能由于淡水鱼和海水鱼鱼种不同所致。Prabhakara等[19]研究了淡水鱼卡特拉鱼和麦瑞加拉鲮鱼的磷脂组成,其中PC约占55%~60%,PE约37%~39%,PI约为3%~6%。上述研究中磷脂组分PC、PE含量与本实验结果接近。通过对比相对含量,结合脂质极性分析,推测本研究中未知磷脂组分可能为PI。
脂肪酸是鱼类生长发育阶段重要的代谢能源,也是鱼类机体重要的内源性营养物质。在大多数鱼类中,其单一脂肪酸含量最高的通常是C16∶0,也有研究证明C16∶0、C18∶1脂肪酸为鱼类代谢的主要能量来源,这与本实验结果一致,C16∶0、C18∶1在鲢鱼各部位磷脂中含量都较高。不同部位间PUFA最丰富,占总脂肪酸含量的36.79%~51.76%。鱼头中SFA和MUFA的总量都是最高的,PUFA的含量在鱼眼中最多,达51.76%。本实验中测得的各部位间EPA+DHA的含量较丰富,占总脂肪酸的13.22%~27.12%,内脏中明显高于其他部位,其次是鱼眼。杨文鸽等[25]测定了海水鱼马面魨卵巢中的总脂、磷脂及其脂肪酸组成,发现其磷脂的含量占总脂肪的23.01%~33.03%,EPA与DHA之和在总脂肪和磷脂脂肪酸中高达14.50%和20.48%,本实验所测结果与之较相近。可以看出,与一般淡水鱼的脂肪酸组成中极低的DHA和EPA含量相比[6],鲢鱼各部位,特别是内脏和鱼眼的磷脂中EPA、DHA含量相当高,基本与海水鱼原料相当。DHA和EPA属于n-3系列PUFA,能够维护脑和视网膜功能并延缓脑的衰老,预防心血管疾病,抑制肿瘤生长,还具有抗炎、抑制过敏反应等功能[26-28]。有研究发现,结合EPA、DHA等n-3 PUFA的磷脂(EPA磷脂、DHA磷脂),在拥有磷脂和n-3 PUFA各自功能特性的基础上具有一些独特的生物活性,如细胞膜透过性增强,具有较好的氧化稳定性和增强红细胞变形的功能等[4,29]。鲢鱼各部位尤其是眼部和内脏,有望作为EPA磷脂、DHA磷脂的原料来源,进一步进行开发利用。
[1] 李红, 孙东弦, 刘延奇. 大豆磷脂改性研究进展[J]. 中国油脂, 2012, 37(9): 70-75.
[2] 袁利鹏, 刘波, 熊波, 等. 大豆磷脂的制备、功能特性及行业应用研究进展[J]. 中国酿造, 2013, 32(5): 13-15.
[3] 曹国武, 王威. 饲用大豆磷脂应用价值及制取工艺[J]. 粮食与油脂, 2012(5): 30-31.
[4] HOSOKAWA M, TAKAHASHI K. Prparation of polyunsaturated phospholipids and their functional properties[M]//HOU C T. Handbook of industrial biocatalysis. Boca Raton: CRC Press, 2005: 13-15.
[5] 殷涌光, 陈玉江, 刘瑜, 等. 磷脂功能性质及其生产应用的研究进展[J].食品与机械, 2009, 25(3): 120-124.
[6] 孙炳新, 苏阳, 郝婷婷, 等. 提取条件对草鱼鱼油特性的影响及其脂肪酸组成分析[J]. 食品工业科技, 2013, 34(5): 1-7.
[7] FARKAS T, KITAJKA K, FODOR E, et al. Docosahexaenoicacidcontaining phospholipid molecular species in brains of vertebrates[J]. PNAS, 2000, 97(12): 6362-6366.
[8] BLIGH E G, DYER W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology, 1957, 37: 911-917.
[9] 何海波, 张维农, 达世禄. 天然磷脂的色谱法分离、纯化研究进展[J].分析科学学报, 2004, 20(1): 97-102.
[10] 热娜古丽·木沙, 艾比布拉·伊马木, 逄焕明. 鸡皮中功能性脂质成分的分析研究[J]. 新疆农业科学, 2010, 47(3): 583-586.
[11] 王道营, 徐幸莲, 徐为民. 磷脂的提取与分析检测技术[J]. 粮油加工与食品机械, 2005(7): 50-54.
[12] 彭一鸣, 蒋笃孝. PTLC法纯化大豆卵磷脂及鉴定[J]. 中国油脂, 2002, 27(6): 62-64.
[13] 阿曼古丽·依马木山, 热娜古丽·木沙, 方勇, 等. 拜城油鸡和地方土鸡脂质成分比较分析研究[J]. 新疆农业科学, 2014, 51(3): 552-557.
[14] 胡小中, 温光源, 龙金林. 磷脂分析检测技术研究进展[J]. 中国油脂, 2003, 28(3): 41-44.
[15] 张丽, 卢航, 刘迪, 等. 超声波辅助提取鱼脑磷脂的研究[J]. 大连海洋大学学报, 2014, 29(1): 66-69.
[16] 张敏, 李瑞霞, 伊纪峰, 等. 4 种经济海藻脂肪酸组成分析[J]. 海洋科学, 2012, 36(4): 7-12.
[17] 孙丽阳, 刁全平, 陶静, 等. 龙头鱼中脂肪酸的GC/MS分析[J]. 吉林师范大学学报, 2010(2): 99-101.
[18] 季怀锐, 刘玉兰, 汪学德, 等. 芝麻油磷脂组分及脂肪酸组成分析[J].农业机械, 2012(15): 34-37.
[19] PRABHAKARA R P G, BALASWAMY K, NARSING R G, et al. Lipid classes, fatty acid and phospholipid composition of roe lipids from Catla catla and Cirrhinus mrigala[J]. International Food Research Journal, 2013, 20(1): 275-279.
[20] BHASKAR N, SWAPNA C, HATHWAR D, et al. Lipid class and fatty acid composition of meat and nonmeat components of selected seafoods[J]. Indian Journal of Fisheries, 2012, 59(1) : 133-139.
[21] 王琦. 海产动物来源n-3 PUFA磷脂的提取及生物活性研究[D]. 青岛: 中国海洋大学, 2008: 16-17.
[22] 凌沛学, 荣晓花. 磷脂在保健食品和药品中的应用[J]. 山东食品科技, 2004(2): 6-7.
[23] 汪海峰, 杨受保. 磷脂的功能及其在水产养殖中的应用[J]. 水利渔业, 2004, 24(5): 67-69.
[24] 陈文娟, 陈丽娇. 大黄鱼鱼卵磷脂提取及其磷脂成分分析[J]. 福建农林大学学报, 2012, 41(4): 498-502.
[25] 杨文鸽, 洪晨志, 钱云蕾. 马面魨卵巢在不同贮藏温度下磷脂成分的变化[J]. 湛江海洋大学学报, 2001, 21(1): 35-38.
[26] 曹万新, 孟橘, 田玉霞. DHA的生理功能及应用研究进展[J]. 中国油脂, 2011, 36(3): 1-4.
[27] 朱丽娜, 张志国, 张敏, 等. DHA的生理功能及其在食品中的稳定性[J].中国乳品工业, 2009, 37(2): 45-48.
[28] 张春艳. DHA和EPA的生理作用及开发利用研究进展[J]. 柳州师专学报, 2005, 20(3): 118-121.
[29] 马琴. 二十二碳六烯酸-磷脂生物活性的研究[D]. 青岛: 中国海洋大学, 2009: 8-10.
Lipid Classes and Fatty Acid Composition of Phospholipids from Different Parts of Silver Carp
ZOU Zhou1, WANG Qi1,2,3,*, YU Gang4, ZHANG Wei-nong1,2,3, WANG Hai-bin1,3
(1. College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China; 2. Research Center of Oils and Plant Proteins Technology, Wuhan Polytechnic University, Wuhan 430023, China; 3. Hubei Collaborative Innovation Center for Processing of Agricultural Products, Wuhan 430023, China; 4. Key Laboratory of Aquatic Product Processing, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China)
The distribution and composition of phospholipids in the head, eyes, belly flap, dorsal muscle, viscera and tail of silver carp were analyzed and compared by using Folch method, silica-gel column chromatography and thin layer chromatography (TLC). It was shown that the phospholipids in different parts of silver carp included phosphatidylcholine, phosphatidylethanolamine, phosphatidyelserine and an unknown component. Phosphatidylethanolamine (PE) and phosphatidylcholine (PC) in each part of silver carp were significantly more abundant than other phospholipid components. Fatty acid composition of phospholipids from different parts of silver carp were analyzed by gas chromatography-mass spectrometry, and the results indicated that the content of saturated fatty acids (SFA) in the head was the highest, followed by the viscera, and the lowest in the eyes of silver carp. Mono-unsaturated fatty acids (MUFAs) were significantly more abundant in the head than in the belly flap, eyes and dorsal muscle, without showing significant differences among the last three (P > 0.05), and the lowest levels of MUFAs were found in the viscera. The content of poly-unsaturated fatty acids (PUFAs) in fish eyes was the highest, and the difference between tail and dorsal muscle was not significant, which both accounted for over 49%, but higher than in head, belly flap and viscera. The total amount of eicosapntemacnioc acid (EPA) and docosahexaenoic acid (DHA) in visceral were significantly higher than in other parts, followed by fish eyes. The content of DHA in fish eyes was the highest, but EPA was the most abundant in viscera.
silver carp; phospholipids; thin layer chromatography (TLC); fatty acid composition; gas chromatography-mass spectrometry (GC-MS)
TS254.9
A
1002-6630(2014)24-0105-05
10.7506/spkx1002-6630-201424020
2014-06-28
国家自然科学基金青年科学基金项目(31301446);农业部水产品加工重点实验室开放基金项目(nybjg201209);湖北省教育厅科学技术研究计划优秀中青年人才项目(Q20121803);武汉轻工大学引进人才科研启动项目(090367)作者简介:邹舟(1991—),女,硕士研究生,研究方向为食品科学与工程。E-mail:zz19911203@163.com
*通信作者:王琦(1981—),男,讲师,博士,研究方向为水产品加工与综合利用。E-mail:wq311zb@hotmail.com

