鸡3种组织中热应激相关基因的表达谱芯片分析
宋晓燕,张德祥,张文武,季从亮,张细权,罗庆斌
1. 华南农业大学,动物科学学院,广州 510642;
2. 广东温氏食品集团股份有限公司,新兴 527439;
3. 华南农业大学,农业部鸡遗传育种与繁殖重点实验室,广州 510642
夏季高温引起鸡(Gallus gallus)的热应激反应,导致鸡生理机能改变、繁殖性能下降,严重影响鸡的肉、蛋产品质量和数量,给养鸡生产带来巨大的损失[1~3]。鸡在热应激时的生理生化特性已有报道,例如:热应激影响鸡生理过程的改变,增加鸡空肠内顶端葡萄糖的转换[4];诱导鸡骨骼肌中超氧游离基产生[5];影响鸡颈动脉上皮钙离子通道的改变[6];对肝脏线粒体呼吸作用、活性氧族的产生和脂质氧化反应具有显著影响[7];影响血液中T3、CD3、CD4/CD8、H/L(异嗜性粒细胞/淋巴细胞)值、皮质酮等[8~11];急性热应激会影响肉鸡的采食[12]。此外,研究表明热应激还会影响肉鸡钙离子浓度的变化、细胞的增殖、白细胞介素-2的产生[13]。对鸡的耐热性与热休克蛋白(Heat shock proteins , HSPs)家族基因的关系也有报道,热应激条件下HSP70和HSP90表达量升高,有利于鸡抵抗热应激损伤[14~17]。相关研究利用基因芯片技术分析了果蝇(Drosophila melanogaster)、小鼠(Mus musculus)、家猪(Sus domesticus)等模式动物热应激相关基因的差异表达,发现不同物种各具特点[18~23]。热应激是受多基因影响和调控的复杂生理过程,在鸡中,对于影响和调控这一复杂生理过程的分子机制还缺乏系统的研究。本文旨在利用全基因组表达谱芯片检测鸡热应激相关的差异表达基因,结合生物信息学方法分析热应激影响鸡重要生理功能的分子机制,为筛选鸡耐热性候选基因提供依据。
1 材料和方法
1.1 材料
由广东温氏食品集团股份有限公司提供矮小型黄羽肉鸡纯系雏鸡24只(公母各半)。常规饲养8 d,分为2组,每组12只(公母各半),以28℃±1℃处理3 h为对照组,40℃±1℃应激3 h为实验组。3 h后,立即处死参试雏鸡,采集大脑、肝脏、腿肌组织,放入液氮保存,后转入–80℃冰箱保存,用于提取RNA。
1.2 方法
1.2.1 RNA的提取和RNA池的构建
采用 Trizol(Invitrogen)一步法提取各组织的总RNA。异丙醇沉淀法浓缩RNA后进一步采用Qiagen RNeasy Mini Kit进行总RNA样品的纯化。RNA样品的纯度采用紫外分光光度计(ND-1000)测定并计算,OD260/280在1.8~2.0之间。RNA样品的完整性采用甲醛变性胶凝电泳检测,28S和18S rRNA比值在2.0以上。将特定组织的公、母各1个样品进行等量混合,获得1个样品RNA池,热应激处理组和对照组各制备3个RNA池。
1.2.2 微阵列分析
本研究选用Affymetrix GeneChip Chicken Genome Array芯片,该芯片包含了38 535个探针组,代表鸡的32 773个转录本。实验在博奥生物集团有限公司进行,芯片及探针的详细信息可参见Affymetrix公司网站(http://www.Affymetrix.com),具体实验过程参见 GeneChip Expression Analysis Technical Manual(Affymetrix, Rev.5, Part number701021)。
1.2.3 数据分析
利用GeneChip Operating software (GCOS 1.4,Affymetrix)提取芯片数据,用 DNA-chip analyzer(dChip)进行芯片数据的归一化处理。采用SAM3.0软件(http://www.stat.stanford.edu/~tibs/SAM/)筛选差异表达基因,筛选标准为变化倍数≥2或≤0.5,q≤0.05。运用Cluster 3.0软件(Stanford University School of Medicine, Stanford, CA, USA)进行聚类分析,采用层次聚类法(Average linkage算法)并用Treeview软件进行查看。运用 MAS3.0分子功能注释系统(http://bioinfo.capitalbio.com/mas3/)对差异表达基因进行基因功能分类(Gene ontology, GO)及通路功能分析(Kyoto encyclopedia of genes and genomes,KEGG),计算各功能分类和通路中基因富集的显著程度,以FDR≤0.05为标准评估其显著性。
1.2.4 实时定量PCR验证表达谱芯片的检测结果
为验证表达谱芯片检测结果的可靠性,选择10个差异表达基因,采用实时定量PCR方法检测热应激处理组与对照组各组织中基因的表达量。qRT-PCR的引物采用 Primer5.0软件设计,选取的10个基因及其引物信息见表1,以β-actin为内参基因。
采用荧光试剂SYBR® Premix ExTaqTM进行实时定量PCR检测,检测样本的总RNA量为2 µg,反应体系为15 µL,包括cDNA第一链模板1 µL,mixture混合溶液 7.5 µL,上下游引物各 0.1 µL,ddH2O 6.3 µL。反应条件为:95℃ 5 min;95℃ 10 s,55 ℃ ~60 ℃ 35 s ,72℃ 40 s,45个循环。溶解曲线检测条件为:95℃ 5 s;65 ℃ 1 min 。每个样品的表达量均重复检测3次,采用2-ΔΔCt计算目的基因的相对表达量。
2 结果与分析
2.1 3种组织中差异表达的探针
本研究表达谱芯片检测结果的相关数据已提交至NCBI/GEO数据库(GSE23592)。3种组织的热应激处理组与对照组相比,存在显著差异的探针个数为 1042个(筛选标准为变化倍数≥2或≤0.5,q≤0.05)。大脑组织中存在显著差异的探针共有 183个,其中 129个有基因注释,105个基因上调表达,24个基因下调表达;肝脏中存在显著差异的探针共有558个,其中339个有基因注释,248个基因上调表达,91个基因下调表达;腿肌组织中共有301个探针存在显著差异,其中209个有基因注释,142个基因上调,67个基因下调。
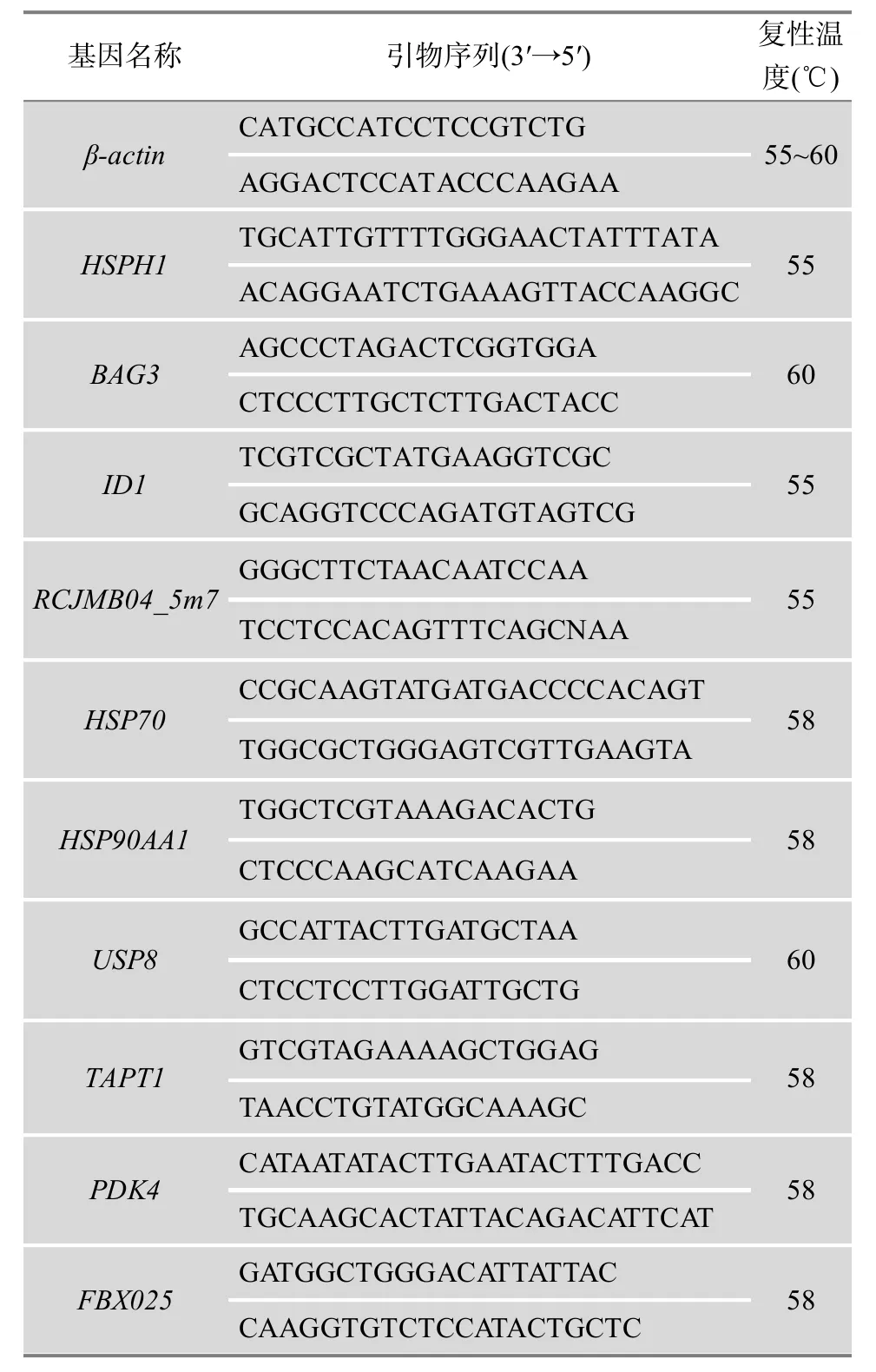
表1 实时定量PCR检测的基因及其引物信息
3种组织共有差异表达探针935个(不同组织间有共同差异表达探针的只统计1次)。只在大脑、肝脏和腿肌组织检测到的具有组织特异性的差异表达探针分别为142个、470个和224个;不同组织间,大脑和肝脏有30个共同差异表达探针,大脑和腿肌有19个差异表达探针,肝脏和腿肌有66个差异表达探针。3种组织共有8个共同的差异表达探针,其中 6个具有基因注释,分别是:HSP25(Heat shock protein 25),HSPH1(Heat shock 105 kDa/110 kDa protein),PDK4(Pyruvate dehydrogenase kinase, isozyme 4),BAG3(BCL2-associated athanogene3),LOC423265(Similar to splicing factor, arginine/serine-rich 5<premRNA splicing factor SRP40)和ID1(Inhibitor of DNA binding 1),除ID1在热应激处理后表现为下调表达外,其余基因均为上调表达。
2.2 3种组织中差异表达的基因
相对于对照组,热处理组的HSPH1和HSP25在3种组织中均为上调表达。HSP70和HSP90B1在大脑和肝脏组织中共同上调表达;HSP90AA1、HSPA5、DNAJA4、DNAJB4、HSPB8和HSPA4L只在大脑组织中上调表达;LOC777492和DNAJC12在肝脏组织中特异表达;DNAJB在腿肌组织中特异性下调表达。上述不同热休克蛋白家族基因在不同组织中出现差异表达,揭示了这些基因在机体热适应中具有重要的作用。
2.3 差异表达探针的聚类分析
运用Cluster3.0软件进行聚类分析,双向聚类图见图1。3种组织中热应激处理组与对照组的基因表达分别聚为两大类,如肝脏 1、2、3为对照组聚为一类,肝脏 4、5、6为热应激组聚为一类,大脑和腿肌组织的聚类结果与肝脏组织类似。肝脏组织、大脑组织和腿肌组织内的6个样品各分别聚为一大类,表明这3种组织的基因表达模式差异较大,具有组织表达的特异性。利用 Cluster3.0 软件中的SOM过程将935个差异表达探针聚为9类(表2)。
2.4 差异表达基因的功能分类
对热应激处理组与对照组的差异表达基因进行GO富集分析,结果表明:在大脑组织中有39个生物学过程发生了显著改变,包括蛋白质折叠、热应答过程、蛋白质聚合、细胞抗凋亡过程等;在肝脏组织中发生显著改变的生物学过程有37个,包括抗细胞凋亡过程、蛋白质折叠、细胞周期等;在腿肌组织中发生显著改变的生物学过程有31个,包括蛋白质折叠、代谢调节、细胞凋亡负调节等。
在大脑组织中有 108个探针为特异性上调表达(氮末端聚糖合成、蛋白酪氨酸激酶信号途径、蛋白质氨基酸磷酸化等)。肝脏组织中特异性表达的探针有492个,其中381个探针上调表达(tRNA氨基酰化、糖代谢、脂代谢等),111个探针为下调表达(类固醇和胆固醇的生物合成、多种药物代谢等)。腿肌组织中特异性表达的探针有 240个,其中下调表达探针 81个(生长调节、负向调控胰岛素受体信号途径等),上调表达探针159个(透明质烷代谢、L-丝氨酸合成、组蛋白脱磷酸等)。大脑、肝脏和腿肌组织在热应激时相关基因具有不同的表达模式和特定的生物学功能,但 3种组织也存在蛋白质折叠、抗细胞凋亡等共同的生物学过程。
基于KEGG数据库,利用MAS3.0软件进行通路分析。结果发现,大脑组织中改变显著的通路有18个,其中与热应激有关的是MAPK信号通路、精氨酸和脯氨酸代谢通路和钙离子信号通路等。MAPK信号通路中表达量显著改变的基因是PRKACB、PPM1B、MEF2C和HSP70。肝脏组织中改变显著的通路有58个,与热应激有关的有钙离子信号通路、多种代谢通路、类固醇化合物的合成和细胞周期活动等,其中钙离子信号通路中表达量显著改变的基因是TNNC2、PLCG2、EGFR、EDNRA、CACNA1D和ADCY1。腿肌组织中显著改变的通路有 51个,与热应激相关的通路有 p53信号通路、MAPK信号通路、细胞周期和转化生长因子信号途径,其中在MAPK信号通路中表达量显著改变的基因有PRKCB、MAPK8、MAP3K4、FGFR2和FGF。
2.5 热应激时3种组织中参与代谢反应的差异表达基因
肝脏组织中参与糖代谢的差异表达基因有PFKFB4、NSDHL、GALE和LYVE1;腿肌中涉及糖代谢的基因有LYG2和ALDOB。肝脏组织中涉及脂类代谢的差异表达基因有LSS、HSD17B7、FDPS、DHCR7、DHCR24、NR5A2、FABP4、ANGPTL3和QKI等;腿肌组织中与脂类代谢有关的差异表达基因有LIPG、APOB、APOH和AGPAT6。大脑组织中参与蛋白质代谢的差异表达基因主要是XPO1和CNP;肝脏组织中参与蛋白质代谢的基因有PSEN1和DHCR24;而在腿肌中参与蛋白质代谢的差异表达基因有XPO1、ARNTL、CDO1和AMD1。热应激处理导致鸡3种组织的主要代谢反应都发生了改变,但在不同组织中涉及的差异表达基因并不相同,表明在热应激条件下,大脑、肝脏和腿肌组织具有不同的基因表达模式。
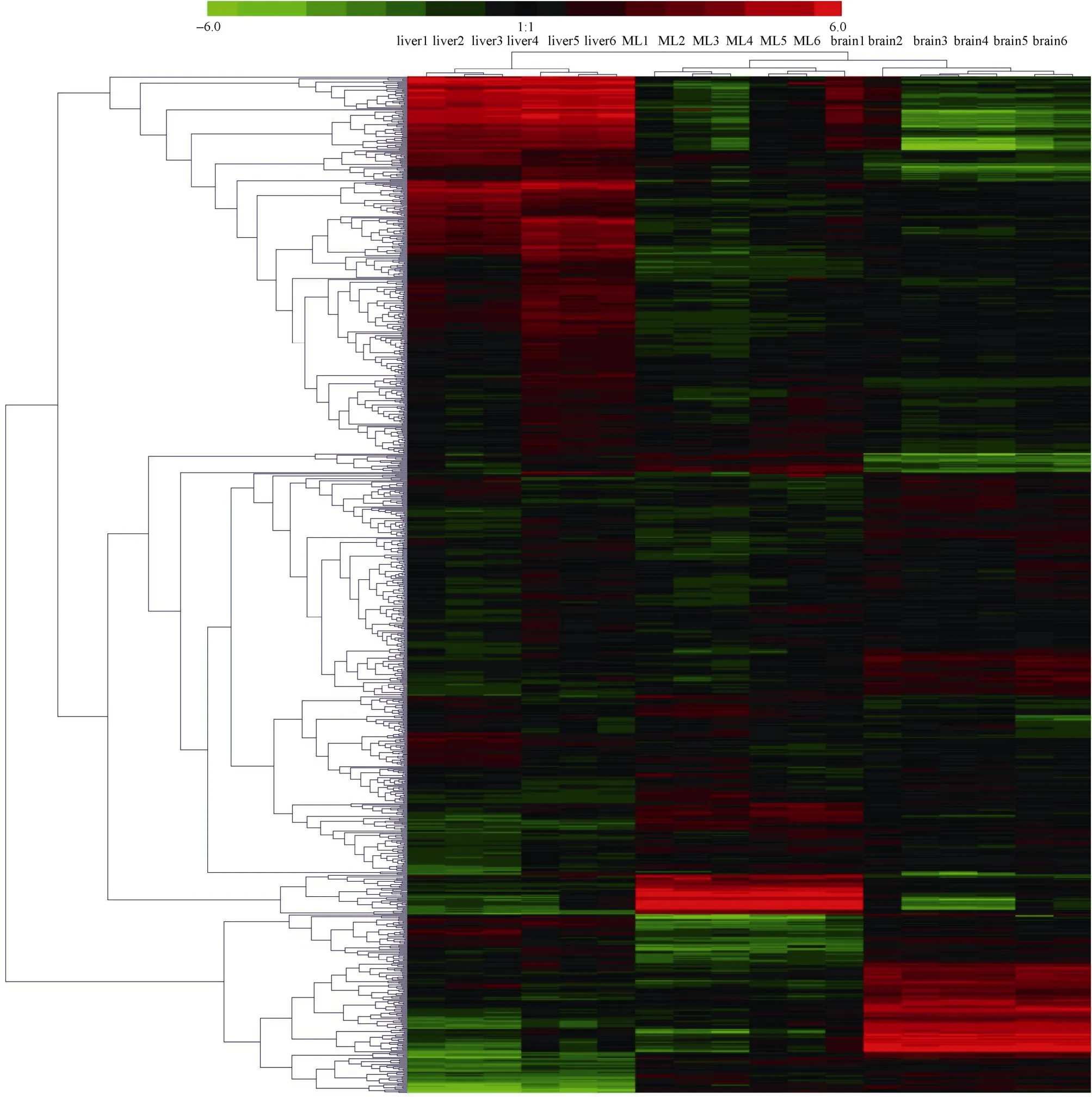
图1 3种组织芯片数据的双向聚类结果
2.6 实时定量PCR验证结果
选择 10个利用表达谱芯片检测到的差异表达基因,采用实时定量PCR方法对部分检测结果进行验证。如图2所示,大脑、肝脏、腿肌组织中利用表达谱芯片和实时荧光定量PCR两种方法所得的基因表达结果的趋势一致,相关系数(r)分别为 0.66(P≤0.037)、0.91(P≤0.0002)、0.91(P≤0.0003),表明表达谱芯片的检测结果可靠。
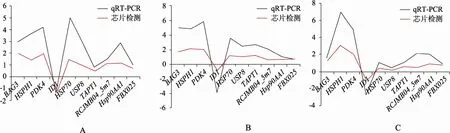
图2 表达谱芯片和实时荧光定量PCR检测基因差异表达倍数趋势比较
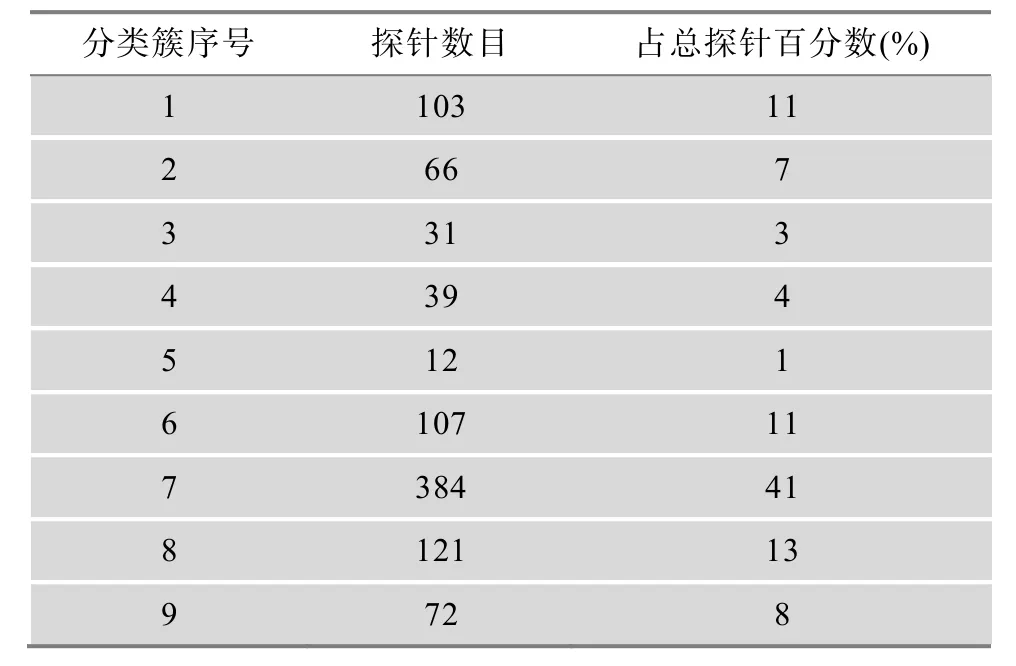
表2 935个SOM聚类探针数目情况
3 讨 论
在鸡3种组织中,HSP25表达差异较大,在脑组织上调17.37倍,肝脏组织中上调25.21倍,腿肌组织中上调 2.9倍。该基因能够有效地结合非天然蛋白并抑制蛋白折叠中间物的聚集[24,25]、抵抗细胞凋亡、在应激中保护细胞骨架的稳定[26],并能在神经胶质细胞中抵抗蛋白酶体抑制剂引起的应激[27]。研究发现,HSP25只有在剧烈、致死性热应激条件才能被诱导表达[28]。鸡HSP25能够抑制细胞外来物应激、侵扰导致的蛋白质错误折叠和聚集[29]。目前研究认为,HSP25是一种热应激反应标志性的蛋白。本研究发现HSP25在脑组织与肝脏组织的表达倍数明显高于腿肌组织,提示鸡在热应激反应过程中,脑组织与肝脏组织优先做出反应,之后可能通过其他途径调控其在别的组织中出现类似反应[30]。
在鸡3种组织中HSPH1(Hsp105)显著上调表达,在脑组织中上调2.65倍,肝组织中上调4.35倍,腿肌组织中上调7.83倍。HSPH1与Hsp70、Hsp90等热克休蛋白基因家族成员有相似功能,热处理细胞能够诱导Hsp105表达量升高[31,32],HSP105蛋白还可影响和抑制超氧化歧化酶突变体的聚集[33]。但HSPH1参与鸡热应激反应的机制尚未见报道。
HSP70表达量升高是有机体适应外界应激环境的本能反应。HSP70和HSP90蛋白作为分子伴侣帮助细胞内重要蛋白的正确折叠、避免降解,从而改善细胞在逆境胁迫下的生存能力[18,34,35]。本研究发现,鸡在热应激条件下,HSP70、HSP90和HSPA5等基因的表达量升高,其中HSP70mRNA的表达具有组织特异性,且在脑组织中的表达量比肝脏和腿肌组织高,与本课题组前期的研究结果一致[15]。
细胞凋亡是由基因控制的细胞自主有序的主动死亡过程[36,37]。半胱天冬蛋白酶(Caspase)在细胞凋亡过程中起着必不可少的作用,细胞凋亡实际上是Caspase不可逆有限水解底物的级联放大反应过程[38~40]。本研究发现,鸡热应激处理组与对照组的大脑组织中有 3个与抗细胞凋亡相关的基因表达量发生显著改变(HSPA5、CRYAB和BAG3);肝脏组织中有5个相关基因表达量发生显著改变(PROK2、EEF1A2、DHCR24、BCL2L1和BAG3);腿肌组织中则有6个相关基因表达量发生显著改变(SCG2、MITF、MAPK8、EYA1、BAG3和ALB)。BAG3在3种组织中都出现了显著的差异表达,BAG3能够协同BCL-2影响APAF1而起到抑制细胞凋亡的作用[41,42]。BAG3在热应激或其他应激源应激时还能与热应激蛋白家族成员形成复合物而产生对应激源的耐受[43],此外BAG3还具有抑制蛋白质合成和促进蛋白质自吞的功能,而该功能同时受到HSF1的调节[44,45]。
钙离子途径是一种普遍的细胞内信号传导机制,机体受到应激或细胞内激素释放时,钙离子信号途径通过钙调素(CaM)或蛋白激酶(PKC)同工酶的激活和细胞核运输调控DNA的复制、修补一级细胞循环等核事件[46]。研究发现,热休克能引起细胞内钙离子浓度发生改变、触发细胞内的钙离子突然增多,正是通过钙离子结合蛋白的转导实现的,表现为Calmodulin(CaM)钙调素蛋白、CaM-相关蛋白、钙依赖性蛋白激酶(CDPK)、神经钙蛋白(CBL)和热休克蛋白的上调表达[47~49]。本研究发现,钙离子信号通路相关基因的表达量在 3种组织中都发生了显著改变,包括大脑组织中的TNNC2、PLCB1和PRKACB基因,肝脏组织中的TNNC2、CACNA1D、EGFR、ADCY1、EDNRA和PLCG2基因及腿肌组织中的AGTR1和PRKCB基因。研究表明,应激时热休克蛋白可影响钙离子的稳态,调节细胞内钙离子电流,增加或激活钙调素蛋白[50~52],而增加钙离子在细胞浆内的释放,能够促进细胞凋亡蛋白的激活而导致细胞凋亡的发生[53]。因此,热休克蛋白能协同抗细胞凋亡相关基因(BAG家族和 Bcl-2家族基因等)发挥抗细胞凋亡的功能,而这两方面的活动相互制约平衡,从而稳定机体内环境。
MAPK(促细胞有丝分裂蛋白激酶)信号通路是激活生长因子受体下游的重要靶标。MAPK信号通路能调节细胞内活性,包括基因表达、细胞分化、细胞增殖、细胞存活和凋亡[54]。Nielsen等[20]利用全基因组表达芯片检测了果蝇在微热处理64 h前后基因的差异表达,发现果蝇机体耐热性与MAPK信号通路内的基因表达量改变有关。对家猪的研究发现,热应激诱导MAPK信号通路改变,通过小窝细胞的增殖和迁移,调节细胞损伤修复和再生,热应激前后猪大脑组织和腿肌组织中MAPK信号通路中改变的基因有 9个(PRKACB、PPM1B、MEF2C、HSP70、PRKCB、MAPK8、MAP3K4、FGFR2和FGF)。这些基因分别在细胞分化、细胞增殖、细胞存活和凋亡等生物学过程中具有重要功能,对机体细胞抗热应激起着积极的作用[55]。
本研究在全基因组水平上对鸡热应激的分子机制进行了初步探索。在热应激时,鸡大脑、肝脏和腿肌组织具有不同的基因表达模式。HSP25、HSPH1、PDK4、BAG3和ID1在3种组织中均表现为显著的上调或下调表达,揭示这些基因在鸡的热应激反应中具有重要的功能。
[1]St-Pierre NR, Cobanov B, Schnitkey G. Economic losses from heat stress by US livestock industries.J Dairy Sci,2003, 86(Suppl.): E52–E77.
[2]Rozenboim I, Tako E, Gal-Garber O, Proudman JA, Uni Z.The effect of heat stress on ovarian function of laying hens.Poult Sci, 2007, 86(8): 1760–1765.
[3]Tang S, Yu JM, Zhang M, Bao ED. Effects of different heat stress periods on various blood and meat quality parameters in young Arbor Acer broiler chickens.Can J Anim Sci,2013, 93(4): 453–460.
[4]Garriga C, Hunter RR, Amat C, Planas JM, Mitchell MA,Moretó M. Heat stress increases apical glucose transport in the chicken jejunum.Am J Physiol Regul Integr Comp Physiol, 2006, 290(1): R195–R201.
[5]Mujahid A, Yoshiki Y, Akiba Y, Toyomizu M. Superoxide radical production in chicken skeletal muscle induced by acute heat stress.Poult Sci, 2005, 84(2): 307–314.
[6]Siddegowda YKB, Leo MDM, Kumar D, Hooda OK, Prakash VR, Mishra SK. Influence of heat stress on the reactivity of isolated chicken carotid artery to vasoactive agents.Exp Physiol, 2007, 92(6): 1077–1086.
[7]Yang L, Tan GY, Fu YQ, Feng JH, Zhang MH. Effects of acute heat stress and subsequent stress removal on function of hepatic mitochondrial respiration, ROS production and lipid peroxidation in broiler chickens.Comp Biochem Physiol, 2010, 151(2): 204–208.
[8]Gross WG, Siegel HS. Evaluation of the heterophil/lymphocyte ratio as a measure of stress in chickens.Avian Dis,1983, 27(4): 972–979.
[9]Khajavi M, Rahimi S, Hassan ZM, Kamali MA, Mousavi T. Effect of feed restriction early in life on humoral and cellular immunity of two commercial broiler strains under heat stress conditions.Br Poult Sci, 2003, 44(3):490–497.
[10]Bridle BW, Julian R, Shewen PE, Vaillancourt JP, Kaushik AK. T lymphocyte subpopulations diverge in commercially raised chickens.Can J Vet Res, 2006, 70(3): 183–190.
[11]Al-Aqil A, Zulkifli I. Changes in heat shock protein 70 expression and blood characteristics in transported broiler chickens as affected by housing and early age feed restriction.Poult Sci, 2009, 88(7): 1358–1364.
[12]Lei L, Hepeng L, Xianlei L, Hongchao J, Hai L, Sheikhahmadi A, Yufeng W, Zhigang S. Effects of acute heat stress on gene expression of brain-gut neuropeptides in broiler chickens (Gallus gallus domesticus).J Anim Sci, 2013,91(11): 5194–5201.
[13]Han AY, Zhang MH, Zuo XL, Zheng SS, Zhao CF, Feng JH, Cheng C. Effect of acute heat stress on calcium concentration, proliferation, cell cycle, and interleukin-2 production in splenic lymphocytes from broiler chickens.Poult Sci, 2010, 89(10): 2063–70.
[14]Leandro NSM, Gonzales E, Ferro JA, Ferro MI, Givisiez PE, Macari M. Expression of heat shock protein in broiler embryo tissues after acute cold or heat stress.Mol Reprod,2004, 67(2): 172–177.
[15]Zhen FS, Du HL, Xu HP, Luo QB, Zhang XQ. Tissue and allelic-specific expression of hsp70 gene in chickens: basal and heat-stress-induced mRNA level quantified with real-time reverse transcriptase polymerase chain reaction.br Poult Sci, 2006, 47(4): 449–455.
[16]Sohn SH, Subramani VK, Moon YS, Jang IS. Telomeric DNA quantity, DNA damage, and heat shock protein gene expression as physiological stress markers in chickens.Poult Sci, 2012, 91(4): 829–836.
[17]Gu XH, Hao Y, Wang XL. Overexpression of heat shock protein 70 and its relationship to intestine under acute heat stress in broilers: 2. Intestinal oxidative stress.Poult Sci,2012, 91(4): 790–799.
[18]Horowitz M, Eli-Berchoer L, Wapinski L, Friedman N,Kodesh E. Stress-related genomic responses during the course of heat acclimation and its association with ischemic-reperfusion cross tolerance.J Appl Physiol, 2004,97(4): 1496–1507.
[19]Bhusari S, Hearne LB, Spiers DE, Lamberson WR, Antoniou E. Transcriptional profiling of mouse liver in response to chronic heat stress.J Therm Biol, 2008, 33(3):157–167.
[20]Nielsen MM, Sørensen JG, Kruhøffer M, Justesen J,Loeschcke V. Phototransduction genes are up-regulated in a global gene expression study of Drosophila melanogaster selected for heat resistance.Cell Stress Chaperones,2006, 11(4): 325–333.
[21]Yu J, Yin P, Liu FH, Cheng GL, Guo KJ, Lu A, Zhu XY,Luan WL, Xu JQ. Effect of heat stress on the porcine small intestine: A morphological and gene expression study.Comp Biochem Physiol, 2010, 156(1): 119–128.
[22]Altincicek B, Elashry A, Guz N, Grundler FM, Vilcinskas A, Dehne HW. Next generation sequencing based transcriptome analysis of septic-injury responsive genes in the beetle Tribolium castaneum.PLoS ONE, 2013, 8(1):e52004.
[23]Landis G, Shen J, Tower J. Gene expression changes in response to aging compared to heat stress, oxidative stress and ionizing radiation in Drosophila melanogaster.Aging,2012, 4(11): 768–789.
[24]Haslbeck M. sHsps and their role in the chaperone network.Cell Mol Life Sci, 2002, 59(10): 1649–1657.
[25]Bauer NG, Richter-Landsberg C. The dynamic instability of microtubules is required for aggresome formation in oligodendroglial cells after proteolytic stress.J Mol Neurosci, 2006, 29(2): 153–168.
[26]Gusev NB, Bogatcheva NV, Marston SB. Structure and properties of small heat shock proteins (sHsp) and their interaction with cytoskeleton proteins.Biochemistry(Mosc),2002, 67(5): 511–519.
[27]Goldbaum O, Riedel M, Stahnke T, Richter-Landsberg C.The small heat shock protein HSP25 protects astrocytes against stress induced by Proteasomal inhibition.Glia,2009, 57(14): 1566–1577.
[28]Vertii A, Hakim C, Kotlyarov A, Gaestel M. Analysis of properties of small heat shock protein Hsp25 in MAPK~activated protein kinase 2 (MK2)~deficient cells -MK2-dependent insolubilization of Hsp25 oligomers correlates with susceptibility to stress.J Biol Chem, 2006, 281(37):26966–26975.
[29]Katoh Y, Fujimoto M, Nakamura K, Inouye S, Sugahara K,Izu H, Nakai A. Hsp25, a member of the Hsp30 family,promotes inclusion formation in response to stress.FEBS Lett, 2004, 565(1–3): 28–32.
[30]Ji B, Ernest B, Gooding JR, Das S, Saxton AM, Simon J,Dupont J, Métayer-Coustard S, Campagna SR, Voy BH.Transcriptomic and metabolomic profiling of chicken adipose tissue in response to insulin neutralization and fasting.BMC Genomics, 2012, 13(1): 441–456.
[31]Hendrick JP, Hartl F. Molecular Chaperone Functions of Heat-Shock Proteins.Annu Rev Biochem, 1993, 62(1):349–384.
[32]Samali A, Orrenius S. Heat shock proteins: regulators of stress response and apoptosis.Cell Stress Chaperones,1998, 3(4): 228–236.
[33]Yamashita H, Kawamata J, Okawa K, Kanki R, Nakamizo T, Hatayama T, Yamanaka K, Takahashi R, Shimohama S.Heat-shock protein 105 interacts with and suppresses aggregation of mutant Cu/Zn superoxide dismutase: clues to a possible strategy for treating ALS.J Neurochem, 2007,102(5): 1497–1505.
[34]Pratt WB, Toft DO. Steroid receptor interactions with heat shock protein and immunophilin chaperones.Endocr Rev,1997, 18(3): 306–360.
[35]Hartl FU. Molecular chaperones in cellular protein folding.Nature, 1996, 381 (6583): 571–580.
[36]Iwamoto S, Koike Y, Hosomichi K, Hara H, Yoshida Y,Ogawa H, Hanzawa K. Identification of cDNA for the HSPA2, HSPA5 and HSPA8 orthologs of the heat shock protein 70 family from guinea fowl (Numida meleagris).Anim Sci J, 2005, 76(5): 519–524.
[37]Raff MC. Social controls on cell survival and cell death.Nature, 1992, 356(6368): 397–400.
[38]Thompson CB. Apoptosis in the pathogenesis and treatment of disease.Science, 1995, 267(5203): 1456–1462.
[39]吕翠仙, 樊廷俊, 胡国斌, 丛日山. 凋亡诱导因子与细胞凋亡. 生物化学与生物物理学报, 2003, 35(10): 881–885.
[40]樊廷俊, 夏兰, 韩贻仁. 线粒体与细胞凋亡. 生物化学与生物物理学报, 2001, 33(1): 7–12.
[41]Launay S, Hermine O, Fontenay M, Kroemer G, Solary E,Garrido C. Vital functions for lethal caspases.Oncogene,2005, 24(33): 5137–5148.
[42]Liao Q, Ozawa F, Friess H, Zimmermann A, Takayama S,Reed JC, Kleeff J, Büchler MW. The anti-apoptotic protein BAG-3 is overexpressed in pancreatic cancer and induced by heat stress in pancreatic cancer cell lines.FEBS Lett, 2001, 503(2–3): 151–157.
[43]Romano MF, Festa M, Pagliuca G, Lerose R, Bisogni R,Chiurazzi F, Storti G, Volpe S, Venuta S, Turco MC, Leone A. BAG3 protein controls B-chronic lymphocytic leukaemia cell apoptosis.Cell Death Differ, 2003, 10(3): 383–385.
[44]Takayama S, Bimston DN, Matsuzawa S, Freeman BC,Aime-Sempe C, Xie Z, Morimoto RI, Reed JC. BAG-1 modulates the chaperone activity of Hsp70/Hsc70.EMBO J, 1997, 16(16): 4887–4896.
[45]Carra S. The stress-inducible HspB8-Bag3 complex induces the elF2α kinase pathway: Implications for protein quality control and viral factory degradation?Autophagy,2009, 5(3): 428–429.
[46]庞枫, 龚兴国. 细胞内信号分子传导的研究进展. 生物化学与生物物理进展, 2000, 27(1): 24–28.
[47]Liu HT, Li B, Shang ZL, Li XZ, Mu RL, Sun DY, Zhou RG. Calmodulin is involved in heat shock signal transduction in wheat.Plant Physiol, 2003, 132(3): 1186–1195.
[48]Takatsuji H, Mori M, Benfey PN, Ren L, Chua NH. Characterization of a zinc finger DNA-binding protein expressed specifically in Petunia petals and seedlings.EMBO J,1992, 11(1): 241–249.
[49]Chen YC, Kao YH., Huang CF, Cheng CC, Chen YJ, Chen SA. Heat stress responses modulate calcium regulations and electrophysiological characteristics in atrial myocytes.J Mol Cell Cardiol, 2010, 48(4): 781–788.
[50]Franceschelli S, Rosati A, Lerose R, De Nicola S, Turco MC, Pascale M. Bag3 gene expression is regulated by heat shock factor1.J Cell Physiol, 2008, 215(3): 575–577.
[51]Szigeti G, Bányász T, Magyar J, Körtvély Á, Szigligeti P,Kovács L, Jednákovits A, Nánási PP. Effects of bimoclomol, the novel heat shock protein coinducer, in dog ventricular myocardium.Life Sci, 2000, 67(1): 73–79.
[52]Magyar J, Bányász T, Szigligeti P, Körtvély A, Jednákovits A, Nánási PP. Electrophysiological effects of bimoclomol in canine ventricular myocytes.Naunyn Schmiedebergs Arch Pharmacol, 2000, 361(3): 303–310.
[53]Liu J, Kam KW, Borchert GH, Kravtsov GM, Ballard HJ,Wong TM. Further study on the role of HSP70 on Ca2+homeostasis in rat ventricular myocytes subjected to simulated ischemia.Am J Physiol Cell Physiol, 2006, 290(2):C583–C591.
[54]Tantral L, Malathi K, Kohyama S, Silane M, Berenstein A,Jayaraman T. Intracellular calcium release is required for caspase-3 and -9 activation.CellBiochem Funct, 2004,22(1): 35–40.
[55]Sompallae R, Stavropoulou V, Houde M, Masucci MG.The MAPK Signaling Cascade is a central hub in the regulation of cell cycle, apoptosis and cytoskeleton remodeling by tripeptidyl-peptidase II.Gene Regul Syst Biol,2008, 24(2): 253–265.

