烷基苯三氧化硫磺化工艺探讨
宁静霞
(山西省运城市安监局,山西 运城 044000)
烷基苯三氧化硫磺化工艺探讨
宁静霞
(山西省运城市安监局,山西 运城 044000)

三氧化硫磺化工艺中,各步合成反应的热力学和动力学性质决定了其平衡转化率与工艺条件之间的联系。文中对有关反应过程进行了理论分析和计算。
烷基苯磺酸;合成工艺;理论分析
烷基苯磺酸是洗涤剂行业应用的最重要的阴离子表面活性剂原料之一。它与烧碱中和后所形成的烷基苯磺酸钠具有很好的去污力、泡沫力和乳化力,而且与其他表面活性剂相比具有较为明显的经济优势,因此在现代洗涤剂生产中仍然占据着主导地位。
1. 合成方法概述[1]
根据所采用磺化剂的不同,烷基苯磺酸的合成路线分为发烟硫酸磺化工艺和SO3磺化工艺两种。二者的磺化反应原理基本相同,但前者因投资少、工艺简单、操作方便而适用于较小规模的生产。然而,发烟硫酸磺化工艺以发烟硫酸为原料,反应中为了提高平衡转化率而需要使用过量硫酸,使产品分离后会副产大量的废硫酸,因此近年来正逐渐被SO3磺化工艺所取代。
从原理上讲,SO3磺化工艺主要包含两部分反应:一是从原料硫磺到SO3的制备反应;二是以SO3磺化烷基苯而合成烷基苯磺酸的反应。
在生产过程中,SO3磺化工艺主要包括四大部分:
① 空气干燥:即采用冷却和硅胶吸附的手段使空气干燥达到露点-60℃的要求,为S→SO2→SO3提供燃烧和转化用空气。
② SO3发生:使S燃烧并转化为SO3,为RC6H5的磺化提供磺化剂。
③ 磺化反应:S O3与R C6H5发生反应,合成RC6H4SO3H,再经分离、老化、水解后得到磺酸产品。
④ 尾气净化:来自磺化反应部分的尾气经过静电除雾器(ESP)和碱吸收塔处理,使SO2和SO3达到排放标准后排空。
2. SO3磺化工艺中的合成反应及其热力学、动力学分析
2.1 硫磺燃烧生成SO2的反应
硫磺燃烧生成SO2的反应为:
S + O2→ SO2+△rHθ
由此查得系统物质在298K和标准状态的热力学性质如下[2]:
△Hfθ(SO2,g)=-296.83 KJ/mol
△Gfθ(SO2,g)=-300.19 KJ/mol
Sθ(SO2,g)=248.1 J/mol.K
Sθ(O2,g)=205.03 J/mol.K
Sθ(S,g)=31.9 J/mol.K
故反应的热效应为:
△rHθ=-296.83KJ/mol
298K时,反应Gibbs函数变为:
△rGθ=-300.19 KJ/mol
反应熵变为:
△rSθ=248.1-(205.03+31.9)=11.17 J/mol.K
当温度为923K(650℃)时,反应的Gibbs函数变为:
△rGθ(923K)≠△rHθ-T×△rSθ
=-296.83-923×11.17÷1000
=-307.14 KJ/mol
可以计算平衡常数Kθ:
由△rGθ(923K)=-RT lnKθ(923K) 得:
Kθ(923K)=exp (-△rGθ/RT)
=exp [307.14×1000÷(8.314×923)]
=2.4×1017
可见,该反应是一个强放热反应,自发地正方向进行。650℃时,理论上平衡常数很大。
2.2 SO2转化为SO3的反应
SO2在V2O5催化的条件下,进一步转化为SO3,反应过程如下:
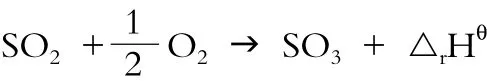
系统物质298K和标准态的热力学性质如下:
△Hfθ(SO3,g)=-395.70 KJ/mol
△Gfθ(SO3,g)=-371.10 KJ/mol
Sθ(SO3,g)=256.6 J/mol.K
故反应热效应为:
△rHθ=-395.7-(-296.83)=-98.87 KJ/mol
298K时,反应Gibbs函数变为:
△rGθ=-371.1+300.19=-70.91 KJ/mol
反应熵变为:
△rSθ=256.6-248.1-0.5×205.03=-94 J/mol.K
当温度为773K(500℃)时,反应的Gibbs函数变为:
△rGθ(773K)=△rHθ-T×△rSθ
=-98.87-773×(-94)÷1000
=-26.21 KJ/mol
Kθ(773K)=exp (-△rGθ/RT)
=exp [26.21×1000÷(8.314×773)]
=59.04
从热力学的角度分析,存在一临界温度TC,当T>TC时,SO2不能进行转化。此时,△rGθ(TC)=0。忽略温度对焓变和熵变的影响,可以确定该温度为:
TC=△rHθ÷△rSθ=-98.87×1000÷(-94)=1051.81 K(即778℃)
因此,可以计算出该反应在不同温度下的Gibbs函数变ΔrGθ和平衡常数Kθ。如表1所示。
对ΔrGθ和Kθ的数据进行分析,可以看出:在热力学方面,SO2平衡转化程度是温度的减函数(当然,是O2和SO2含量的增函数)。当t>600℃时,其反应的转化程度已经比较小了。
但是,从动力学角度考虑,反应速率是温度的增函数。在低温和没有V2O5催化剂的情况下,SO2的转化反应实质上难以进行。V2O5的存在,先使得反应分子生成了具有活性的表面中间物。这也可被认为是降低了反应所需活化能。在低于400℃时,反应速率较慢,因而同样不能在有效的时间内达到如表1中所列的转化程度。
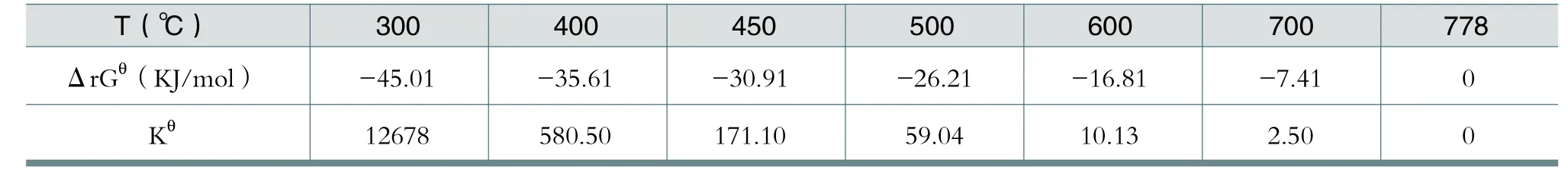
表1 不同温度下的Gibbs函数变ΔrGθ和平衡常数Kθ
综合考虑热力学和动力学因素,在温度425~500℃的区域,转化反应最为有效。据此,可以计算该反应在400℃以上温度下的平衡转化率数据α,并制作出图1。
可见,随着温度T的升高,平衡转化率α发生递减。实际工艺中,采取分段转化和段间冷却方式来维持适宜的转化温度,通常采用3~4段转化,最终转化率可达98%左右。
2.3 烷基苯(LAB)与SO3磺化生成烷基苯磺酸[3]
SO3与直链烷基苯(LAB)的磺化反应过程,主要由生成目的产物烷基苯磺酸(LASA)的主反应以及生成磺酸酐和砜等产物的副反应组成。主、副反应的反应式分列如下:
主反应:
1)快反应:R-C6H5+ 2SO3→ RC6H4SO2OSO3H(焦磺酸)
2)慢反应:RC6H4SO2OSO3H + R-C6H5→2RC6H4SO3H + △rHθ
副反应:
1)RC6H4SO2OSO3H + RC6H4SO3H
→RC6H4SO2OSO2C6H4R(磺酸酐)+ H2SO4
2)RC6H4SO2OSO3H + R-C6H5
→RC6H4SO2OSO2C6H4R(砜) + H2SO4
生成磺酸的反应热效应为:
△rHθ=-170 KJ/mol
动力学方面,反应速率同样是温度的增函数。但是,由于△rHθ<0,故温度升高则平衡常数K下降,对LAB的转化不利。同时,SO3磺化反应放热极大,反应速率极快,若控制不慎,极易造成局部过热而发生副反应,生成砜和酸酐,使产品的质量降低;若温度过低,则产物磺酸的黏度增加,对传质、传热不利,进而影响产品质量[4]。
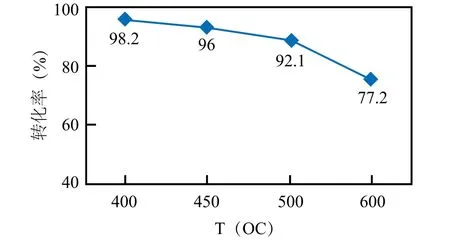
图1 不同温度下的SO2平衡转化率
从化学平衡的角度考虑,由于该反应不生成水,属不可逆反应,故不需要过量的SO3磺化剂,m(SO3)∶m(LAB)几乎为理论摩尔比。当m(SO3)∶m(LAB)过高时,也易造成过磺化反应,使产物中的砜和酸酐增多。
3. 工艺要点分析
1) 在干燥空气流量和硫磺流量保持稳定的情况下,将燃硫气体出口的温度控制在650~700℃。根据近似关系计算,此时混合气体中的SO2体积浓度约为6~7%。
2) 控制适宜的各段转化入口温度为430~450℃,以保持SO2转化率的稳定。因为SO2转化率的任何微小波动都会给后续磺化过程带来较大影响,进而导致产品质量不稳定。
3) 将磺化反应温度严格控制在40~45℃。如前所述,温度过高时,系统会发生过磺化而生成副产物,不仅使得产品中不皂化物增加,而且严重影响产品色泽。若温度过低,则反应速率太慢,导致磺化反应转化率降低,因而产品中活性物含量低,未磺化油增高。
4) 严格控制m(SO3)∶m(LAB)=1.01~1.03∶1,并保持SO3与空气的混合气体中SO3的体积浓度在7%左右。若摩尔比过高,不仅造成过磺化反应而影响产品质量,还会因尾气中SO3过多而增大尾气处理系统负荷,而且造成原料硫磺的浪费;摩尔比过低时,同样会造成LAB的转化率降低而使产品中活性物含量低,未磺化油增高。
另外,在实际生产中,控制适当的老化温度、老化时间和稳定的水解等条件,对于磺化产品质量的改善也是必需环节。
[1] 郑富源编译. 合成洗涤剂生产技术[M]. 北京: 轻工业出版社, 1988.8: 15-17.
[2] 大连理工大学编. 无机化学[M]. 北京: 高等教育出版社, 1990.4: 439-440.
[3] 方云等译. 工业磺化/硫酸化生产技术[M]. 北京: 中国轻工业出版社, 1993: 92-95.
[4] 夏纪鼎, 倪永全 主编.表面活性剂和洗涤剂化学与工艺学[M]. 北京: 中国轻工业出版社, 1997.5: 241-242.

