舒尼替尼对人高转移肝癌细胞株MHCC97-H局部黏着斑激酶表达的影响
张尘玉 张 微 李书平 杨志强 迟新楠 岳 莉
肝癌是临床上常见的恶性肿瘤之一,多数患者发现时已是晚期或伴有转移,错过了最佳手术时期[1],并且对放化疗不敏感,预后不良。近年来研究发现局部黏着斑激酶(focal adhesion kinase,FAK)的高表达促进了肝癌的侵袭和转移[2],如能有效抑制FAK,则可能抑制肿瘤的侵袭和转移,但由于目前药物均缺乏特异性,故尚无以FAK为靶点的药物。舒尼替尼(Sunitinib,Sutent)是一种新型多靶向性治疗肿瘤的口服药物,能抑制癌细胞的生长,可显著延长肝癌患者的生存期[3]。舒尼替尼是否对FAK也有靶向抑制作用,目前尚鲜见相关报道。本研究旨在探讨舒尼替尼对肝癌细胞的体外杀伤作用,以及对FAK蛋白表达水平的影响。
1 材料与方法
1.1 材料 (1)细胞株:人高转移肝癌细胞株MHCC97-H第4代,引自中国科学院上海细胞生物研究所细胞库。(2)舒尼替尼由辉瑞公司生产。(3)鼠抗人FAK多克隆抗体购自美国Abcam公司。(4)胎牛血清、胰蛋白酶购于北京博奥森生物工程有限公司。(5)四甲基偶氮唑蓝(MTT)购于北京华美公司。(6)辣根过氧化物酶标记的二抗购于北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 细胞培养 细胞在含有10%胎牛血清的DMEM培养液(含青霉素100 U/mL,链霉素100 mg/L)中生长,培养条件为37℃5%CO2饱和湿度,用0.25%胰蛋白酶和0.02%EDTA液消化传代。
1.2.2 实验分组 应用100%二甲基亚砜(DMSO)溶解舒尼替尼,于-20℃保存,使用时稀释,DMSO终浓度小于0.5%,不影响细胞生长。空白对照组不加舒尼替尼,实验组分别加入2.5、5、10和20 μmol/L的舒尼替尼,分别作用24、48和72 h。
1.2.3 瑞氏-吉姆萨染色观察细胞形态 取对数生长期细胞接种于铺有盖玻片的6孔培养板,加入FTY720,同时设阴性对照,经药物作用48 h,取片风干,滴加无水乙醇待风干,加瑞氏吉姆萨染液染色30 s,PBS浸泡2 min,洗去染液,无水乙醇固定,晾干、封片,镜检拍照。
1.2.4 MTT法检测细胞增殖抑制率 常规消化细胞,离心制成单细胞悬液,细胞计数,调整浓度至3×104/mL;用移液器每孔加入100 μL细胞悬液,接种96孔板,每组设6个复孔,同时设置6个空白调零孔。共接种4块96孔板;放入培养箱中孵育,以后每隔48 h换液1次;第2天选择取出96孔板,每孔加MTT溶液20 μL。细胞放置在37℃5%CO2的培养箱中培养4 h;小心吸弃孔内上清,每孔加入150 μL DMSO,震荡溶解10 min;在酶联免疫仪调定在570 nm波长处,测定吸光度(A)值。根据吸光度值计算细胞抑制率(%)=(1-实验组A值/空白调零组A值)×100%。
1.2.5 Western blot检测用药前后FAK的蛋白表达 收集各组细胞,加入细胞裂解液,放置在冰上15 min,在4℃10 000 r/min离心10 min,上清液采用Bradford法测蛋白含量;加入2×SDS上样缓冲液,煮沸5 min;离心,取20 μg蛋白上样到10%SDS-PAGE胶进行电泳,电转90 min后将蛋白转到PVDF膜,加入一抗(1∶1 000),在摇床上室温摇2 h,4℃孵育过夜;加入辣根过氧化物酶标记的二抗(1∶700)孵育1 h。最后用发光试剂发光,X线胶片进行曝光、显影、定影。以β-ac⁃tin为内参,Western blot检测FAK的蛋白表达水平,通过Quantity One软件对结果进行定量分析。以各组FAK表达水平的光密度(OD)值与β-actin OD值比即为相对表达量
1.3 统计学方法 采用SPSS 17.0软件进行统计分析,计量资料采用均数±标准差(±s)表示,不同时间资料比较采用重复测量资料方差分析,同一时间点不同浓度组之间数据比较采用单因素方差分析,多重比较采用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态 光镜下未经舒尼替尼作用的MHCC97-H细胞无核碎裂及溶解等现象,见图1A。舒尼替尼10 μmol/L浓度下作用48 h后可观察到大部分细胞发生凋亡,细胞膜完整,但胞浆出现发泡现象,染色质固缩、胞核碎裂及凋亡小体等典型的凋亡形态,见图1B。

Figure 1 The cell morphology of MHCC97-H before and after sunitinib treatment(Wright-Giemsa stain,×200)图1 舒尼替尼作用前后MHCC97-H细胞形态学的影响(瑞氏-吉姆萨染色,×200)
2.2 舒尼替尼对肝癌MHCC97-H细胞的抑制作用 MHCC97-H细胞经舒尼替尼2.5、5、10和20 μmol/L处理后,细胞均出现不同程度的抑制,作用48 h时抑制率最明显,各组比较差异均有统计学意义(P<0.05),见表1。
Table 1 Comparison of inhibitory rates of MHCC97-H between different concentrations and different times of sunitinib treatment表1 舒尼替尼不同浓度作用时间下肝癌细胞MHCC97-H抑制率比较(n=3,%,±s)

Table 1 Comparison of inhibitory rates of MHCC97-H between different concentrations and different times of sunitinib treatment表1 舒尼替尼不同浓度作用时间下肝癌细胞MHCC97-H抑制率比较(n=3,%,±s)
*P<0.05,**P<0.01;F时间=213.995,F分组=1 188.270,F交互= 15.329,均P<0.01;a与(1)组比较,b与(2)组比较,c与(3)组比较,d与(4)组比较,P<0.05;表2同
组别空白对照组(1)2.5 μmol/L组(2)5.0 μmol/L组(3)10 μmol/L组(4)20 μmol/L组(5)F 24 h 0.300±0.100 22.983±1.311a 36.580±1.367ab 48.350±1.145abc 47.270±0.944abc 1 036.650**48 h 0.433±0.115 32.863±1.471a 49.240±2.256ab 63.797±2.707abc 58.887±3.409abcd 374.730**72 h 0.567±0.058 30.787±1.732a 44.923±1.696ab 61.260±1.366abc 57.847±0.664abcd 1 113.618**
2.3 Western blot检测FAK的蛋白表达 舒尼替尼作用于肝癌细胞48 h时抑制率最明显,FAK蛋白表达水平出现不同程度的下降,见图2、表2。
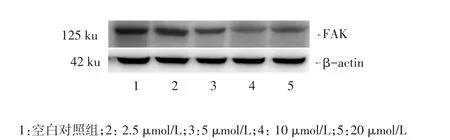
Figure 2 The effects of different concentrations of sunitinib on the expression of FAK图2 不同浓度舒尼替尼对FAK蛋白表达的影响
Table 2 The effects of different concentrations of sunitinib on the expression of FAK protein表2 不同浓度舒尼替尼对FAK蛋白表达的影响(n=3,±s)

Table 2 The effects of different concentrations of sunitinib on the expression of FAK protein表2 不同浓度舒尼替尼对FAK蛋白表达的影响(n=3,±s)
组别空白对照组(1)2.5 μmol/L组(2)5.0 μmol/L组(3)10 μmol/L组(4)20 μmol/L组(5)F FAK蛋白表达量0.980±0.004 0.838±0.008a 0.706±0.002ab 0.555±0.002abc 0.608±0.005abcd 162.459**
3 讨论
3.1 研究背景 原发性肝癌作为五大恶性肿瘤之一,每年大约有50万的新发病例[4],其中肝细胞癌(HCC)是最常见且预后最差的类型[5]。肝癌对放化疗不敏感,患者预后较差,因此靶向治疗为肝癌患者带来了新的希望。无论侵袭还是转移都是在多基因作用下形成的,任何致癌基因的过度表达及抑癌基因的缺失都会导致侵袭和转移的发生。不少分子靶向药物也应运而生,但临床上应用的肿瘤标志物在肿瘤鉴别的灵敏度及特异度均未达到理想的程度。3.2 FAK与肿瘤的关系 FAK是由Schaller等首先发现的一种非受体酪氨酸激酶,在多种恶性肿瘤中高表达或过度激活。有研究发现FAK能促进肝癌细胞的侵袭和转移,是肝癌患者无病生存率和总生存率的独立预后影响因素之一[6]。动物模型研究发现,降低FAK的表达可以减少肝癌细胞的转移[7],围绕FAK开发新的靶向药物以抑制肿瘤细胞的侵袭和转移,成为目前的研究热点,但由于药物均缺乏特异性,结果并不理想。目前单靶点/单基因的药物种类较多,疗效不一,成本也相当昂贵,因此寻求多靶点药物成为治疗肿瘤患者的首要目标。
3.3 舒尼替尼在治疗肝癌方面的应用 舒尼替尼是一种多靶点酪氨酸激酶抑制剂,具有抗血管生成活性[8],在治疗转移性肾癌方面取得了较好的疗效[9],它能降低肿瘤细胞的生长速度,并提高患者的生存期。研究发现舒尼替尼对肝癌患者同样有效,它能抑制血管内皮生长因子(VEGF)受体,延长肝癌患者的总生存期[10]。舒尼替尼可能通过VEGF、细胞外调节蛋白激酶(ERK)等多条信号转导通路作用于癌细胞[11-12],并能提高自然杀伤(NK)细胞的杀伤活性[13]。但其是否对FAK也有靶向抑制作用,目前国内外鲜见相关文献报道。
3.4 本研究的意义和局限性 本研究显示舒尼替尼作用于人高转移肝癌MHCC97-H细胞株48 h后抑制率达峰值,可出现典型的细胞凋亡形态,且在2.5~20 μmol/L浓度范围内出现了不同程度的抑制,10~20 μmol/L可能是抑制细胞的最佳浓度,体外药物实验可能为临床的最佳给药浓度提供一定的参考。经不同浓度舒尼替尼作用48 h时抑制最明显,肝癌MHCC97-H细胞中FAK的蛋白表达出现了不同程度的下调,这表明舒尼替尼对特异性不高的FAK也存在一定的靶向抑制作用,其具体的作用机制仍需要进一步探索和研究。
[1] Chaudhury PK,Hassanain M,Bouteaud JM,et al.Complete re⁃sponse of hepatocellular carcinoma with sorafenib and Y radioembo⁃lization[J].Curr Oncol,2010,17(5):67-69.
[2]Luedde T.MicroRNA-151 and its hosting gene FAK(focal adhe⁃sion kinase)regulate tumor cell migration and spreading of hepato⁃cellular carcinoma[J].Hepatology,2010,52(3):1164-1166.doi: 10.1002/hep.23854.
[3]Yeo W,Chen PJ,Furuse J,et al.Eastern Asian expert panel opin⁃ion:designing clinical trials of molecular targeted therapy for hepa⁃tocellular carcinoma[J].BMC Cancer,2010,10:620.doi:10.1186/ 1471-2407-10-620.
[4] Horger M,Lauer UM,Schraml C,et al.Early MRI response monitor⁃ing of patients with advanced hepatocellular carcinoma under treat⁃ment with the multikinase inhibitor sorafenib[J].BMC Cancer, 2009,9:208.doi:10.1186/1471-2407-9-208.
[5]Yang ZQ,Yang ZY,Zhang LD,et al.Increased liver-infiltrating CD8+FoxP3+regulatory T cells are associated with tumor stage in hepatocellular carcinoma patients[J].Hum Immunol,2010,71(12): 1180-1186.doi:10.1016/j.humimm.2010.09.011.
[6]Yuan Z,Zheng Q,Fan J,et al.Expression and prognostic signifi⁃cance of focal adhesion kinase in hepatocellular carcinoma[J].J Cancer Res Clin Oncol,2010,136(10):1489-1496.doi:10.1007/ s00432-010-0806-y.
[7]Xu WJ,Zhang S,Zhang N,et al.RNA interference targeting focal adhesion kinase inhibited the growth of human hepatocellular carci⁃noma sk-hep-1[J].Sichuan Da Xue Xue Bao Yi Xue Ban,2011,42(4):455-460.
[8] Harmon CS,DePrimo SE,Raymond E,et al.Mechanism-related circulating proteins as biomarkers for clinical outcome in patients with unresectable hepatocellular carcinoma receiving sunitinib[J].J Transl Med,2011,9:120.doi:10.1186/1479-5876-9-120.
[9]Yoshino T,Kawai K,Miyazaki J,et al.A case of acute adrenal insuf⁃ficiency unmasked during sunitinib treatment for metastatic renal cell carcinoma[J].Jpn J Clin Oncol,2012,42(8):764-766.doi: 10.1093/jjco/hys070.
[10]Serova M,de Gramont A,Tijeras-Raballand A,et al.Benchmark⁃ing effects of mTOR,PI3K,and dual PI3K/mTOR inhibitors in he⁃patocellular and renal cell carcinoma models developing resistance to sunitinib and sorafenib[J].Cancer Chemother Pharmacol,2013, 71(5):1297-1307.doi:10.1007/s00280-013-2129-6.
[11]Piscazzi A,Costantino E,Maddalena F,et al.Activation of the RAS/ RAF/ERK signaling pathway contributes to resistance to sunitinib in thyroid carcinoma cell lines[J].J Clin Endocrinol Metab,2012,97(6):E898-906.doi:10.1210/jc.2011-3269.
[12]Fenton MS,Marion KM,Salem AK,et al.Sunitinib inhibits MEK/ ERK and SAPK/JNK pathways and increases sodium/iodide sym⁃porter expression in papillary thyroid cancer[J].Thyroid,2010,20(9):965-974.doi:10.1089/thy.2010.0008.
[13]Krusch M,Salih J,Schlicke M,et al.The kinase inhibitors sunitinib and sorafenib differentially affect NK cell antitumor reactivity in vi⁃tro[J].J Immunol,2009,183(12):8286-8294.

