小剂量纳洛酮联合曲马多用于妇科腹腔镜术后镇痛的临床观察
谢惠萍
广西鹿寨县妇幼保健院妇产科 545600
腹腔镜手术具有创伤小、术中出血量少、术后并发症少及恢复快等优势,被临床广泛的使用[1]。近年来,随着腹腔镜手术病例的逐年增加及患者对术后疼痛小的要求提高,术后疼痛逐渐受到临床医生的重视。本研究采用联合小剂量氯胺酮和曲马多用于妇科腹腔镜术后镇痛,观察联合镇痛的效果,现报告如下。
1 对象与方法
1.1 研究对象 收集2011年6月-2012年6月于我院妇科行腹腔镜手术治疗的患者104例。病例纳入标准:术前心肺功能正常,美国麻醉师协会(ASA)分级Ⅰ~Ⅱ级;无慢性疼痛史,无长期应用镇痛镇、静药物史。根据随机数字表法分为曲马多组和联合组,各52例。曲马多组年龄21~41(26.7±3.2)岁;体质量44~80(63.1±10.8)kg;腹腔镜下子宫全切术9例,子宫肌瘤核除术20例,输卵管切除术15例,卵巢瘤摘除术8例。联合组年龄22~40(26.2±3.0)岁;体质量43~81(63.0±10.2)kg;腹腔镜下子宫全切术7例,子宫肌瘤核除术21例,输卵管切除术14例,卵巢瘤摘除术10例。两组年龄、体质量及手术方式无明显差异。
1.2 镇痛方法 所有患者均于麻醉前30min肌注阿托品0.5mg,进入手术室后静注芬太尼0.2mg、阿曲库铵0.5mg/kg、丙泊酚2mg/kg,诱导气管插管。术中吸氧、氧化亚氮,均为每分钟吸入1.0~2.0L,同时吸入1%~2%安氟醚维持麻醉效果,必
要时可追加芬太尼和阿曲库胺,剂量分别为2μg/kg、0.2mg/kg。维持呼气末二氧化碳分压在38~42mmHg。手术结束时静注阿托品0.5mg、新斯的明1mg,待患者苏醒,自主呼吸、吞咽、咳嗽反射恢复,生命体征稳定后拔除气管导管。曲马多组离室前静注曲马多100mg;联合组离室前静注曲马多100mg,纳洛酮0.4mg。
1.3 观察指标 观察两组术后即刻(T0)、1h(T1h)、6h(T6h)和24h(T24h)的疼痛程度,平均动脉压(MAP)、心率(HR)情况。同时观察术后2h寒战、术后24h恶心、呕吐情况。疼痛程度采用视觉模拟评分法(VAS)评价:最低分0分,提示无痛,最高分为10分,提示剧烈疼痛。
1.4 统计学方法 VAS、MAP、HR及恶心、呕吐评分采用(±s)表示,不同时间点采用协方差分析,组间比较采用t检验,计数资料采用χ2检验以α=0.05为检验标准(P<α为差异有统计学意义),软件版本为SPSS19.0。
2 结果
2.1 两组患者不同时间点VAS评分比较情况联合组在T0、T1h、T6h时VAS评分明显低于曲马多组(P<0.05),但T24h时联合组与曲马多组VAS评分无明显差异(P>0.05)。见表1。
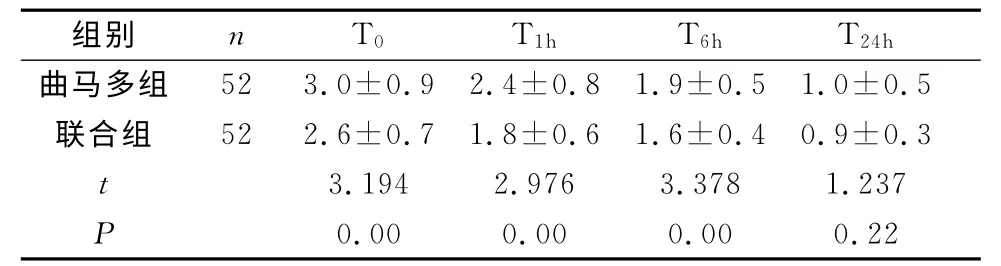
表1 两组患者不同时间点VAS评分比较情况(x±s)
2.2 两组患者不同时间点MAP、HR变化情况两组术前及术后T24hMAP、HR无明显差异,联合组术后T0、T1h、T6h时MAP、HR均明显低于曲马多组,差异有统计学意义(P<0.05),见表2、表3。
表2 两组患者不同时间点MAP比较情况(±s)
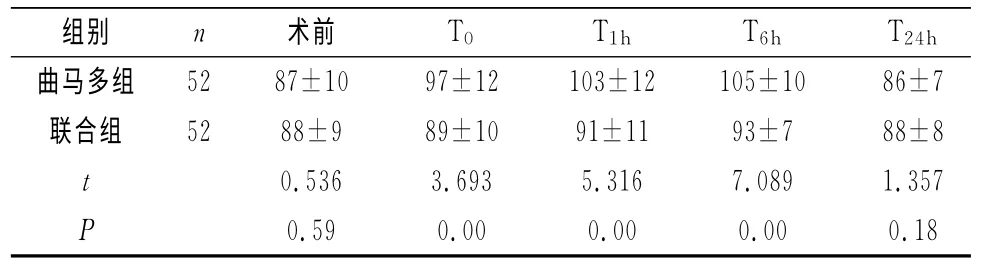
表2 两组患者不同时间点MAP比较情况(±s)
?
表3 两组患者不同时间点HR比较情况(±s)
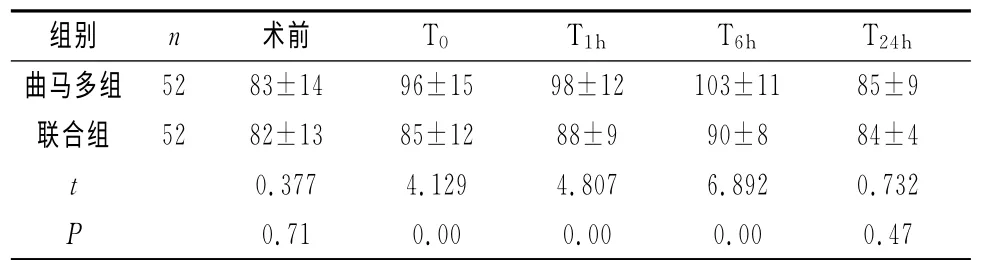
表3 两组患者不同时间点HR比较情况(±s)
?
2.3 两组不良反应发生情况 术后24h,联合组4例伴有恶心,3例伴有呕吐症状,对症处理后好转,恶心、呕吐发生率为13.5%(7/52)。曲马多组10例恶心,8例呕吐,恶心、呕吐发生率为34.6%(18/52)。联合组恶心、呕吐发生率明显低于曲马多组。术后2h,联合组寒战发生率为3.8%(2/52),曲马多组为25.0%(13/52),联合组寒战发生率明显低于曲马多组(P<0.05)。
3 讨论
众多研究证实,约63%的腹腔镜手术妇科患者术后存在膈肌及肩端疼痛,此类疼痛是影响患者不适的主要原因。另外腹腔镜术后易发生恶心、呕吐。目前,大多数患者于腹腔镜术后应用镇痛剂以缓解疼痛[2]。过去主要采用腹腔内给予局麻药及甾体类抗炎药缓解疼痛。曲马多是近年来研究较多的术后镇痛药物,其极少发生临床意义上的呼吸抑制,既能缓解疼痛,还能获得较稳定的血流动力学。纳洛酮是一种阿片受体特异性拮抗剂。研究报道,低剂量纳洛酮可有效提高阿片受体激动剂如吗啡等的镇痛作用,还可明显减少不良反应,包括耐受性及成痛性[3]。胡柳青等[4]研究将低剂量纳洛酮联合曲马多应用开腹手术中,结果发现,纳洛酮联合曲马多组患者的镇痛效果明显优于单纯的曲马多组。本研究结果亦显示,联合组术后T0、T1h、T6h时VAS评分明显低于曲马多组(P<0.05),且MAP、HR均明显低于曲马多组(P<0.05),说明曲马多联合低剂量纳洛酮提高了镇痛效果,且血流动力学较稳定,这一定程度促进了腹腔镜手术患者术后恢复。
纳洛酮可拮抗曲马多与阿片受体结合的镇痛通路,但不会影响5-羟色胺(5-HT)、去甲肾上腺素(NE)相关镇痛通路。近期的研究表明,小剂量阿片受体拮抗药能增强阿片受体激动药的镇痛效能,还可有效减少恶心、呕吐、瘙痒等不良反应[5],但其确切机制尚不明了。Kitahara等[6]研究表明,小剂量纳洛酮可减少镇痛药物的消耗量,且能获得与原剂量相同的镇痛效果;可显著减少镇痛药物的不良反应[7];大剂量纳洛酮可能会降低镇痛药物的镇痛效应,增加不良反应,由此推测,纳洛酮可能是通过拮抗曲马多与阿片受体的结合途径而达到提高曲马多的镇痛效果和抑制其不良反应发生的目的,而且这种拮抗作用可能与纳洛酮的剂量有关。小剂量纳洛酮可特异性阻断GS蛋白偶联的兴奋作用而产生镇痛效果,减少曲马多的使用量,故降低了不良反应的发生率[8];可提高阿片受体表达,促进内源性阿片肽释放,从而增加术后镇痛效果[9]。曲马多为部分激动药,纳洛酬是阿片受体拮抗药,增加纳洛酮剂量后,可优先结合阿片受体,因此降低了阿片受体和曲马多的结合,使得镇痛效果减弱。
总而言之,曲马多联合小剂量纳洛酮可增强曲马多的镇痛效果,降低其消耗量,对血流动力学影响较轻,不良反应少,安全可靠,对患者术后恢复非常有利。因此,曲马多联合小剂量纳洛酮对术后镇痛效果安全、有效,是腹腔镜术后镇痛较好的方法。
[1] 解寒冰,孙德利,夏云展.腹腔镜手术与开腹手术治疗老年胃十二指肠穿孔的疗效对比〔J〕.中国老年学杂志,2013,33(11):2556-2557.
[2] 田香.腹腔镜手术后舒芬太尼单次剂量镇痛效果的比较〔J〕.重庆医学,2013,42(14):1646-1647.
[3] 尹柏双,付连军,宋永利,等.纳洛酮的药理特性及其在麻醉镇痛中的应用〔J〕.安徽农业科学,2013,18(9):152-153.
[4] 胡柳青,宋苏沛,王振恒,等.低剂量纳洛酮对曲马多镇痛效应的影响〔J〕.世界临床药物,2010,31(3):157-158.
[5] 陈春,龚园,杨鹏,等.低剂量纳洛酮对曲马多镇痛效应的影响〔J〕.四川医学,2012,33(7):1169-1171.
[6] Kitahara M,Kojima K,HanadaM,et al.EffectivenessoforaItramadol hydrochloride for chronicnon-malignantpain〔J〕.Masui,2009,58(8):971-975.
[7] Joshi GG,Thakur BS,Sircar S,et al.Role of intravenous naloxone in severepruritus of acute cholestasisl〔J〕.Indian Joumal of Gastroenterelogy,2009,28(5):180-182.
[8] 张一肖,何珂,陶伟荣,等.低剂量纳洛酮对舒芬太尼镇痛效应的影响〔J〕.世界临床药物,2010,31(6):329-330.
[9] 何珂,刘毅,么继钢,等.小剂量纳洛酮对瑞芬太尼镇痛效应的影响〔J〕.徐州医学院学报,2008,28(10):667-668.

