阿托伐他汀对糖皮质激素性股骨头坏死骨组织MMP / TIMP 系统的影响
王建忠 武永刚 董慧珍
. 论著 Original article .
阿托伐他汀对糖皮质激素性股骨头坏死骨组织MMP / TIMP 系统的影响
王建忠 武永刚 董慧珍
目的观察阿托伐他汀对长期应用皮质激素大鼠骨组织中基质金属蛋白酶-2 ( matrix metalloproteinase-2,MMP-2 )、基质金属蛋白酶-9 ( matrix metalloproteinase-9,MMP-9 ) 及其特异性抑制因子基质金属蛋白酶组织抑制剂-1 ( tissue inhibitor of matrix metalloproteinases-1,TIMP-1 ) 和基质金属蛋白酶组织抑制剂-2 ( tissue inhibitor of matrix metalloproteinases-2,TIMP-2 ) mRNA 表达的影响,探讨阿托伐他汀预防激素性股骨头坏死的效果及其作用机制。方法健康 SD 大鼠 30 只,采用数字随机法,分为激素组、阿托伐他汀组和对照组 3 个组,每组 10 只。激素组和阿托伐他汀组给予肌内注射醋酸泼尼松龙 12.5 mg / kg,每周 2 次;阿托伐他汀组同时给予阿托伐他汀 1 mg / kg 灌胃,每日 1 次 ( 按每千克体重最大用量给药,每天最大用量是 60 mg,实验动物给药量为 60 mg / 60 kg 体重 );对照组只给予相同体积生理盐水肌注。给药后 4 周取左侧股骨头骨组织石蜡包埋,HE 染色,鉴定骨质疏松和股骨头坏死情况;取右侧股骨头骨组织提取总 RNA,采用逆转录聚合酶链反应 ( RT-PCR ) 技术检测 MMP-2、MMP-9、TIMP-1 和 TIMP-2 的 mRNA 表达水平。结果激素组与阿托伐他汀组各有 1 只动物死亡。对照组股骨头骨组织切片 HE 染色可见骨小梁由板层骨构成,绝大多数小梁骨陷窝内可见骨细胞,小梁间为血管和骨髓。激素组表现为骨小梁稀疏和大量不连续的骨碎片及骨髓坏死,碎片骨陷窝内骨细胞大部分消失,周围有大量炎性肉芽组织,阿托伐他汀组介于两者之间,轻度炎性细胞浸润,骨小梁略纤细,多数小梁骨陷窝内可见骨细胞,小梁间为血管和骨髓。MMP-2 在激素组、阿托伐他汀组、对照组中的表达分别为 0.15±0.04、0.10±0.09、0.09±0.03;MMP-9 在 3 组中的表达分别为 0.13±0.03,0.11±0.05 和 0.08±0.02;TIMP-1 在 3 组中的表达分别为 0.07±0.02,0.15±0.05 和 0.18±0.04;TIMP-2 在3 组中的表达分别为 0.45±0.15,0.73±0.08 和 0.69±0.19。激素组与对照组比较,MMP-2、MMP-9 mRNA 表达增高,TIMP-1、TIMP-2 mRNA 的表达降低,差异有统计学意义 ( P<0.05 );阿托伐他汀组与对照组比较,除 MMP-9 差异有统计学意义外,其余差异无统计学意义;阿托伐他汀组与激素组比较,MMP-2、MMP-9 mRNA 表达降低,TIMP-1、TIMP-2 mRNA 表达增高,差异有统计学意义 ( P<0.05 )。结论醋酸泼尼松龙上调大鼠骨组织中 MMP-2、MMP-9 mRNA 的表达水平,下调 TIMP-1、TIMP-2 的表达水平,使 MMPs / TIMPs比值升高。阿托伐他汀可以拮抗皮质激素对 MMPs / TIMPs 系统的调控。
糖皮质激素类;骨坏死;受体,细胞因子;药物评价
基质金属蛋白酶 ( matrix metalloproteinase,MMPs ) 及其特异性抑制因子基质金属蛋白酶组织抑制剂 ( tissue inhibitor of matrix metalloproteinases,TIMPs ) 是参与降解包括骨在内的全身各种组织细胞外基质的蛋白酶家族。已证实 MMPs / TIMPs 系统在机体各种组织的发育和修复[1-2]、肿瘤的发生发展[3-6]、炎症反应[7]等过程中都发挥着重要的作用,而且与激素性骨坏死的发生也存在一定关系[8]。成熟破骨细胞的活化是骨吸收的前提,成骨细胞通过分泌 MMPs 来完成对破骨细胞的活化。其中,MMPs中的胶原酶发挥重要的介导作用。Holliday 等[9]发现在胶原酶抑制剂存在条件下破骨细胞的骨吸收作用被明显抑制,而在半胱氨酸蛋白酶抑制剂或其它MMPs 抑制剂存在条件下破骨细胞的骨吸收作用只能部分减弱。这表明邻近破骨细胞的基质细胞和成骨细胞通过释放大量胶原酶分解胶原产生胶原质片段从而激活破骨细胞的骨吸收作用。可见胶原酶不仅直接参与破骨细胞的骨吸收过程,而且是成骨细胞诱导破骨细胞骨吸收的中介因子之一。
研究表明 MMPs 也参与了被活化的破骨细胞向矿化骨表面的移行和贴附过程。Sato 在兔破骨细胞中检测到高表达的 MT1-MMP,而且 MT1-MMP 与相应于板状伪足和伪足小体区域的基底膜反应。推测MT1-MMP 与破骨细胞的迁移和贴附有关。另外 Sato等[10]将纯化的破骨细胞分别培养于涂或未涂胶原的骨片上。在未涂胶原的骨片上 MMPs 抑制剂未能抑制骨陷窝的形成,而在涂有胶原的骨片上 MMPs 抑制剂有效的抑制了骨陷窝的形成。使用其它类的蛋白酶抑制剂没有出现这种现象。表明破骨细胞依赖于部分 MMPs 的活动以移行到骨吸收区域。可见,MMPs 不仅直接参与骨基质降解,而且破骨细胞的迁移和贴附也依赖于部分 MMPs 的活动。
Mattot 等[11]对小鼠胚胎发育的研究发现,在长骨和肋骨的肥大软骨细胞中或迁移到长骨骨形成区域的成骨细胞和内皮细胞中有胶原酶的转录积聚,而 TIMP-2 的基因转录要提前于胶原酶。提示TIMP-2 不仅局限在转录后,而且在转录水平对其有调控作用。而在病理骨改建中对 MMPs 的调控作用的失调导致 MMPs 的过量表达。Rubin 等[12]通过建立废用尺骨的动物模型研究胶原酶-1 的表达,发现胶原酶-1 在废用尺骨骨细胞中的表达明显高于正常尺骨。在对骨质疏松的研究中发现:在骨质疏松小鼠的胫骨中,破骨细胞释放的 MMP-9 较正常小鼠高约 4 倍。Bord 等[13]发现在正常的新生肋骨中破骨细胞持续表达一定数量的 TIMP-1,而在病理性骨和异位骨中破骨细胞不表达或表达很少的 TIMP-1。这表明 TIMP 与 MMPs 之间的平衡影响骨的转换和改建过程。
近年有研究表明,他汀类药物因其降脂功能被用来防治激素性骨质疏松与股骨头坏死,但未见关于阿托伐他汀对激素性股骨头坏死骨组织 MMPs / TIMPs 系统作用的研究。本实验中,我们对长期应用糖皮质激素 SD 大鼠,预防性给予阿托伐他汀干预,通过逆转录聚合酶链反应 ( reverse transcriptase polymerase chain reaction,RT-PCR ),观察阿托伐他汀对大鼠股骨头骨组织 MMP-2、MMP-9、TIMP-1、TIMP-2 mRNA 表达的影响,评估阿托伐他汀是否可以通过对 MMPs / TIMPs 系统的作用来预防激素性骨坏死,为临床应用阿托伐他汀预防激素性骨坏死提供新的实验依据。
材料与方法
一、实验动物
3 个月龄的健康 SD 大鼠 30 只,雌雄各半,体重 250~300 g,由西安交通大学医学院动物实验中心提供。
二、主要仪器与试剂
ABI 7000 型 Real-time PCR 仪为美国 ABI 公司产品;醋酸泼尼松龙由湖北制药有限公司提供;阿托伐他汀由辉瑞制药有限公司提供;骨组织 RNA 提取试剂 Trizol 为美国 Invitrogen 公司产品;逆转录-多聚酶链反应试剂盒为立陶宛 Fermentas 公司产品;引物由大连宝生物工程有限公司合成。
三、动物造模、分组及药物处理
30 只大鼠采用数字随机法,分为激素组、阿托伐他汀组和对照组 3 个组,每组 10 只。激素组和阿托伐他汀组给予 12.5 mg / kg 醋酸泼尼松龙肌注,每周 2 次;阿托伐他汀组同时给予阿托伐他汀1 mg / kg 灌胃 ( 按每千克体重最大用量给药,每天最大用量是 60 mg,实验动物给药量为 60 mg / 60 kg 体重 ),每日 1 次;对照组给予相同体积的生理盐水,每周 2 次。
四、组织学检查
用药后 4 周处死动物,取左侧股骨头,10% ( 体积分数 ) 甲醛溶液固定,乙二胺四乙酸 ( EDTA ) 脱钙,梯度酒精脱水,石蜡包埋,切成 5 μm 厚切片,HE 染色,显微镜下观察,鉴定股骨头坏死情况。诊断标准参照 2006 年我国制定的股骨头坏死诊断和治疗的专家建议:活检显示骨小梁的骨细胞空陷窝多于 50%,且累及邻近多处骨小梁有骨髓坏死。
五、RT-PCR 检测
Real-time PCR 仪检测大鼠骨组织中 MMP-2、MMP-9、TIMP-1 和 TIMP-2 mRNA 的表达水平。
1. 骨标本总 RNA 的提取:处死大鼠,快速取出右侧股骨大转子,剔除软骨后置于盛有 1 ml Trizol 的研磨器中仔细研碎并孵育 5 min,三氯甲烷沉淀,离心 ( 1500 r / min,离心半径 5 cm,20 min )后取上清液。用等体积的异丙醇沉淀 RNA 后离心( 1500 r / min,离心半径 5 cm,20 min ) 去上清液,750 ml / L 乙醇洗涤,风干后用焦碳酸二乙酯处理水溶解,经过电泳证实提取总 RNA 完整性,保证 RNA总量能够满足下一步实验。
2. cDNA 第一链的合成:取总 RNA 500 ng,加随机引物 1 μl,焦碳酸二乙酯处理水补至 12 μl,依照逆转录反应试剂盒说明书合成 cDNA 第一链,保存于 -70 ℃ 冰箱。
3. RT-PCR 检测:根据目的基因在 GenBank中的已知序列,采用 Premier 5.0 软件设计引物( 表 1 )。选 25 μl 反应体系,参照 Real-time PCR 仪说明书,三步法进行 PCR 反应。反应条件:95 ℃35 s,1 个循环预变性;95 ℃ 5 s 变性,58 ℃ 20 s退火, 72 ℃ 35 s 延伸,45 个循环。通过 ABI prism 7000 SDS 软件对各组目的基因作相对定量。
六、统计学处理
所有实验数据均采用 SPSS 13.0 软件进行统计学处理。计量资料均数用 x-±s 表示,多组间均数比较采用单因素方差分析,组间两两比较采用 LSD-t 检验,P<0.05 为差异有统计学意义。
结 果
一、各组大鼠股骨头骨组织镜下所见
4 周时,激素组与阿托伐他汀组各有 1 只动物死亡。死亡原因主要是饮食量逐渐减少,体重下降,全身逐渐衰竭。对照组股骨头骨组织切片 HE染色可见骨小梁由板层骨构成,绝大多数小梁骨陷窝内可见骨细胞,小梁间为血管和骨髓。激素组表现为骨小梁稀疏和大量不连续的骨碎片及骨髓坏死,碎片骨陷窝内骨细胞大部分消失,周围有大量炎性肉芽组织,阿托伐他汀组介于两者之间,轻度炎性细胞浸润,骨小梁略纤细,多数小梁骨陷窝内可见骨细胞,小梁间为血管和骨髓 ( 图 1 )。

表1 实时定量 PCR 的引物序列Tab.1 Primer sequences of real time quantitative PCR
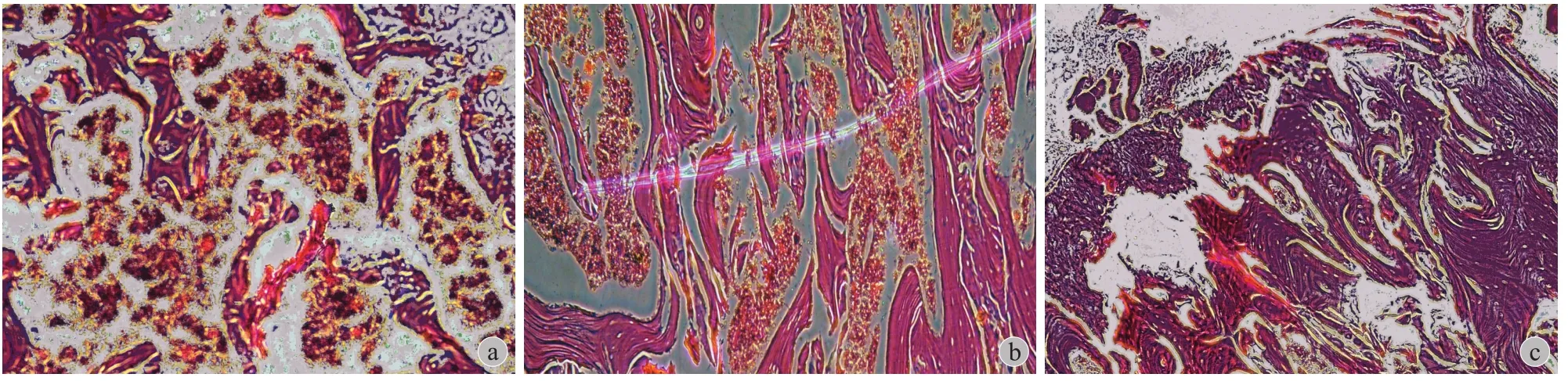
图1 3组大鼠股骨头骨组织 a:激素组 :骨小梁稀疏和大量不连续的骨碎片及骨髓坏死,碎片骨陷窝内骨细胞大部分消失,周围有大量炎性肉芽组织 ( HE ×40 );b:阿托伐他汀组:轻度炎性细胞浸润,骨小梁略纤细,多数小梁骨陷窝内可见骨细胞,小梁间为血管和骨髓 ( HE ×20 );c:对照组:骨小梁由板层骨构成,绝大多数小梁骨陷窝内可见骨细胞,小梁间为血管和骨髓 ( HE ×20 )Fig.1 Bone tissues of the femoral head of the rats in 3 groups a: Hormone groups: The thinning bone trabecular and a large number of discontinuous bone fragments and bone marrow necrosis, bone cells most disappear in lacunae within bone fragments, surrounded by a large number of infammatory granulation tissue ( HE ×40 ); b: Atorvastatin group: Mild infammatory cells infltration, trabecular bone slightly thin, bone cells can be seen in the pit of majority trabecular bone, the blood vessels and bone marrow can be seen between trabecular ( HE ×20 ); c: Control group: the trabecular bone is composed of lamellar bone, bone cells can be seen in the pit of vast majority of trabecular bone, the blood vessels and bone marrow can be seen between trabecular ( HE ×20 )
二、MMP-2、MMP-9、TIMP-1、TIMP-2 mRNA 表达结果
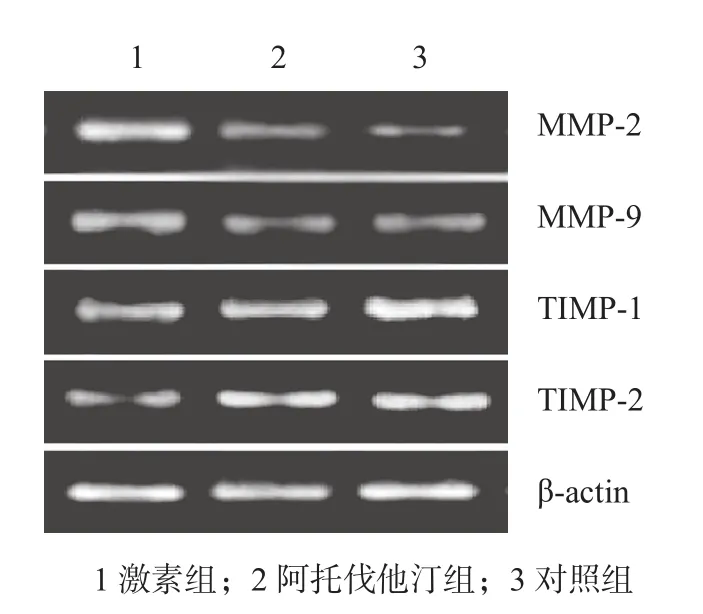
图2 MMP-2、MMP-9、TIMP-1、TIMP-2 mRNA 表达Fig.2 The mRNA expressions of MMP-2,MMP-9,TIMP-1 and TIMP-2
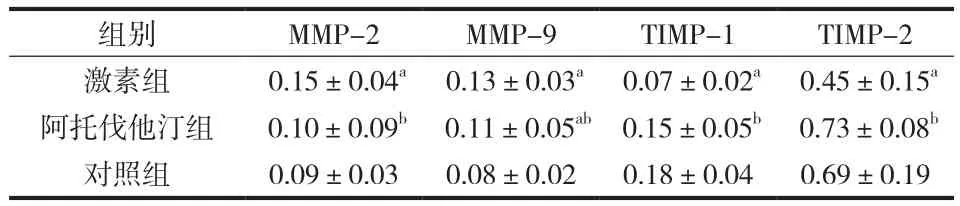
表2 各组大鼠-股骨头骨组织 MMP-2、MMP-9、TIMP-1、TIMP-2 mRNA 表达 ( x±s )Tab.2 The mRNA expressions of MMP-2, MMP-9, TIMP-1 -and TIMP-2 in bone tissues of the femoral head of the rats in 3 groups ( x±s )
3 组目的基因 RT-PCR 扩增产物行琼脂糖凝胶电泳,根据片段大小,在相应位置出现目的条带( 图 2 )。经 RT-PCR 检测出各组目的基因的表达水平( 表 2 ),结果显示:激素组与对照组比较,MMP-2、MMP-9 mRNA 表达水平增高,TIMP-1、TIMP-2 mRNA 的表达水平降低,差异有统计学意义 ( P<0.05 );阿托伐他汀组与对照组比较,除 MMP-9 差异有统计学意义外,其余差异无统计学意义;阿托伐他汀组与激素组比较,MMP-2、MMP-9 mRNA 表达降低,TIMP-1、TIMP-2 mRNA 表达增加,差异有统计学意义 ( P<0.05 )。
讨 论
1991 年,Maruno 等[14]首次报道降脂药物克利贝特对激素性兔股骨头坏死的干预作用。
Cui 等[15]研究表明与单独应用激素组鸡股骨头内软骨下骨细胞坏死及其脂肪组织增生相比,洛伐他汀与激素共用组内股骨头脂肪细胞增生程度轻微,并无明显骨坏死发生。Pritchett 等[16]对 284 例应用大剂量糖皮质激素同时服用他汀类降脂药的患者进行长期随访后发现,最终只有 3 例 ( 1% ) 发生骨坏死,远远低于同期文献报道单独应用激素的骨坏死率 ( 3%~20% ) 。Laufs 等[17]研究发现经他汀类药物的干预后,由于血管闭塞而导致的梗死灶明显减少,提示他汀类药物可能具有促进缺血组织侧支循环建立的作用。临床研究资料显示他汀类药物具有独特的抗炎作用[18-19],其抗炎作用机制包括减弱炎症细胞的趋化和聚集、抑制巨噬细胞可溶性细胞间黏附分子及金属蛋白酶的表达等,减少白细胞介素-1 和白细胞介素-6、单核细胞趋化蛋白-1、细胞间黏附分子-1、血管细胞黏附分子-1、细胞基质金属蛋白酶-9、肿瘤坏死因子 α 等炎症因子的表达。动物实验发现,辛伐他汀主要通过减轻激素所致的脂肪代谢紊乱来预防股骨头坏死[20-21]。激素加辛伐他汀组和单用辛伐他汀组血清胆固醇及三酰甘油水平均显著低于单用激素组,且这 2 组中髓内脂肪堆积明显减少,血管通畅。辛伐他汀还能通过其它作用机制预防激素性股骨头坏死。它可使血清骨钙素水平明显升高,而反映破骨细胞活性的血浆抗酒石酸酸性磷酸酶水平显著降低,提示辛伐他汀能阻止糖皮质激素引起骨吸收和促进骨形成,抑制激素所产生的骨代谢紊乱[20]。辛伐他汀还可对抗激素对NO 合成的抑制作用, 维持正常血清 NO 水平[21]。而 NO 能松弛血管平滑肌、使血管舒张、抑制血小板凝集、改善组织灌注,对股骨头血液供应起保护作用。核心结合因子 a1 ( core binding factor alphal 1,Cbfa1 ) 能调控骨分化相关基因的表达,促进骨组织形成。梁红锁等[22]通过建立激素性股骨头坏死的动物模型,应用普伐他汀进行干预,发现激素性坏死股骨头内 Cbfa1 mRNA 的表达增加。Weinstein 等[23]对激素所致的股骨头坏死手术切除股骨头,标本用TUNEL 技术进行细胞凋亡检测发现有大量的骨细胞凋亡,认为激素引起的股骨头坏死实际上是骨细胞凋亡。发现他汀类药物普拉固能有效干预激素性股骨头坏死中骨细胞凋亡[24]。
在前期研究中,我们已经通过动物实验证实,糖皮质激素醋酸泼尼松龙可以促进大鼠 MMP-2、MMP-9 mRNA 的表达,抑制 TIMP-1、TIMP-2 mRNA的表达,认为长期应用糖皮质激素导致的骨坏死可能与其对 MMPs / TIMPs 系统的影响有关[25-26]。本实验中,我们通过对长期应用糖皮质激素的大鼠,预防性地给予阿托伐他汀干预,观察到阿托伐他汀可以拮抗糖皮质激素的这种作用。提示阿托伐他汀可以通过对 MMPs / TIMPs 系统的“正性”干预作用,来拮抗糖皮质激素的“负性”作用,有效预防激素性股骨头坏死,为临床应用阿托伐他汀预防激素性骨坏死提供了实验依据。在下一步研究中,我们将通过临床试验,进一步证实阿托伐他汀能通过 MMPs / TIMPs 系统有效防止激素性骨坏死,为早期防治激素性骨坏死提供一条可能途径。
[1]Dixon JA, Gorman RC, Stroud RE, et al. Mesenchymal cell transplantation and myocardial remodeling after myocardial infarction. Circulation, 2009, 120(11):220-229.
[2]Ahmed N, Dreier R, Gopferich A, et al. Soluble signalling factors derived from differentiated cartilage tissue affect chondrogenic differentiation of rat adult marrow stromal cells. Cell Physiol Biochem, 2007, 20(5):665-678.
[3]Cavalheiro BG, Junqueira CR, Brandao LG. Expression of matrix metalloproteinase 2 (MMP-2) and tissue inhibitor of metalloproteinase 2 (TIMP-2) in medullary thyroid carcinoma: prognostic implications. Thyroid, 2008,18(8):865-871.
[4]Chernov AV, Sounni NE, Remacle AG, et al. Epigenetic control of the invasion-promoting MT1-MMP/MMP-2/TIMP-2 axis in cancer cells. J Biol Chem, 2009, 284(19):12727-12734.
[5]Eren B, Sar M, Oz B, et al. MMP-2, TIMP-2 and CD44 expression in non-small-cell lung carcinomas. Ann Acad Med Singapore, 2008, 37(1):32-39.
[6]Mroczko B, Groblewska M, Lukaszewicz-Zajac M, et al. Pretreatment serum and plasma levels of matrix metalloproteinase 9 (MMP-9) and tissue inhibitor of matrix metalloproteinases 1 (TIMP-1) in gastric cancer patients. Clin Chem Lab Med, 2009, 47(9):1133-1139.
[7]Hernandez M, Martinez B, Tejerina JM, et al. MMP-13 and TIMP-1 determinations in progressive chronic periodontitis. J Clin Periodontol, 2007, 34(9):729-735.
[8]Iwase T, Hasegawa Y, Ishiguro N, et al. Synovial fluid cartilage metabolism marker concentrations in osteonecrosisof the femoral head compared with osteoarthrosis of the hip. J Rheumatol, 1998, 25(3):527-531.
[9]Holliday LS, Welgus HG, Fliszar CJ, et al. Initiation of osteoclast bone resorption by interstitial collagenas. J Biol Chem, 1997, 272(35):22053-22058.
[10]Sato T, Hou P, Heegaard AM, et al. Identification of the membrane-type matrix metalloproteinase MT1-MMP in osteoclasts. J Cell Sci, 1997, 110(5):589-596.
[11]Mattot V, Raes MB, Henreit P, et al. Expression of interstitial collagenase is restricted to skeletal tissue during mouse embryogenesis. J Cell Sci, 1995, 108(2):529-534.
[12]Rubin C, Sun YQ, Hadjiargyrdl M, et al. Increased expression of matrix metalloproteinase-1 in osteocytes precedes bone resorption as stimulated by disuse:evidence for autoregulation of the cell’s mechanical environment. J Orthop Res, 1999, 17(3):354-359.
[13]Bord S, Hornerm A, Beeon CA, et al. Tissue inhibitor of matrix met alloproteinase-1 (TIMP-1) distribution in normal and pathological human bone. Bone, 1999, 24(3):229-235.
[14]Maruno H, Shimizu T, Kawai K, et al. The response of osteocytes to a lipid clearing agent insteroid-treated rabbits. Bone Joint Surg (Br), 1991, 73:911-915.
[15]Cui Q, Wang GJ, Balian G. Steroid-induced adipogenesis in bone marrow and osteonecrosis. Arco News, 1994, 6:117-119.
[16]Pritchett JW. Statin therapy decreases the risk of osteonecrosis in patients receiving steroids. Clin Orthop Relat Res, 2001, (386):173-178.
[17]Laufs U, Endres M, Stagliano N, et al. Neuroprotection mediated by changes in the endothelial actin cytoskeleton. J Clin Invest, 2000, 106(1):15-24.
[18]Tousoulis D, Antoniades C. Effects of atorvastatins on reative hyperemia and inflammatory process in patients with congestive hert failure. Atherosclerosis, 2005, 178(2):359-363.
[19]Fehr T, Kahlert C, Fierz W, et al. Statin-induced immunomododulatory effects on human T cells in vivo. Atherosclerosis, 2004, 175(1):83-90.
[20]敦先礼, 李锋, 方忠. 辛伐他汀对早期激素性股骨头坏死的预防作用. 华中科技大学学报(医学版), 2006, 35(3):346-349.
[21]王卫东, 廖文胜, 王义生. 辛伐他汀预防激素性股骨头坏死的实验研究. 郑州大学学报(医学版), 2004, 39(3):473-475.
[22]梁红锁, 赵宏斌, 马秋野, 等. 普伐他汀对激素性坏死股骨头内Cbfa1表达的影响. 昆明医学院学报, 2006, 27(2):1-4.
[23]Weinstein RS, Nicholas RW, Manolagas SC. Apoptosis of osteocytes in glucocorticoids-induced osteonecrosis of the hip. J Clin Endocrinol Metab, 2000, 85(8):2907-2912.
[24]李挺松, 肖增明. 普拉固对兔激素性股骨头坏死骨细胞凋亡的干预研究. 广西医科大学学报, 2006, 23(2):209-212.
[25]王建忠, 王坤正, 周荣兴, 等. 长期应用糖皮质激素对大鼠股骨头骨组织骨保护素/NF-κB受体活化因子配基-基质金属蛋白酶/基质金属蛋白酶组织抑制剂系统的影响. 中国修复重建外科杂志, 2011, 25(4):402-407.
[26]王建忠, 王坤正, 时志斌, 等. 长期应用糖皮质激素对大鼠股骨头骨组织MMPs/TIMPs系统的影响. 西安交通大学学报(医学版), 2011, 32(6):754-757.
( 本文编辑:李贵存 )
Effects of atorvastatin on the expression levels of tissue inhibitor of metalloproteinases timps / matrix metalloproteinases in bone tissues of femoral head necrosis induced by glucocorticoid
WANG Jian-zhong, WU Yong-gang, DONG Hui-zhen. Department of Orthopedics, the second Affiliated Hospital, Inner Mongolia Medical College, Hohhot, Inner Mongolia, 010030, PRC
ObjectiveTo investigate the effects of atorvastatin on the mRNA expressions of matrix metalloproteinase-2 ( MMP-2 ), matrix metalloproteinase-9 ( MMP-9 ), tissue inhibitor of matrix metalloproteinases-1 ( TIMP-1 ) and tissue inhibitor of matrix metalloproteinases-2 ( TIMP-2 ) in bone tissues of the rats receiving glucocorticoid for a long time, and to discuss the effects and mechanism of atorvastatin in preventing glucocorticoidinduced femoral head necrosis ( FHN ).MethodsA total of 30 healthy adult Sprague-Dawley ( SD ) rats were randomly divided into 3 groups, including glucocorticoid group, atorvastatin group and control group with 10 ratsin each group. The rats in the glucocorticoid group and atorvastatin group were treated by intramuscular injection of 12.5 mg / kg prednisolone twice a week. The rats in the atorvastatin group were treated by intragastric administration with 1 mg / kg atorvastatin once a week. The maximum dose was 60 mg each day for experimental animals whose maximum weight was 60 kg. The rats in the control group were treated only by intramuscular injection of the same volume sodium chloride. After 4 weeks’ intervention, the paraffn-embedded osteonecrosis of the left femoral head was detected by HE stain, to identify osteoporosis and FHN. The total Ribonucleic Acid ( RNA ) of the right femoral head was extracted and the mRNA expression levels of MMP-2, MMP-9, TIMP-1 and TIMP-2 mRNAs were examined by reverse transcriptase polymerase chain reaction ( RT-PCR ).ResultsThere was 1 death case in the glucocorticoid group and atorvastatin group respectively. The HE staining of bone tissue slices of the femoral head in the control group showed the bone trabecula was composed of lamellar bone and there were osteocytes in most of the lacunas of the trabecular bone and blood vessels and marrows between bone trabeculae. In the glucocorticoid group, the bony trabecula was sparse and there were a great number of discontinuous bone fragments and marrow necroses. Most of the osteocytes in the lacunas of bone fragments disappeared, with a lot of infammatory granulation tissues around. In the atorvastatin group, there was mild infammatory cell infltration and thin bone trabecula. Osteocytes could be seen in most of the lacunas of the trabecular bone, and blood vessels and marrows between bone trabeculae. The expressions of MMP-2 in the glucocorticoid group, atorvastatin group and control group were 0.15±0.04, 0.10±0.09 and 0.09±0.03. The expressions of MMP-9 in 3 groups were 0.13±0.03, 0.11±0.05 and 0.08±0.02. The expressions of TIMP-1 in 3 groups were 0.07±0.02, 0.15±0.05 and 0.18±0.04. The expressions of TIMP-2 in 3 groups were 0.45±0.15, 0.73±0.08 and 0.69±0.19. The mRNA expressions of MMP-2 and MMP-9 in the glucocorticoid group were higher than that in the control group, and while the mRNA expressions of TIMP-1 and TIMP-2 were lower. The differences between them were statistically signifcant ( P<0.05 ). As to the comparison between the atorvastatin group and the control group, statistically signifcant differences existed only in the expressions of MMP-9. The mRNA expressions of MMP-2 and MMP-9 in the atorvastatin group were lower than that in the control group, and while the mRNA expressions of TIMP-1 and TIMP-2 were higher. The differences between them were statistically signifcant ( P<0.05 ).ConclusionsThe mRNA expressions of MMP-2 and MMP-9 can be up-regulated and the expressions of TIMP-1 and TIMP-2 can be down-regulated by prednisolone, so as to improve the ratio between MMPs and TIMPs. The glucocorticoid control of MMPs / TIMPs can be antagonized by atorvastatin.
Glucocorticoids; Osteonecrosis; Receptors, cytokine; Drug evaluation
10.3969/j.issn.2095-252X.2014.11.015
R684.3
国家自然科学基金资助项目 ( No. 81160228 );国家自然科学基金资助项目 ( No. 81260284 )作者单位:010030 呼和浩特,内蒙古医科大学第二附属医院创伤骨科 ( 王建忠、董慧珍 );015000 内蒙古巴彦淖尔市医院骨外科 ( 武永刚 )
武永刚,Email: wuyonggang888@126.com
2014-03-14 )

