正交试验优选地榆总鞣质提取工艺❋
严 玮,许建勇,姜晓燕,缪 婧
(1.南通市中医院,南通 226001;2.苏州大学,苏州 215000)
地榆(Sanguisorba officinalis L.)为多年生蔷薇科(Rosaceae)地榆属(Sanguisorba L.)植物的草本植物,以根入药。地榆中的鞣质具有抑菌、抗肿瘤、抗氧化、降血糖、降血脂、免疫、抗腹泻、抗病毒和降低尿毒症毒素等多种药理活性[1-3],因此考察如何快速有效地提取地榆中鞣质具有现实意义。
1 试药与仪器
1.1 工艺研究用药材
地榆(批号120501)购于南通三越中药饮片有限公司。
1.2 仪器设备
T6 型新世纪紫外-可见分光光度计,北京普析通用仪器有限责任公司生产;1001 型旋转蒸发仪,上海爱朗仪器有限公司生产;AL104 型电子分析天平,梅特勒-托利多上海有限公司生产;没食子酸对照品(批号110831-201204),购自中国药品生物制品检定所,其他试药均为分析纯。
2 方法与结果
2.1 总鞣质的含量测定[4-5]
2.1.1 对照品溶液制备 精密称取没食子酸对照品50 mg,置于100 mL棕色容量瓶中,加水溶解稀释至刻度,精密量取5 mL,置50 mL 棕色容量瓶中,加水稀释至刻度摇匀即得。
2.1.2 供试品溶液的制备 称取地榆10 g粉碎,过 60目筛置于容器中,采用不同方法、按不同溶剂浓度、料液比、时间、温度进行提取、抽滤,合并滤液置于 250 mL 棕色容量瓶中,加水 150 mL放置过夜,超声处理 10 min,放冷至室温,加水至刻度、摇匀,静置过夜,弃去初滤液 50 mL,精密量取续滤液 10 mL,置于 100 mL 棕色容量瓶中,用水稀释至刻度摇匀即得。加水定容至 200 mL 量瓶中即得。
2.1.3 标准曲线的制备 精密吸取没食子酸对照品溶液 0.5、1.0、2.0、3.0、4.0和5.0 mL,分别置于25 mL棕色量瓶中,分别加磷钼钨酸试液1 mL,依次精密加入12 mL 20%碳酸钠溶液,加水稀释至刻度摇匀,以水为空白,760 nm 处测定吸光度(Y),以Y为纵坐标,质量浓度X为横坐标,得回归方程Y=47.65X-0.085(r=0. 9994),提示没食子酸在1~10 μg/mL与Y呈良好线性关系。
2.1.4 样品测定 按《中国药典》2010 版附录XB 鞣质含量测定方法测定。①总酚含量:精密量取供试品溶液0.2 mL,置25 mL 棕色量瓶中,按 2. 1. 3 项下方法测定Y,计算总酚质量浓度;②不被吸附的多酚含量:精密量取供试品溶液25 mL,加至已有干酪素0. 6 g 的100 mL具塞锥形瓶中,密塞置30 ℃水浴中保温1 h,振摇取出放冷、摇匀,过滤弃初滤液,取续滤液0.2 mL置于25 mL 棕色量瓶,按2.1.3项下方法测定Y,计算不被吸附的多酚质量浓度。根据公式计算:鞣质含量=总酚量-不被吸附多酚含量。
2.1.5 精密度试验 精密吸取供试品溶液0. 2 mL,置 25 mL 棕色量瓶中,按2.1.3项下方法测定X,重复5次,RSD为0.10%,提示仪器精密度良好,操作平行稳定。
2.1.6 加样回收率试验 精密吸取3份供试品溶液0.2 mL,分别准确加入高、中、低3个剂量组的对照品,按 2.1.3项下方法测定X,计算加样回收率96.62%,RSD为0.97%。
2.2 提取
2.2.1 正交试验[6-7]表2、3显示,地榆的鞣质在乙醇的水溶液中具有较好的溶解性,试验乙醇浓度、加溶剂倍数、回流时间和提取次数设计为4因素3水平,称取地榆10 g,粉碎过60目筛,紧密称定,按表1进行提取,以总鞣质含量为指标进行考察。

表1 因素水平表

表2 正交试验结果(L9(34))
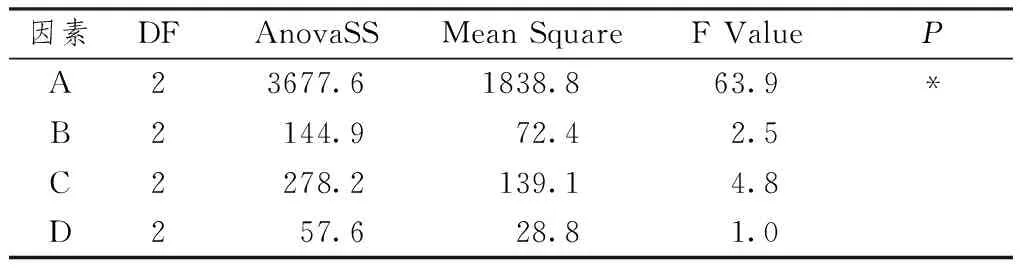
表3 方差分析表(SAS)
注:F临界值F0.01(1,2)=99,F0.05(1,2)=19,*显著
表2、3显示,乙醇浓度为影响总鞣质的主要因素,而回流时间、溶剂倍数和提取次数为次要因素,搭配A3C1B2D3。影响总鞣质含量的主要因素排列为:乙醇浓度>回流时间>溶剂倍数>提取次数,即药材加80%乙醇、溶剂10倍、回流2次,每次回流1 h。
2.2.2 验证试验 表4显示,称取10 g地榆4份,分别加80%乙醇回流1 h,溶剂10倍,回流2次,减压回收溶剂。

表4 验证试验结果
表5显示,2批样品中总鞣质含量相近,略高于正交表中的最高含量,提示按正交试验筛选的最优提取工艺基本稳定、可行。
3 讨论
本课题以地榆所含总鞣质为指标进行正交试验筛选,参考2010 年版《中国药典》1部附录干酪素法,以没食子酸做对照品制定标准曲线并测定鞣质含量[2]。本课题中测得地榆所含鞣质7.2%,与文献结果相似[8-9]。
预试验结果显示,温度对提取鞣质的工艺影响并不大,因此未纳入温度的研究,与文献结论相似[10]。相对乙醇,甲醇的溶解性较好[11],纯甲醇的提取效率最高,可能与甲醇穿透细胞能力较强有关。但考虑甲醇的安全性和大生产的可行性,鞣质的极性较大,也可以溶解在水中,因此本课题针对不同浓度的乙醇水溶液作为受试溶剂进行考察。
经过正交设计得到地榆总鞣质提取的最佳工艺,药材加80%乙醇回流1 h,溶剂10倍,回流2次。按最佳工艺进行重复试验验证,结果显示总鞣质的提取稳定,溶剂采用乙醇溶液,此工艺适合于大生产提取地榆总鞣质。
[1] Ravipati AS,Zhang L,Koyyalamudi SR,et al. Antioxidant and anti-inflammatory activities of selected Chinese medicinal plants and their relation with antioxidant content[J]. BMC Complement Altern Med,2012,12:173.
[2] Wang Z,Loo WT,Wang N,et al. Effect of Sanguisorba officinalis L on breast cancer growth and angiogenesis[J]. Expert Opin Ther Targets,2012,16(Suppl):S79-89.
[3] Choi ES,Kim JS,Kwon KH,et al. Methanol extract of Sanguisorba officinalis L. with cytotoxic activity against PC3 human prostate cancer cells[J]. Mol Med Rep,2012,6(3):670-674.
[4] 国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2010:99.
[5] 王添敏,孙晓丽,彭雪,等.胡桃楸的根、茎枝、叶和果皮中总鞣质的含量测定[J]. 中国中药杂志,2011,17(1): 32-36.
[6] Zhang YJ,Peng CW,Xu SQ,et al. Optimization of extraction on flavonoids from leaves of Heritiera littoralis[J]. Zhong Yao Cai,2012,35(4):638-641.
[7] Cai H,Bao Z,Jiang Y,et al. Study on processing method of Cistanche tubulosa[J]. Zhongguo Zhong Yao Za Zhi,2007,32(13):1289-1291.
[8] 刘英,苏柘僮,陈龙,等. 应用Box-Behnken设计优化地榆鞣质的闪式提取工艺[J]. 华西药学杂志,2012,27(3):304-306.
[9] 唐志国. 优选地榆鞣质的超声波提取工艺[J]. 中国民康医学,2011,24(6):764-765.
[10] Aelenei N,Popa MI,Novac O,et al. Tannic acid incorporation in chitosan-based microparticles and in vitro controlled release[J]. J Mater Sci Mater Med,2009,20(5):1095-1102.
[11] Sinchaiyakit P,Ezure Y,Sriprang S,et al. Tannins of tamarind seed husk: preparation, structural characterization, and antioxidant activities[J]. Nat Prod Commun,2011,6(6):829-834.

