超临界CO2流体萃取墨红玫瑰花中鞣质的工艺优化
李金凤,张旋,陶冬冰
(沈阳农业大学食品学院,辽宁沈阳110866)
墨红,又名朱墨双辉,学名Rose chinensis Jacq“Crimsin Glory”H.T.[1],是国内食用玫瑰花种植的主要品种[2]。鞣质是玫瑰花中重要的生理活性物质之一,是以玫瑰为原料加工的食品涩味产生的主要来源[3],是玫瑰花抗衰老和调节女性内分泌系统的重要抗氧化功能物质之一[4]。目前国内外对鞣质的抗氧化性研究已经十分深入[5],提取方法多为溶剂提取法、超声波提取法等,提取率相对较低[6],造成玫瑰鞣质的利用不高,通常在加工过程中脱涩除去[7],本文旨在研究以墨红玫瑰花为原料,利用超临界CO2萃取技术提高提取鞣质的效率,优化墨红玫瑰花中鞣质的提取工艺。对玫瑰功能性食品开发起到一定的借鉴意义,为进一步开发高效、高价值的天然食品抗氧化剂、食品添加剂、研制功能性食品及开发医药材料提供理论指导[8]。
1 材料与方法
1.1 材料与设备
1.1.1 试验材料
本试验所采用的原料为新鲜的玫瑰花,品种为法国墨红玫瑰,采于云南七彩云花生物科技有限公司食用玫瑰花基地。
石油醚(30℃~60℃)、氯仿、丙酮、无水乙醇、甲醇(均为 AR 试剂):国药集团;鞣花酸(C76H52O46,M=1 701.25):Sigma 公司。
1.1.2 主要仪器
紫外可见分光光度计(Cary50):美国Vrian;不锈钢筛(20、40、60、80、100 目):日本 AS ONE;超临界萃取设备(HA121-50-02 型):南通市华安超临界萃取有限公司;真空冷冻干燥设备(Freezone2.5):美国Labconco。
1.2 试验方法
1.2.1 鞣质的提取方法
1.2.1.1 工艺流程
墨红玫瑰花→原料预处理(去除花托、留完整花瓣)→烘干→粉碎→预处理(过筛、脱脂)→超临界CO2萃取→真空抽滤→收集滤液→测定
1.2.1.2 预处理方法
称取一定量的粉碎过筛后的墨红玫瑰花粉末,用石油醚在60 ℃回流8 h 进行脱脂,再用氯仿冷浸24 h处理,以除去色素、脂肪等杂质[9]。
1.2.1.3 超临界CO2萃取方法
准确称取脱脂后的样品,装入萃取釜,密闭,在夹带剂罐中装入适量夹带剂,控制超临界CO2萃取仪器的萃取温度、萃取压力、分离温度、分离压力等条件,在超临界状态下进行萃取,在一定时间后降压,从分离柱得到提取液,然后减压浓缩除去有机溶剂,Folin-Denis法测定鞣质含量,然后真空冷冻干燥得到粗提物[10]。
1.2.2 鞣质的定量方法[11]
鞣质的定量方法采用Folin-Denis 比色法。鞣质类化合物在碱性溶液中,可将磷钨酸钠还原并生成蓝色化合物,颜色的深浅与鞣质含量正相关,在760 nm 波长比色,以鞣花酸标准品做标准曲线,再根据测得的吸光值在标准曲线上查得对应的鞣质含量。
1.2.2.1 Folin-Denis 显色剂的配制[12]
50 g 钨酸纳,10 g 磷钼酸溶于含375 mL 水的烧瓶中,在加入25 mL 85%的磷酸,水浴回流2 h,冷却后定容至500 mL 棕色容量瓶中保存。
Na2CO3饱和溶液:35 g 无水 Na2CO3于 70 ℃溶解在100 mL 水中,放置过夜。
1.2.2.2 标准曲线的制作
准确配制0.102 mg/mL 的鞣花酸标准溶液,分别吸取 0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL 标准液加入装有25 mL 水的50 mL 容量瓶中,再各加2.5 mLFolin-Denis 显色剂,10 mL Na2CO3饱和溶液,摇匀定容,室温下放置30 min 后比色,以平均吸光值与标准溶液的浓度作线性回归分析[13],得到回归方程:y=51.929x+0.011 5(R2=0.997 3)。标准曲线图见图1。
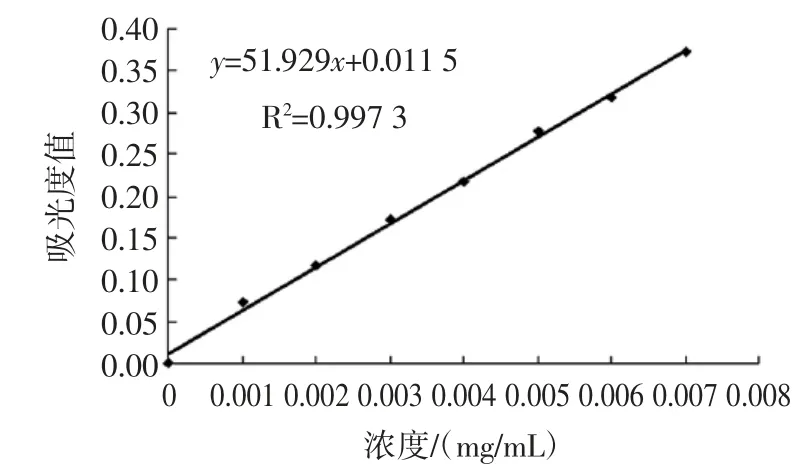
图1 Folin-Denis 法测定鞣质含量的标准曲线Fig.1 The calibration curve of tannin content
1.2.3 单因素试验
称取玫瑰干粉300 g,分别进行夹带剂的选择(70%乙醇、水、50 %甲醇、60 %丙酮为夹带剂,萃取温度60 ℃、萃取压力20 MPa、萃取时间1 h、夹带剂流量20 mL/min、分离温度 40 ℃、分离压力 8 MPa)[13];粉碎粒度(原料粒度为 20、40、60、80、100 目,70%乙醇夹带剂、萃取温度60℃、萃取时间1h、夹带剂流量20 mL/min、分离温度 40 ℃、分离压力 8 MPa)[14];萃取时间(萃取时间为 20、40、60、90、120、150、180 min,70 %乙醇夹带剂、萃取温度60 ℃、萃取压力20 MPa、夹带剂流量20 mL/min、分离温度 40 ℃、分离压力 8 MPa)[15];萃取温度(20、30、40、50、60、70 ℃,70 %乙醇夹带剂、萃取压力20 MPa、萃取时间1 h、夹带剂流量20 mL/min、分离温度 40 ℃、分离压力 8 MPa)[16];萃取压力(15、20、25、30 MPa,70%乙醇夹带剂、萃取温度 60 ℃、萃取时间1 h、夹带剂流量20 mL/min、分离温度40 ℃、分离压力 8 MPa)[17];夹带剂的流速(15、20、30 mL/min,70%乙醇夹带剂,萃取温度60 ℃、萃取压力20 MP、萃取时间1 h、分离温度 40 ℃、分离压力 8 MPa)[18];夹带剂用量(100、200、400、600、900、1 200 mL 乙醇,萃取温度 60 ℃、萃取压力20 MPa、分离温度40 ℃、分离压力8 MPa时,夹带剂流量 15 mL/min)[19];分离温度(30、35、40、45、50、55、60 ℃,70%乙醇夹带剂、萃取温度 60 ℃、萃取时间1 h、夹带剂流量20 mL/min、分离压力8 MPa)[20]的超临界CO2萃取单因素试验,从分离柱得到提取液,然后减压浓缩除去有机溶剂,Folin-Denis 法测定玫瑰鞣质含量。
1.2.4 正交试验
根据单因素试验结果确定影响鞣质浸提率的因素主要有萃取压力(A)、萃取温度(B),萃取时间(C)、夹带剂乙醇浓度(D),设计四因素三水平的正交试验,每个试验样品重300 g。

表1 超临界CO2 萃取法L9(34)正交试验表Table 1 The project of the L9(34)supercritical CO2 extraction experiment
2 结果与分析
2.1 夹带剂的选择
由于鞣质是强极性的物质,而超临界CO2萃取对弱极性和非极性的物质有较好的萃取效果,所以添加夹带剂,改变超临界流体的极性,可以提高鞣质的提取率。夹带剂选择试验结果见表2。
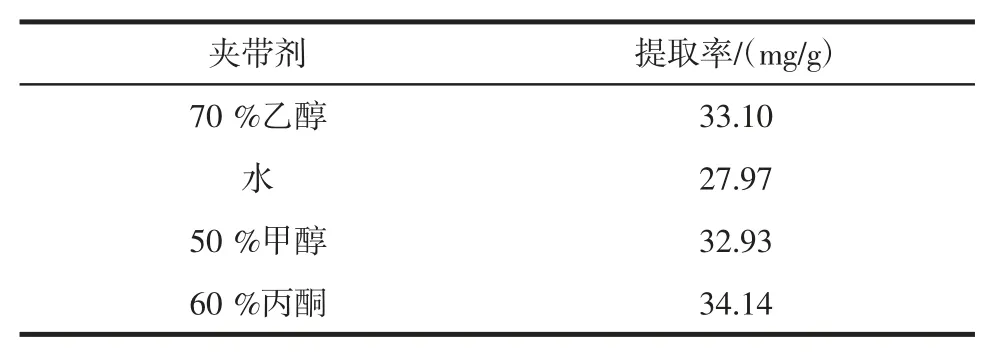
表2 夹带剂的选择Table 2 The selection of entrainers
由表2 可知,用70%乙醇和50%甲醇做夹带剂玫瑰花鞣质的提取率分别为33.10 mg/g 和32.93 mg/g,基本相同,用60%丙酮做夹带剂,鞣质提取率为34.14 mg/g,略高,水做夹带剂鞣质的提取率为27.97 mg/g,最低。但丙酮和甲醇都是有毒的有机溶剂,所以选择乙醇做夹带剂。
2.2 粉碎粒度对玫瑰花中鞣质提取率的影响
原料粒度对玫瑰花鞣质提取率的影响见图2。
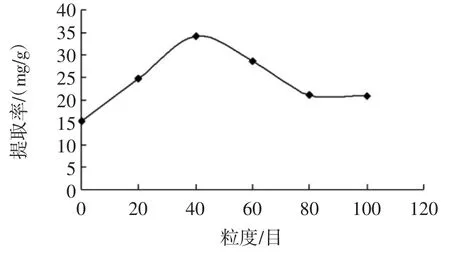
图2 原料粒度对玫瑰花鞣质提取率的影响Fig.2 Extraction effect of tannin from rose by granularity
由图2 可知,当原料粒度过细时,反而不利于玫瑰花中鞣质的提取,主要是因为原料过细不利于超临界CO2流体从原料中通过,还可能造成原料堵塞萃取釜的过滤板,使流体进入分离柱的量大大减少,使玫瑰花鞣质的提取率降低。在试验中还发现,原料目数太高,对仪器的损害很大,减压时会造成过滤板因内外压强不同而破裂,原料漏出,清理仪器时很困难,所以本试验最后选定40 目的原料进行萃取试验。
2.3 萃取时间对玫瑰花鞣质提取率的影响
萃取时间对玫瑰花鞣质提取率的影响见图3。

图3 萃取时间对玫瑰花鞣质提取率的影响Fig.3 Extraction effect of tannin from rose by time
由图3 可以看出,当萃取时间低于60 min 时,随着萃取时间的延长,玫瑰花鞣质的提取率逐渐增高,但超过60 min 后,提高静萃取时间对玫瑰花鞣质的最终提取率影响并不显著。这表明在60 min 时间段内萃取剂CO2和夹带剂乙醇已能较好地渗入玫瑰粉末,因此在以后的萃取过程中,萃取时间定为60 min。
2.4 萃取温度对玫瑰花鞣质提取率的影响
萃取温度对玫瑰花鞣质提取率的影响见图4。
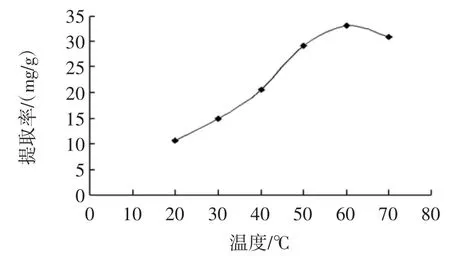
图4 萃取温度对玫瑰花鞣质提取率的影响Fig.4 Extraction effect of tannin from rose by temperature
由图4 可知,在温度小于60 ℃时,玫瑰花鞣质提取率随温度升高而增大,即玫瑰花鞣质在超临界CO2流体中的溶解度随着温度的上升而增大,而温度大于60 ℃以后,鞣质的提取率随温度升高反而有减小的趋势。
2.5 萃取压力对玫瑰花鞣质提取率的影响
萃取压力对玫瑰花鞣质提取率的影响见图5。
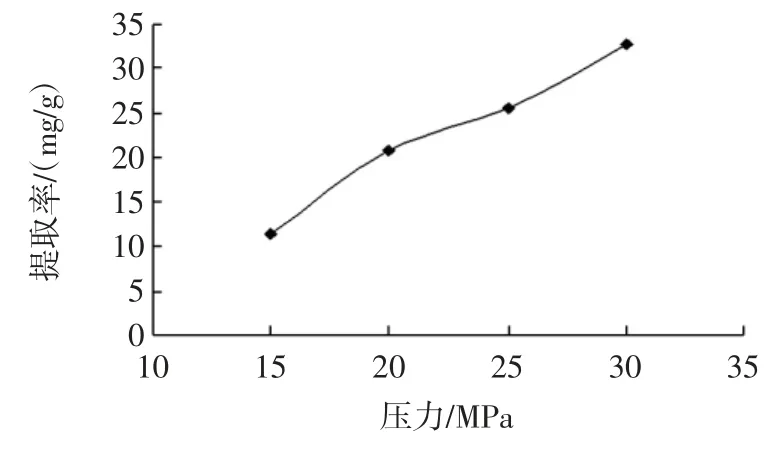
图5 萃取压力对玫瑰花鞣质提取率的影响Fig.5 Extraction effect of tannin from rose by pressure
由图5 可知,随着萃取压力增大,玫瑰花鞣质的提取率不断升高。压力的影响主要体现在改变超临界CO2的密度和极性。在相同的温度和夹带剂用量下,加压可以增加CO2的密度,减少分子间的传质阻力,增加溶质与溶剂之间的传质效率,从而有利于目标组分的萃取。但另一方面,压力的增加会增加设备费用,因此萃取压力不宜过高,且由于使用的超临界CO2萃取仪器具有过压保护,压力不能超过35 MPa。
2.6 夹带剂流量对玫瑰花鞣质提取率的影响
夹带剂流量对玫瑰花鞣质提取率的影响见图6。
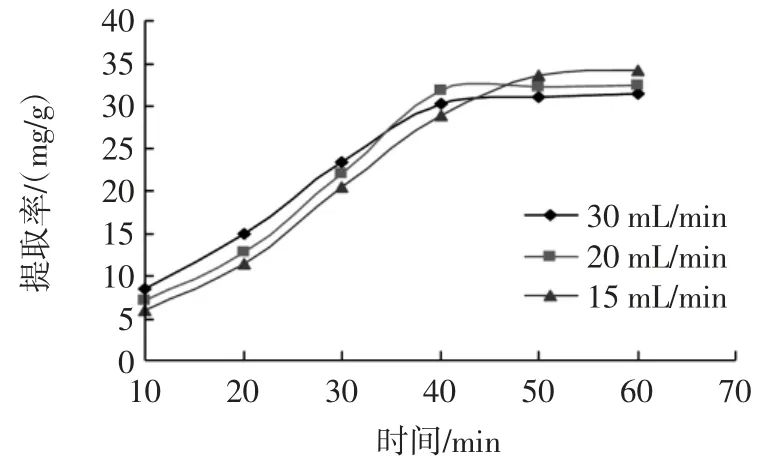
图6 夹带剂流量对玫瑰花鞣质提取率的影响Fig.6 Extraction effect of tannin from rose by entrainer fluence
由图6 可知,通过夹带剂泵加入的乙醇流速增大时,玫瑰花鞣质的萃出速率有所提高;但当乙醇流速低时,由于与玫瑰粉末接触时间相对延长,则有利于玫瑰鞣质总量的提高。
2.7 夹带剂用量对玫瑰花鞣质提取率的影响
夹带剂用量对玫瑰花鞣质提取率的影响见图7。
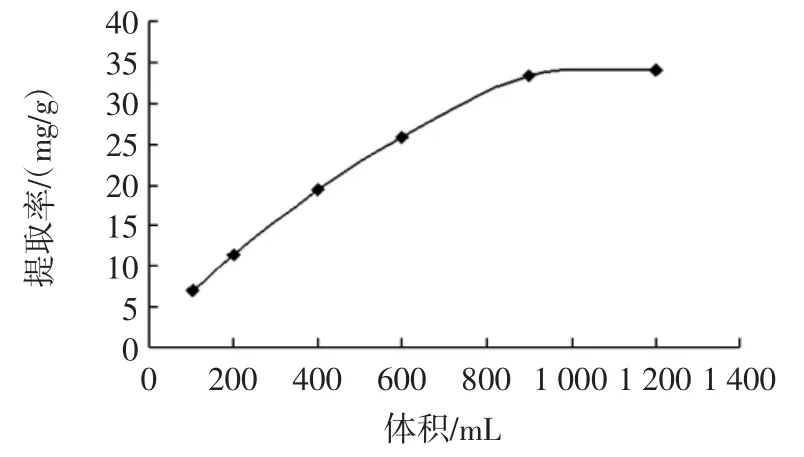
图7 夹带剂用量对玫瑰花鞣质提取率的影响Fig.7 Extraction effect of tannin from rose by entrainer dosage
由图7 可知,随着夹带剂乙醇用量的增加,玫瑰花鞣质的提取率急剧上升。但在900 mL 以后玫瑰鞣质提取率的上升趋势减缓。对于鞣质这类强极性物质,夹带剂用量的多少对改善玫瑰花鞣质在超临界CO2中的溶解性能具有决定性的影响。另一方面,当夹带剂量过高时,将会延长萃取时间及增加操作成本,因此乙醇相对玫瑰粉用量在3 mL/g 为适宜。
2.8 分离温度对玫瑰花鞣质提取率的影响
分离温度对玫瑰花鞣质提取率的影响见图8。

图8 分离温度对玫瑰花鞣质提取率的影响Fig.8 Extraction effect of tannin from rose by separation temperature
由图8 可知,超临界CO2流体在分离柱中降压降温后成为常压气体,这时鞣质从流体中析出,当分离温度小于40 ℃时,随着分离温度的升高,鞣质的析出逐渐增多,超过40 ℃后,上升趋势不明显,且超过50 ℃后,鞣质的析出还略有下降趋势,可能是因为分离温度过高,超临界流体有部分未能成为常压气体而造成鞣质的析出减少。由此可知,分离温度对鞣质的提取率影响不大,考虑温度升高需耗费能源较多,所以分离温度选用40 ℃。
2.9 超临界CO2 萃取玫瑰花鞣质正交试验结果分析
超临界CO2萃取法L(934)正交试验设计及结果见表3。
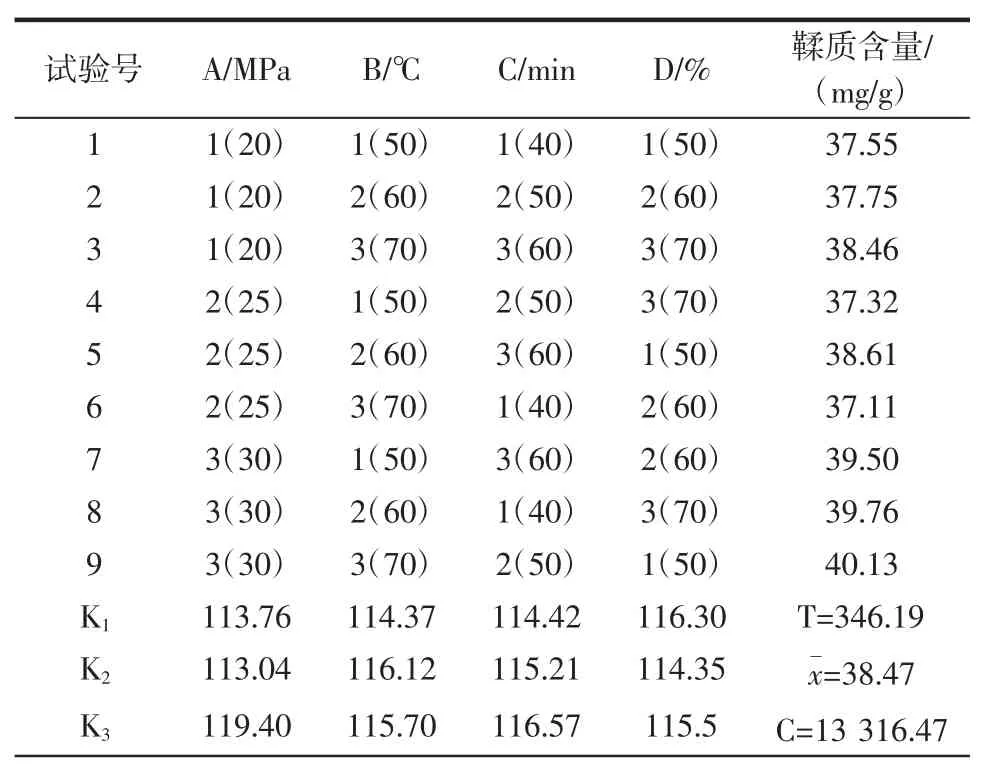
表3 超临界CO2 萃取法L9(34)正交试验设计及结果Table 3 The results of the L9(34)supercritical CO2 extraction experiment

续表3 超临界CO2 萃取法L9(34)正交试验设计及结果Continue table 3 The results of the L9(34)supercritical CO2 extraction experiment
由表3 正交试验结果直观分析可知,萃取压力对玫瑰花鞣质的提取率影响最大,而萃取温度、萃取时间、夹带剂乙醇浓度对玫瑰花鞣质的提取率影响稍小,为了确定各因素对提取效果的影响及其显著性,进行方差分析,见表4。
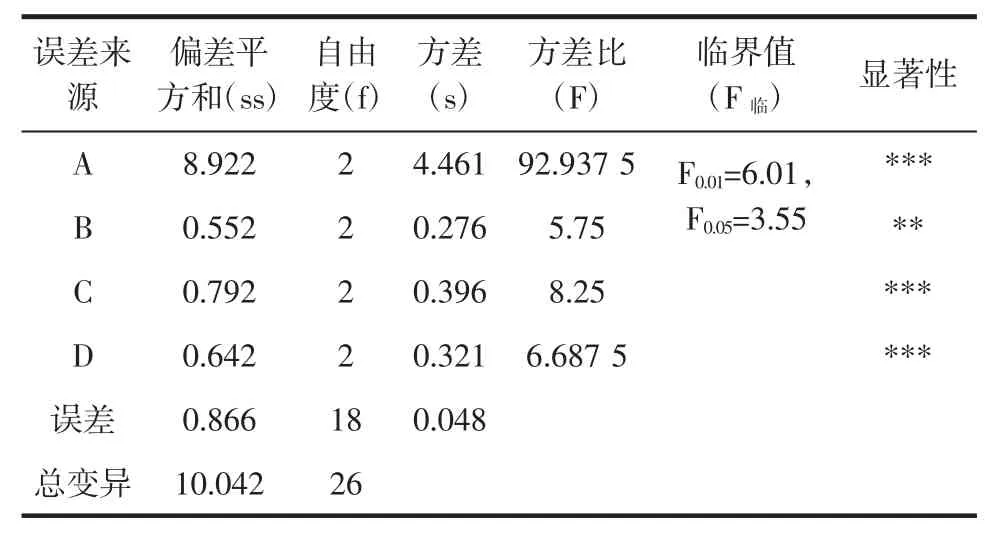
表4 方差分析表Table 4 Variance analysis table
由表4 方差分析结果分析,各因素对提取率的影响大小依次为:萃取压力>萃取时间>夹带剂浓度>萃取温度,最优提取条件为:萃取压力30 MPa、萃取温度60 ℃、萃取时间60 min、夹带剂乙醇浓度50%。验证试验结果见表5。
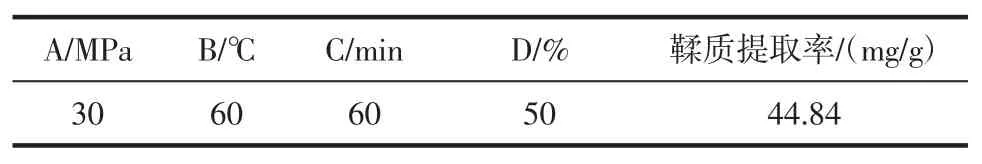
表5 验证试验Table 5 The textual research
由表5 验证试验结果最终确定超临界CO2萃取法提取玫瑰花鞣质的最优提取条件为:玫瑰花粉粒度40 目、萃取压力 30 MPa、萃取温度 60 ℃、萃取时间60 min、分离温度40 ℃、分离压力8 MPa、夹带剂乙醇浓度50%、流速15 mL/min、乙醇用量3 mL/g,超临界CO2萃取法提取玫瑰花鞣质的提取率为44.84 mg/g。
3 讨论
超临界CO2萃取玫瑰花中鞣质的试验分别用丙酮、乙醇、甲醇、水做夹带剂,增强超临界流体的极性[19],以提高鞣质的提取率,用丙酮、乙醇和甲醇做夹带剂,鞣质的提取率基本相同,只有水偏低。本文研究所提取的玫瑰花中的活性成分主要用于食品与保健品工业,必须达到绿色食品要求,因此考虑到溶剂的安全性、有效性、生产成本及操作上的后续工作等因素,本试验选用乙醇作为超临界CO2萃取的夹带剂,既保证了玫瑰花鞣质的顺利溶出,也便于后续工作特别是产品的应用生产。试验采用玫瑰花粉末作为提取原料,当原料粒度过细时,不利于超临界CO2流体从原料中通过,还可能造成原料堵塞萃取釜的过滤板,使流体进入分离柱的量大大减少,使玫瑰花鞣质的提取率降低[20]。在试验中还发现,原料目数太高,对仪器的损害很大,减压时会造成过滤板因内外压强不同而破裂,原料漏出,清理仪器时很困难,所以,找到最适合的原料粉粹粒度对超临界CO2萃取的提取率也有着较大影响。
4 结论
超临界CO2萃取法提取玫瑰花中鞣质的最优提取工艺为:玫瑰花粉粒度40 目、萃取压力30 MPa、萃取温度60 ℃、萃取时间60 min、分离温度40 ℃、分离压力8 MPa、夹带剂乙醇浓度50%、流速15 mL/min、乙醇用量3 mL/g,超临界CO2萃取法提取玫瑰花鞣质的提取率为44.84 mg/g。

