活血降糖饮对长期高脂饲料喂养大鼠肝脏和 脂肪组织GLP-1R及GLUT-4蛋白表达的影响❋
刘德亮,李惠林,渠 昕,赵恒侠,肖小惠
(广州中医药大学深圳临床医学院(深圳市中医院),广东 深圳 518033)
饮食结构的改变导致肥胖、高脂血症、胰岛素抵抗等代谢性疾病的发生率逐年增长,与2型糖尿病的发生关系密切。传统的降糖调脂药物具有明确疗效,但是长期使用其副作用难以避免,因此中药的降糖调脂机制成为研究热点。活血降糖饮由黄芪、生地、丹参等药物组成,具有益气养阴、活血通络的作用,其良好的调脂降糖作用在前期研究中已被证实,现为进一步探讨其降糖调脂的作用机制,本实验通过建立大鼠胰岛素抵抗、高脂血症模型,探讨活血降糖饮对胰岛素抵抗、高脂血症大鼠糖、脂代谢的影响,以及其可能的药理机制。
1 材料与方法
1.1 动物及饲养
SPF级健康雄性SD大鼠50只,约2月龄,体质量150~180 g,由广州中医药大学实验动物中心提供。动物饲养环境温度18~22 ℃,自然昼夜节律光照,自由饮水、摄食,饲养湿度40%~70%;高脂饲料及常规饲料均购自广东省医学实验动物中心,高脂饲料热量组成为碳水化合物20%,蛋白质20%,脂肪60%;常规饲料为碳水化合物64%,蛋白质23%,脂肪13%。
1.2 药物及试剂
活血降糖饮组成:黄芪30 g,生地20 g,丹参30 g,太子参30 g,五味子15 g,麦冬15 g,山药12 g,黄精15 g,丹皮12 g,大黄16 g,红花12 g,桃仁10 g。用10倍体积蒸馏水浸泡生药1 h,大火煎开,小火继续煎煮30 min,共煎2次,过滤浓缩水煎液,浓缩液浓度为4 g/ml,4℃冰箱保存备用。非诺贝特胶囊为法国利博福尼制药公司产品,用双蒸水溶解至浓度为2 g/L,保存在4℃冰箱备用。
1.3 试剂与仪器
甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、游离脂肪酸(NEFA)、血糖试剂盒购自南京建成生物工程研究所。胰岛素放免试剂盒购自北京原子能科学研究所,兔抗大鼠胰高糖素样肽-1受体(GLP-1R)多克隆抗体、β-actin多克隆抗体购自Santa Cruz公司,兔抗大鼠葡萄糖转运体-4(GLUT-4)多克隆抗体为CST公司产品,辣根过氧化物酶标记山羊抗兔IgG抗体购自中杉金桥生物技术有限公司。检测仪器采用北京六一仪器厂DYCZ-24型垂直板电泳槽,中国山东彩虹分析仪器厂GF-D800型半自动生化分析仪,Quantity One定量分析软件及HMIAS-2000图像分析系统。
1.4 试验方法
1.4.1 动物模型的建立和分组 50只大鼠适应性喂养2周(标准饮食),随机选出10只大鼠自由进食进水,标准饲料喂养,作为正常组。剩下的40只大鼠给予高脂、高热量饮食,28周后,筛选血清TC、TG、NEFA、胰岛素抵抗指数(HOMA-IR)异常者30只作为成模大鼠(根据空腹血糖、空腹血清胰岛素计算HOMA-IR,根据正常大鼠血清TC、TG、NEFA、HOMA-IR计算出95%可信区间范围,血清TC、TG、NEFA、HOMA-IR值高于正常范围上限20%被认为是胰岛素抵抗、血脂异常大鼠),按随机数字表法分成模型组、中药组、贝特组、正常组共4组各10只。
1.4.2 动物处理 中药组每日以5 g/kg/d的剂量灌服活血降糖饮煎剂,贝特组每天以非诺贝特混悬液20 mg/kg/d治疗,正常组和模型组以等体积生理盐水灌胃;治疗期间,模型组、中药组、贝特组均继续喂以高脂高热量饲料,正常组喂以常规饲料。
1.4.3 标本制备 各组大鼠均治疗8周后,禁食24 h后,行口服葡萄糖耐量试验(OGTT)及胰岛素释放试验(IRT)实验。继续治疗1周后,禁食24 h,动物以45 mg/kg戊巴比妥钠腹腔注射麻醉,腹主动脉取血,分离血清用于检测TC、TG、HDL-C、LDL-C、NEFA。取附睾周围脂肪组织及肝组织适量,部分以4%多聚甲醛固定,石蜡包埋切片,部分存于液氮中。
1.4.4 指标测量 ①按照试剂盒说明书检测各血清学指标;②肝组织脂肪含量的测定 取约0.5 g肝右叶匀浆,肝组织按 1∶9(W/V)比例加入10%抽提液(氯仿∶甲醇,2∶1,V/V),抽提 24 h,4℃ 1500 g 离心 15min,取上清用酶法测定肝脏组织TG含量;③ western blot测定肝组织及脂肪组织GLP-1R、GLUT-4蛋白表达: 按蛋白抽提试剂盒说明书提取肝脏及脂肪组织总蛋白,考马斯亮蓝G-250测定蛋白浓度;每例标本取50 μg等量蛋白,蛋白电泳采用10%SDS-PAGE凝胶,应用湿转法转膜后,置于封闭液(5%脱脂奶粉),封闭2 h,再用工作浓度为1∶200~1000的抗体稀释液,4℃孵育过夜。第2天TBST洗膜后用工作浓度为1∶5000的山羊抗大鼠IgG-HRP二抗摇床孵育2 h后,进行杂交ECL化学发光。每条带的吸光度值通过凝胶成像系统分析,各蛋白的相对表达量用蛋白/内参的比值表示。

2 结果
2.1 组大鼠OGTT水平比较
表1图1显示,与正常组比较,模型组大鼠血清OGTT0 h、0.5 h、1 h、2 h、3 h血糖水平均升高(P<0.01);与模型组比较,中药组、贝特组大鼠血清OGTT0 h、0.5 h、1 h、2 h、3 h血糖水平均有不同程度降低,差异有统计学意义(P<0.01)。

表1 各组大鼠OGTT水平比较
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:▲P<0.05,▲▲P<0.01

图1 各组大鼠OGTT结果
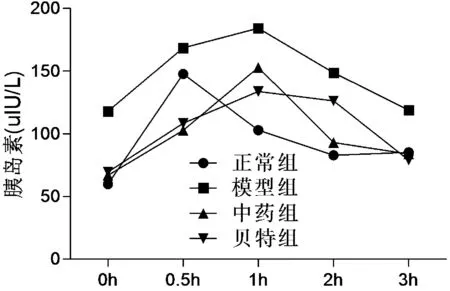
图2 各组大鼠IRT结果
2.2 各组大鼠IRT水平比较
表2图2显示,与正常组比较,模型组大鼠血清IRT0 h、0.5 h、1 h、2 h、3 h胰岛素水平均升高(P<0.01),与模型组比较,中药组、贝特组大鼠血清IRT0 h、0.5 h、1 h、2 h、3 h胰岛素水平均有不同程度降低,差异有统计学意义(P<0.01)。

表2 各组大鼠IRT结果
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:▲P<0.05,▲▲P<0.01
2.3 各组大鼠HOMA-IR、胰岛素敏感指数(ISI)及肝脏TG含量比较
表3显示,与正常组比较,模型组大鼠HOMA-IR、肝脏TG含量明显升高(P<0.01),而ISI水平明显降低(P<0.01);与模型组比较,中药组、贝特组HOMA-IR及肝脏TG含量明显降低(P<0.01),ISI水平明显升高,差异有统计学意义(P<0.05,P<0.01)。

表3 各组大鼠HOMA-IR、ISI及肝脏TG含量比较
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:▲P<0.05,▲▲P<0.01
2.4 各组大鼠血脂水平比较
表4显示,与正常组比较,模型组大鼠血清HDL-C降低(P<0.01),TC、TG、LDL-C、NEFA均升高(P<0.01);中药组、贝特组血清TC、TG、LDL-C、NEFA与模型组比较均降低(P<0.01),HDL-C升高(P<0.01)。
2.5 各组大鼠肝组织切片HE染色结果
光镜下观察,正常组肝细胞排列正常,无明显病理改变 (图3-A);模型组肝组织表现为弥漫性脂肪变性,肝细胞体积增大,胞核居边,胞质中可见大量脂滴空泡,病变最明显处为中央静脉周围,且小叶内有炎症细胞浸润(图3-B);中药组和贝特组大鼠肝脏病理学变化较模型组明显减轻(图3-C、图3-D)。

表4 各组大鼠血脂水平比较
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:▲P<0.05,▲▲P<0.01
2.6 各组大鼠肝脏及脂肪组织GLP-1R蛋白表达的比较
模型组大鼠肝脏GLP-1R蛋白表达明显低于正常组(P<0.01),经过8周治疗后,中药组及贝特组大鼠肝组织中GLP-1R蛋白表达较模型组增加,差异均有统计学意义(P<0.01)。模型组大鼠脂肪组织GLP-1R蛋白表达明显高于正常组(P<0.01),经过8周治疗后,中药组及贝特组大鼠脂肪组织中GLP-1R蛋白表达与模型组比较,差异无统计学意义(P>0.05)。
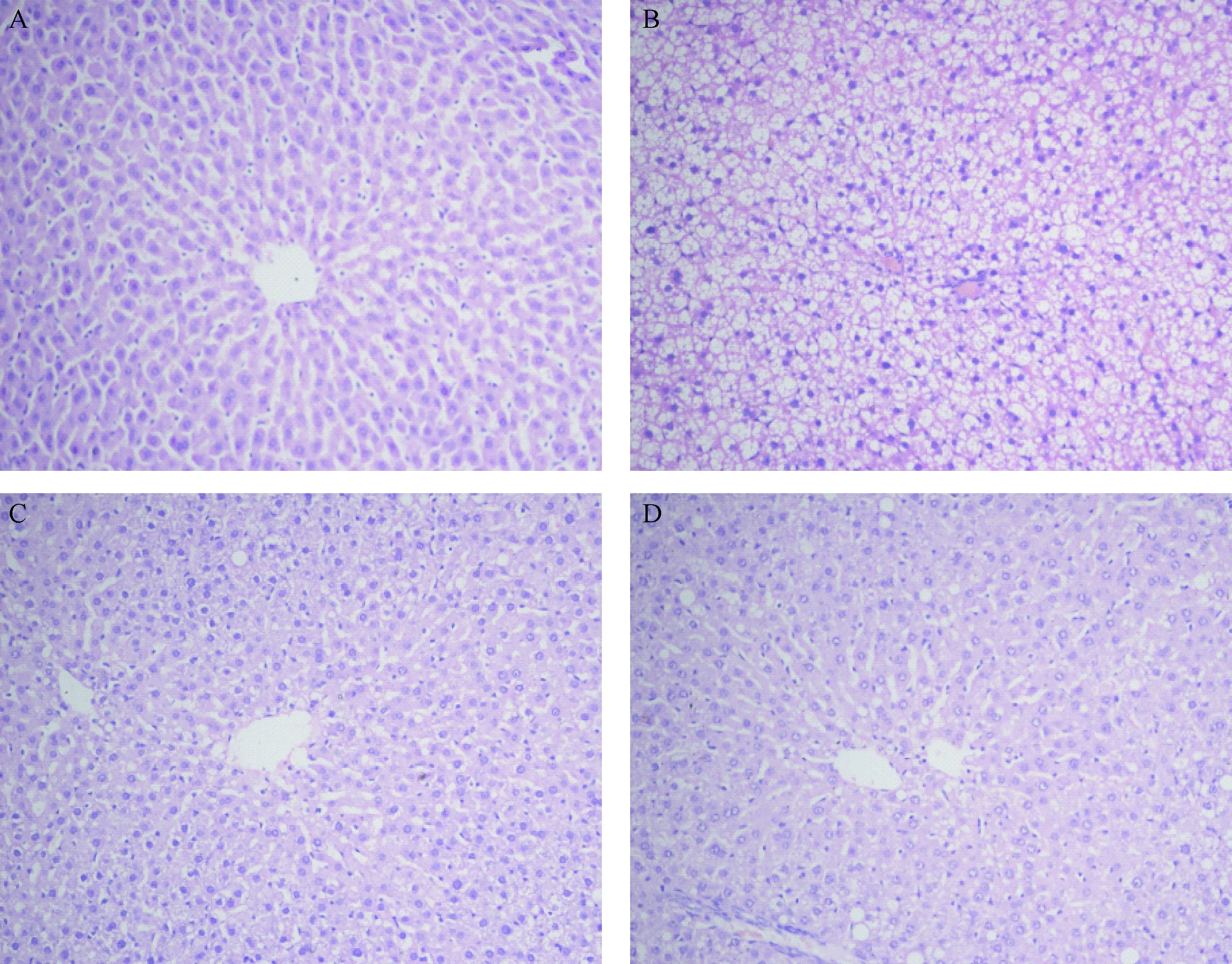
图3 各组大鼠肝脏组织学结果比较 (HE染色,×400)
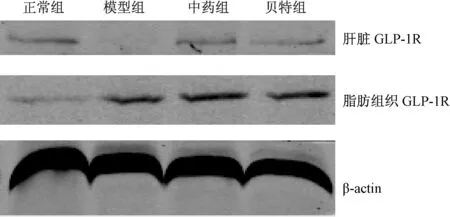
图4 各组大鼠肝脏及脂肪组织中GLP-1R蛋白的表达
2.7 各组大鼠肝脏及脂肪组织GLUT-4蛋白表达的比较
模型组大鼠肝脏及脂肪组织GLUT-4蛋白表达均明显低于正常组(P<0.01),经过8周治疗后,中药组及贝特组大鼠肝脏及脂肪组织中GLUT-4蛋白表达较模型组增加,差异均有统计学意义(P<0.01)。
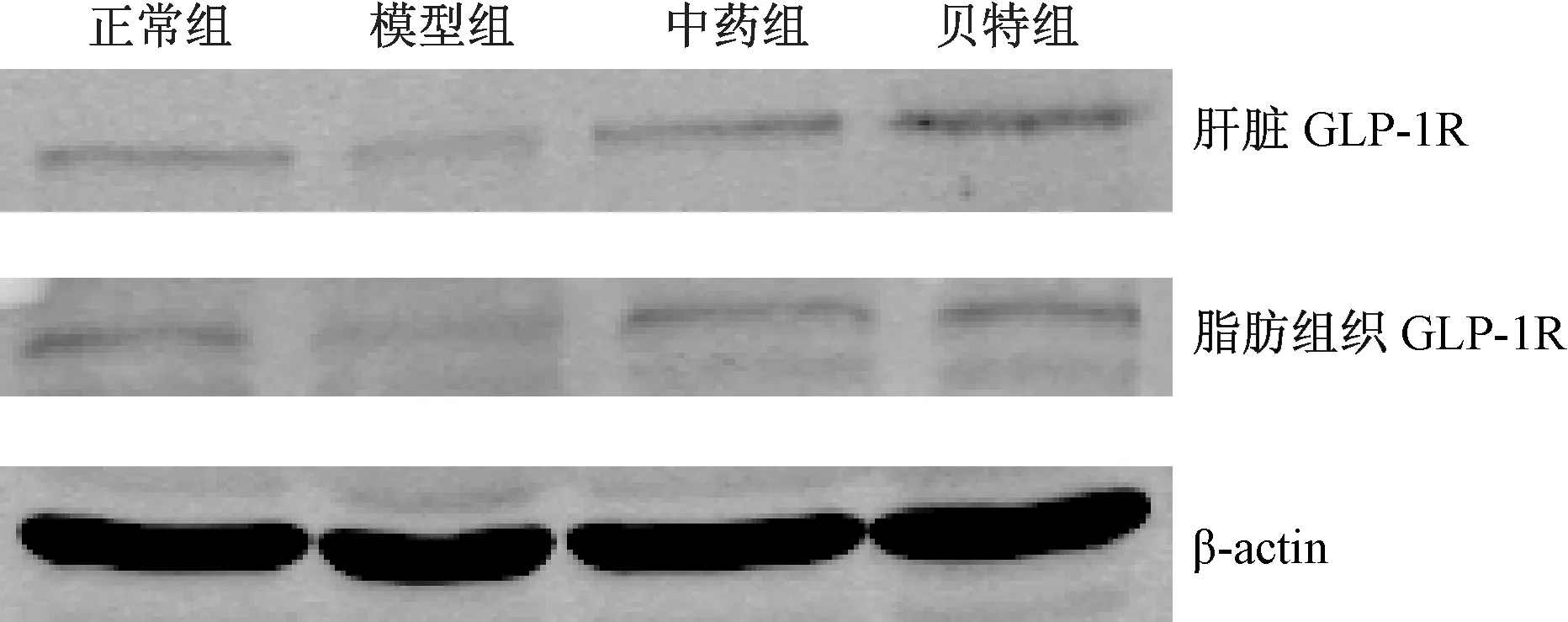
图5 各组大鼠肝组织中GLUT-4蛋白的表达
3 讨论
高脂高热量饮食与高脂血症、脂肪肝、胰岛素抵抗等代谢性疾病关系密切,脂肪组织及异位沉积的脂肪均可导致NEFA升高,进而引起肝脏、骨骼肌、脂肪组织等外周组织的胰岛素信号传导障碍,发生胰岛素抵抗。目前,包括贝特类、他汀类、二甲双胍、GLP-1受体激动剂等在内的多种治疗高脂血症和胰岛素抵抗的药物疗效明确,但此类药物长期使用造成的副作用,如肝功能受损、肝酶升高等难以避免。因此,新型降脂药物的研究成为热点。而有关中医药的降糖调脂作用及其机制的研究也在不断深入。
中医学理论认为,此类疾病的病因大多都是由于肥甘厚味入胃,湿热聚集于中焦,气、血、津液的运行和代谢受到影响,化为痰浊、瘀血,病程日久,痰浊瘀血化热,导致气阴两伤。因此,此类病人多表现为肥胖、少气懒言、动则汗出、口干多饮、舌暗、有瘀斑等证属气阴两虚兼有瘀血的表现。
活血降糖饮是我科通过多年临床经验总结的协定方,具有益气养阴、活血通络的功效。本研究结果表明,使用活血降糖药干预长期高脂饮食喂养诱导的胰岛素抵抗、高脂血症模型大鼠8周后,大鼠胰岛素抵抗及血脂水平明显改善,肝脏TG含量明显降低,说明其具有明显的改善胰岛素抵抗和调脂作用。
肠促胰素的缺乏以及其受体后信号障碍在外周组织胰岛素抵抗发生过程中起重要作用。胰高糖素样肽-1(GLP-1)以葡萄糖依赖的方式通过与胰岛β细胞表面的GLP-1受体(GLP-1R)结合后,刺激胰岛β细胞分泌胰岛素,对血糖进行调节,除此之外,外周组织,如肺、肾、肝、胃、肠、肌肉、脂肪等均有GLP-1R表达[1-2]。外周组织GLP-1R的表达受多种因素的调节,如体质量减轻、肝脂肪变性程度减轻、胰岛素敏感性增加等均能够增加肝脏GLP-1R表达,而经过高脂饮食喂养后,小鼠肝脏GLP-1R表达明显下调[3]。同时在外周组织,GLP-1/GLP-1R信号对糖代谢具有重要调节作用,GLP-1R缺乏的转基因小鼠表现为明显的肝脏胰岛素抵抗,有关脂肪生成和糖异生的激酶表达也明显增加[4-5]。而在脂肪组织,GLP-1R的作用存在一定争议[6]。有人认为在胰岛素抵抗时,内脏脂肪GLP-1R的增加是作为整体GLP-1水平下降的一种代偿作用[7]。但也有研究认为,GLP-1/GLP-1R信号会抑制人骨髓间充质干细胞成脂分化[8]。本研究表明,经过长时间高脂饲料喂养,肝脏GLP-1R蛋白表达明显下调,而经过活血降糖饮治疗后,肝脏GLP-1R蛋白表达明显上调,证明活血降糖饮可能通过GLP-1/GLP-1R信号影响肝脏葡萄糖代谢。在脂肪组织,长期高脂饲料喂养导致脂肪组织GLP-1R蛋白表达增加,与Vendrell J等的文献报道结果类似。经活血降糖饮治疗后,脂肪组织GLP-1R表达无明显变化,其具体原因有待进一步研究。
GLUTs是一组能够促进葡萄糖跨膜转运的膜蛋白,其包括多个亚型[9-10]。肝脏和脂肪组织中,主要由GLUT-4发挥胰岛素依赖的葡萄糖转运工作[11],因此GLUT-4在胰岛素敏感组织中发挥着葡萄糖利用的限速作用。GLUT-4的表达受到多种因素的调节,如胰岛素介导的磷脂酰肌醇3激酶(PI3K)信号传导和蛋白激酶(AMPK)信号传导均对其有激活作用[12-13]。Kim S的研究则证实,GLP-1/GLP-1R信号能促进肝脏GLUT-4蛋白表达[14]。本研究结果显示,长期高脂饮食可以降低大鼠肝脏及脂肪组织GLUT-4蛋白表达,与文献报道一致。经活血降糖饮治疗后,能够增加GLUT-4蛋白表达。然而,其作用是否通过GLP-1R信号通路仍需进一步研究。
本研究中,经过28周高脂饲料喂养诱导高脂血症及胰岛素抵抗动物模型,造模方法与成人高脂血症、胰岛素抵抗的发病模式更为接近,模型动物表现为明显的肥胖、糖脂代谢紊乱、胰岛素抵抗、胰岛素分泌峰值延后、峰值较平、肝组织病理切片显示弥漫性脂肪变性,肝组织TG含量增加,GLP-1R、GLUT-4蛋白表达下调,脂肪组织GLUT-4蛋白表达下调,GLP-1R蛋白表达上调。活血降糖饮由黄芪、生地、丹参等16味中药组成,具有益气养阴、活血通络的功效。前期基础及临床研究表明,其具有良好的降糖、调脂效果,但机制不明[15-16]。本研究证明,活血降糖饮能够有效降低肝脏TG含量,上调肝脏GLP-1R、GLUT-4蛋白表达,上调脂肪组织GLUT-4蛋白表达,改善外周组织葡萄糖利用,这可能是其改善机体胰岛素抵抗、降糖、调脂的机制之一。而对脂肪组织GLP-1R的影响及作用机制仍不明确,有待进一步研究。
综上所述,活血降糖饮对大鼠高脂血症及胰岛素抵抗有确切的治疗作用,其作用效果与非诺贝特类似,其作用机制可能与减少肝脏脂肪沉积、增加肝脏GLP-1R蛋白、增加肝脏及脂肪组织GLUT-4蛋白表达有关。
[1] Drucker D J. The biology of incretin hormones[J]. Cell Metab, 2006,3(3):153-165.
[2] Li Y, Tweedie D, Mattson M P, et al. Enhancing the GLP-1 receptor signaling pathway leads to proliferation and neuroprotection in human neuroblastoma cells[J]. J Neurochem, 2010,113(6):1621-1631.
[3] Lee J, Hong S W, Chae S W, et al. Exendin-4 improves steatohepatitis by increasing Sirt1 expression in high-fat diet-induced obese C57BL/6J mice[J]. PLoS One, 2012,7(2):e31394.
[4] Ayala J E, Bracy D P, James F D, et al. Glucagon-like peptide-1 receptor knockout mice are protected from high-fat diet-induced insulin resistance[J]. Endocrinology, 2010,151(10):4678-4687.
[5] Lee Y S, Shin S, Shigihara T, et al. Glucagon-like peptide-1 gene therapy in obese diabetic mice results in long-term cure of diabetes by improving insulin sensitivity and reducing hepatic gluconeogenesis[J]. Diabetes, 2007,56(6):1671-1679.
[6] Challa T D, Beaton N, Arnold M, et al. Regulation of adipocyte formation by GLP-1/GLP-1R signaling[J]. J Biol Chem, 2012,287(9):6421-6430.
[7] Vendrell J, El B R, Peral B, et al. Study of the potential association of adipose tissue GLP-1 receptor with obesity and insulin resistance[J]. Endocrinology, 2011,152(11):4072-4079.
[8] Sanz C, Vazquez P, Blazquez C, et al. Signaling and biological effects of glucagon-like peptide 1 on the differentiation of mesenchymal stem cells from human bone marrow[J]. Am J Physiol Endocrinol Metab, 2010,298(3):E634-E643.
[9] Ding X, Guo L, Zhang Y, et al. Extracts of pomelo peels prevent high-fat diet-induced metabolic disorders in c57bl/6 mice through activating the PPARalpha and GLUT4 pathway[J]. PLoS One, 2013,8(10):e77915.
[10] Zhao F Q, Keating A F. Functional properties and genomics of glucose transporters[J]. Curr Genomics, 2007,8(2):113-128.
[11] Rea S, James D E. Moving GLUT4: the biogenesis and trafficking of GLUT4 storage vesicles[J]. Diabetes, 1997,46(11):1667-1677.
[12] Jackson S, Bagstaff S M, Lynn S, et al. Decreased insulin responsiveness of glucose uptake in cultured human skeletal muscle cells from insulin-resistant nondiabetic relatives of type 2 diabetic families[J]. Diabetes, 2000,49(7):1169-1177.
[13] Koistinen H A, Galuska D, Chibalin A V, et al. 5-amino-imidazole carboxamide riboside increases glucose transport and cell-surface GLUT4 content in skeletal muscle from subjects with type 2 diabetes[J]. Diabetes, 2003,52(5):1066-1072.
[14] Kim S, Jung J, Kim H, et al. Exendin-4 Improves Nonalcoholic Fatty Liver Disease by Regulating Glucose Transporter 4 Expression in ob/ob Mice[J]. Korean J Physiol Pharmacol, 2014,18(4):333-339.
[15] 张志玲, 李惠林, 董彦敏, 等. 活血降糖饮对2型糖尿病代谢及血液流变学的疗效观察[J]. 中国中医基础医学杂志, 2004,10(7):70-71.
[16] 李惠林, 张志玲, 朱章志, 等. 活血降糖饮对实验性糖尿病大鼠氧自由基的影响[J]. 中医杂志, 2005,46(11):844.

