黑曲霉产菊粉酶菌株的选育及培养基优化
徐艳新,张伟国,葛向阳
(江南大学工业生物技术教育部重点实验室,无锡214122)
黑曲霉产菊粉酶菌株的选育及培养基优化
徐艳新,张伟国,葛向阳
(江南大学工业生物技术教育部重点实验室,无锡214122)
为获得高产菊粉酶的黑曲霉菌株,以AspergillusnigerYH-1为出发菌株,经过亚硝基胍(NTG)诱变,以高温高菊芋粉相结合的方式进行梯度驯化,选育出一株产菊粉酶菌株YH-3,并运用响应面实验方法对该菌株的培养基进行优化。确定了最佳培养基组成:菊芋粉25.2 g/L、豆饼粉40 g/L、蔗糖酯4.9 g/L、NaCl 5.5 g/L。发现内切菊粉酶活力(I)由60.9 U/mL提高到165.0 U/mL,比出发菌株提高了1.7倍。研究证明蔗糖酯对于黑曲霉YH-3发酵产菊粉酶是一种有效的促进剂。
黑曲霉;驯化;菊粉酶;诱变;响应面
菊芋是菊科(Compositae)向日葵属中能形成地下块茎的栽培种,地下块茎含有丰富的菊粉,约占菊芋肥大块茎干质量的70%以上[1]。菊粉(inulin)是一种菊糖型果聚糖,分子由D-呋喃果糖通过β-1,2糖苷键相连,还原端接一个葡萄糖残基,呈直链结构,聚合度为2~60,相对分子质量在3 500~5 500之间[1-2]。
菊粉酶按其作用方式不同分为内切菊粉酶和外切菊粉酶,分别用I和S表示,I/S越大,表明内切菊粉酶活力越大;反之则表明外切菊粉酶活力越大[3]。内切菊粉酶随机地切断菊粉链内部的糖苷键,水解产物主要是低聚果糖;外切菊粉酶作用于菊粉链的非还原性末端的糖苷键,逐一切断糖苷键,主要产物是果糖。经菊粉酶酶解得到的低聚果糖和果糖,由于具有多种优良的生理功能而备受关注[4]。目前,利用菊粉生产低聚果糖或果糖的瓶颈是菊粉酶活性不高。为此,进一步提高菊粉酶活力引起了国内外学者的广泛关注[5]。
笔者对一株产菊粉酶的黑曲霉菌株进行亚硝基胍诱变,以高温高菊芋粉相结合的方式进行梯度驯化,选育出一株产菊粉酶发酵活力较强的菌株,并对影响产酶的显著因素进行了响应面优化,以期得到较高的菊粉酶活力。
1 材料与方法
1.1 菌株
黑曲霉菌株YH-1 (AspergillusnigerYH-1),由笔者所在实验室分离并保藏。
1.2 试剂
菊芋粉(自制):将洗净去皮的鲜菊芋切片,60 ℃烘干,使水分降至5%左右,粉碎过450 μm筛;蛋白胨、(NH4)2SO4、KCl、MgSO4·7H2O、蔗糖酯、菊糖、蔗糖均为分析纯。
1.3 仪器
立式圆形压力蒸气灭菌锅,上海医用核子仪器厂;全温摇床柜,太仓市常乐实验设备厂;UV-2100型可见紫外分光光度计,上海尤尼克有限公司;超净工作台,苏净集团安泰公司;升降恒温水浴锅,上海申顺生物科技有限公司;分析天平,上海奥豪斯国际贸易有限公司。
1.4 培养基
斜面保藏培养基(g/L):葡萄糖20,土豆200,琼脂20。
菊芋粉平板培养基(g/L):菊芋粉(100、120、140、160、180、200、220、250),琼脂20;pH自然,121 ℃灭菌20 min。
驯化培养基(g/L):菊芋粉(梯度质量浓度分别为180、200),琼脂20;pH自然,装液量50 mL/250 mL,121 ℃灭菌20 min。
发酵培养基(g/L):菊芋粉40、豆饼粉50、MnSO40.3、NaCl 0.8、MgSO4·7H2O 0.5、蔗糖酯3;pH自然,装液量100 mL/500 mL,115 ℃灭菌10 min。
1.5 酶活力测定方法
测量方法参照Pessoni等[6]和周杰民等[7]的报道略有改进:内切菊粉酶酶活力的测定:取20 g/L菊糖溶液0.4 mL(pH 4.6、0.2 mol/L Na2HPO4-0.1 mol/L柠檬酸缓冲液配制)加入到25 mL具塞试管中,并于50 ℃水浴平衡5 min,再加入0.1 mL适当稀释的粗酶液,50 ℃水浴反应30 min,最后加入0.5 mL DNS终止反应。沸水浴5 min,待冷却后定容至10 mL,550 nm比色,测定反应体系中还原糖量。在相同条件下,加入灭活的粗酶液0.1 mL作为对照。在上述条件下,每分钟催化底物产生1 μmol还原糖所需酶量为一个酶活力单位(U),用I表示。
外切菊粉酶酶活力的测定:以20 g/mL蔗糖溶液0.4 mL代替菊糖溶液,其他步骤同上。以每分钟催化底物产生1 μmol还原糖所需酶量为一个酶活单位(U),用S表示。
1.6 诱变方法
1.6.1 单孢子悬液的制备
黑曲霉斜面培养3 d,制成孢子悬液,经无菌滤纸过滤,适当稀释后得到密度为106个/mL单孢子悬液。
1.6.2 亚硝基胍(NTG)诱变
吸取1 mg/mL的NTG溶液1 mL加入到装有2 mL单孢子悬液的碘量瓶中,30 ℃下振荡反应一定的时间,离心沉降,弃去上清液,用无菌生理盐水悬浮,适当稀释后涂布于筛选平板。
1.7 筛选方法
1.7.1 初筛
将诱变后的孢子悬液适当稀释,涂布于菊芋粉质量浓度为100 g/L筛选平板,30 ℃培养72 h,挑选出R值(R=T/J,T为透明圈直径,J为菌落直径)较大的单菌落接种于斜面培养基保藏[8]。
1.7.2 复筛
将初筛得到的菌株先进行种子液培养,然后每株菌分别按5%接种量接种于发酵培养基,30 ℃振荡培养120 h,筛选出产酶最高的菌株YH-2。
1.8 驯化
首先对菌株YH-2进行温度和菊芋粉浓度的耐受极限研究,确定驯化的起始温度和菊芋粉浓度。然后对菌株进行高温高菊芋粉相结合的梯度驯化,使其在极端环境下能够生长,提高产酶活力。最后,将驯化后的菌株经初筛复筛得到一株产酶菌株YH-3,并检验该菌株对温度和菊芋粉浓度的耐受性。
1.9 响应面(RSM)实验设计
由单因素实验确定了豆饼粉添加量为40 g/L,MnSO4、MgSO4·7H2O几乎不影响产酶量,因此添加量为0,对产酶影响显著的3个因素为:菊芋粉、蔗糖酯和NaCl。根据Box-Behnken Design(BBD)中心组合实验设计原理[9-10],以影响产酶显著的三因素A(菊芋粉)、B(蔗糖酯)和C(NaCl)为自变量,以内切菊粉酶活力(I)为响应值,设计三因素三水平的BBD实验,实验因素和水平设计见表1。
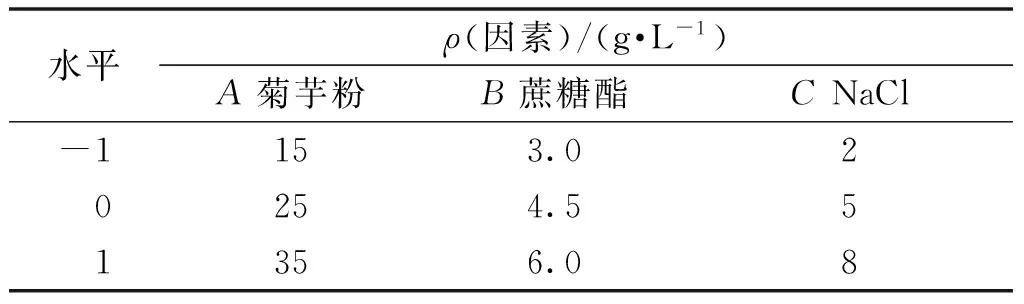
表1 响应面实验设计因素水平表Table 1 Factors and levels of response surface experiments
2 结果与讨论
2.1 亚硝基胍诱变
以实验室保藏的黑曲霉YH-1(I/S=0.38)为出发菌株,进行亚硝基胍诱变,经过初筛、复筛得到一株产酶菌株YH-1-52,重新命名为YH-2,发现内切菊粉酶活力(I)由60.9 U/mL提高到77.4 U/mL,比出发菌株YH-1提高了27%,诱变筛选结果见表2。
由表2可知,诱变前后I/S比值基本不变。表明传统的诱变方法不能够改变黑曲霉产菊粉酶的特性,这与王静等[3]的诱变结果相似。
2.2 耐高温及耐高菊芋粉驯化的结果
2.2.1 YH-2高温高菊芋粉相结合的梯度驯化
菊粉酶是一种诱导酶,在发酵培养基中,菊芋粉既是诱导物又是比较理想的C源。在发酵初期,菌体将菊芋粉分解为还原糖,其后又利用还原糖满足其生长需要,所以菊粉酶的产量会随着菊芋粉浓度增大而提高。但菊芋粉浓度太高,菊芋粉中含有的少量还原糖会使发酵培养基中还原糖总量增加,以及发酵过程中分解得到的还原糖量的增加,都会抑制菌种产酶[3]。高温发酵可以抑制杂菌生长,而且,较高的温度可以诱导孢子萌发[11],刺激菌体迅速生长,对产酶有促进作用。因此采用高温高菊芋粉相结合的驯化思路,以期获得产酶较高的菌株[12]。
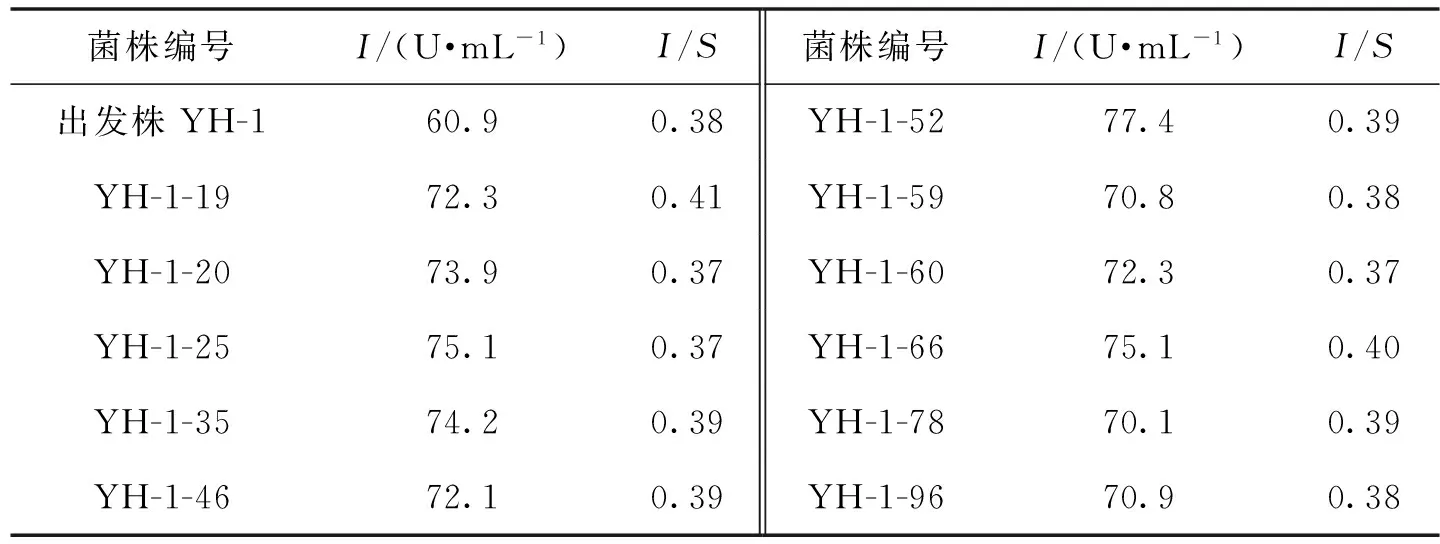
表2 NTG诱变结果Table 2 Results of NTG treatment
首先对NTG诱变得到的菌株YH-2进行耐菊芋粉性能和耐高温性能的研究,确定了菌株YH-2对菊芋粉和温度的耐受极限分别是180 g/L和39 ℃,所以驯化以180 g/L和39 ℃为起始梯度。吸取适量的YH-2的孢子悬液接种于菊芋粉质量浓度为180 g/L的驯化培养基,39 ℃培养32 h,反复驯化5次。接着接种于菊芋粉质量浓度为200 g/L的驯化培养基,41 ℃培养32 h,反复驯化5次,具体步骤见表3。将最后得到的孢子液适当的稀释,经过初筛,复筛选育出一株产酶菌株YH-2-60,重新命名为YH-3,结果见表4。
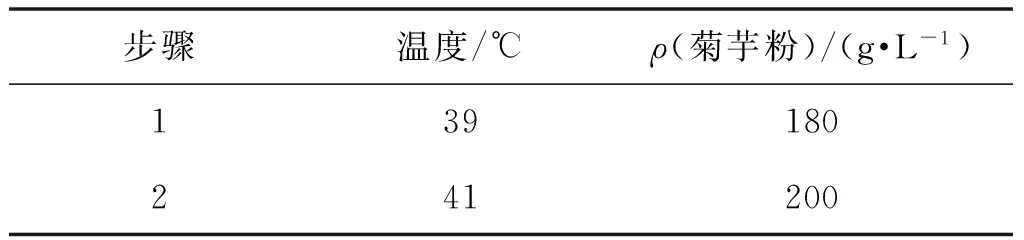
表3 驯化培养条件Table 3 Training conditions of domestication
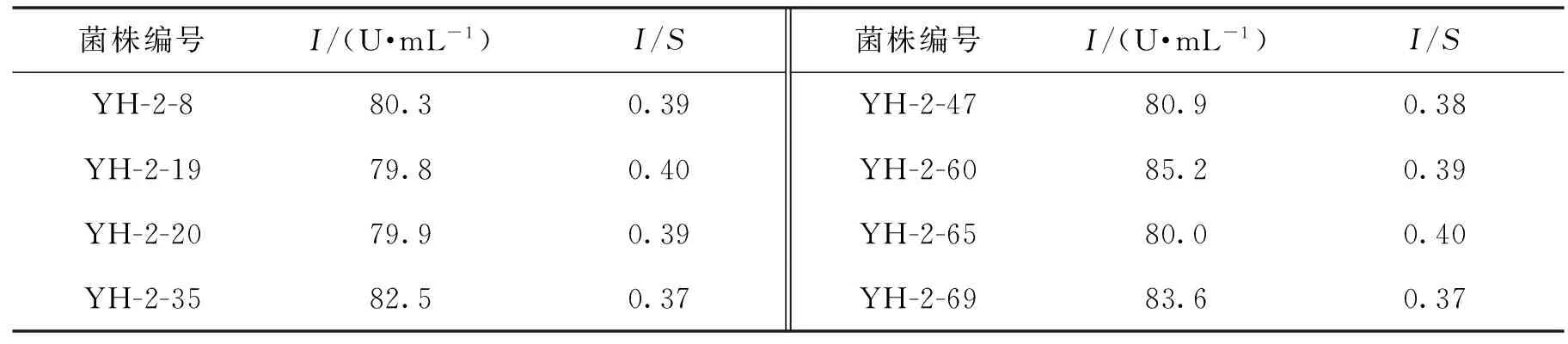
表4 驯化选育结果Table 4 Results of acclimatization and screening
由表4可知,YH-3内切菊粉酶活力(I)由77.4 U/mL提高到85.2 U/mL,比YH-2提高了10%,I/S保持不变。该结果表明,高温高菊芋粉相结合的梯度驯化方法,对于提高菊粉酶的产量有一定的促进作用。2.2.2 驯化前后菌株对菊芋粉和温度耐受性的对比
将驯化前后的菌株YH-2、YH-3进行耐菊芋粉性能和耐高温性能的对比。制备孢子悬液并适当稀释,分别涂布到不同浓度的菊芋粉平板,30 ℃培养3 d,以菌体的生长状况表征对菊芋粉的耐受性,结果见表5。
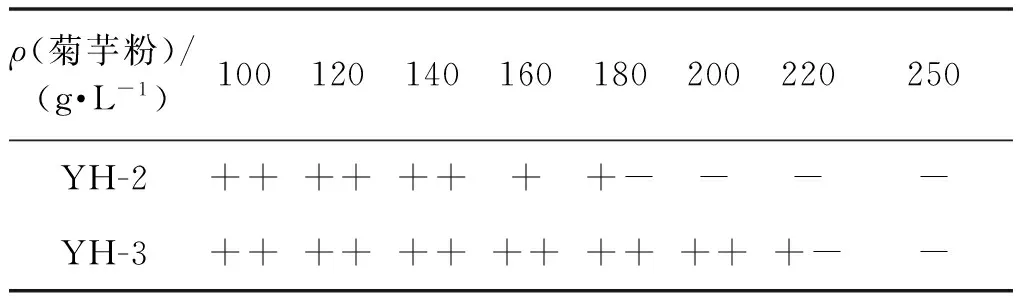
表5 YH-2、YH-3对菊芋粉的耐受性Table 5 Tolerability of YH-2 and YH-3 to Jerusalem artichoke powder
注:++生长较好,+-微弱生长,-不生长。
将孢子悬液涂布到菊芋粉质量浓度为100 g/L的平板,分别放在不同的温度下培养3 d,以菌体的生长状况表征对温度的耐受性,结果见表6。

表6 YH-2、YH-3对温度的耐受性Table 6 Tolerability of YH-2 and YH-3 to temperature
注:++生长较好,+-微弱生长,-不生长。
经过高温、高菊芋粉相结合的梯度驯化,菌株的耐高温耐菊芋粉的能力都得到了相应的提高。由表5可知,YH-2菌株对菊芋粉的耐受临界浓度为180 g/L,超过此浓度已不能生长。YH-3在高于220 g/L时菌株不能生长。驯化前后菌株对菊芋粉的耐受浓度由180 g/L提高到220 g/L。
由表6可知,YH-2对温度的耐受临界值为39 ℃,超过此温度菌株不能生长。YH-3在高于41 ℃时菌株不能生长。驯化前后菌株对温度的耐受性由39 ℃提高到41 ℃。
2.3 菌株选育谱系
菌株选育谱见图1。

图1 YH-1选育谱系Fig.1 Breeding process of YH-1
2.4 菌株YH-3的遗传稳定性
将最终筛选出的菌株A.nigerYH-3进行多次分离纯化,并斜面保藏。平板连续传代10次,在相同培养条件下,产酶结果见表7,结果表明该株菌遗传特性稳定。
2.5 蔗糖酯对黑曲霉产酶的影响
蔗糖酯,是由蔗糖通过酯键与硬脂酸共价键链接[13]。该物质的分子结构中含有亲水性的蔗糖基团和疏水性的脂肪酸基团,在水溶液中成球形的分子排布,具有很强的表面活性,更有利于靠近并吸附在真菌菌丝体的表面,作为持续的刺激信号促进细胞不断地合成以用于生产菊粉酶的mRNA,从而有效地促进菊粉酶的生成[14]。
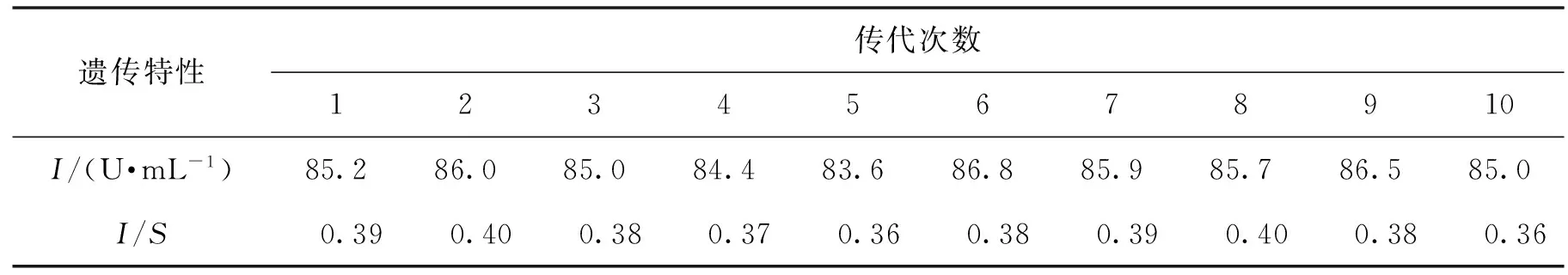
表7 YH-3的遗传稳定性实验Table 7 Genetic stability of YH-3
由单因素实验确定了发酵培养基中蔗糖酯的最佳添加量为5 g/L。在发酵培养基中添加5 g/L的蔗糖酯,经过100 h发酵,发现在添加了蔗糖酯的培养基中菊粉酶活力达到最大值137 U/mL,而没有添加蔗糖酯的培养基中,菊粉酶活力仅达到85.2 U/mL。这表明蔗糖酯对于发酵产菊粉酶是一种有效的促进剂,结果见图2。
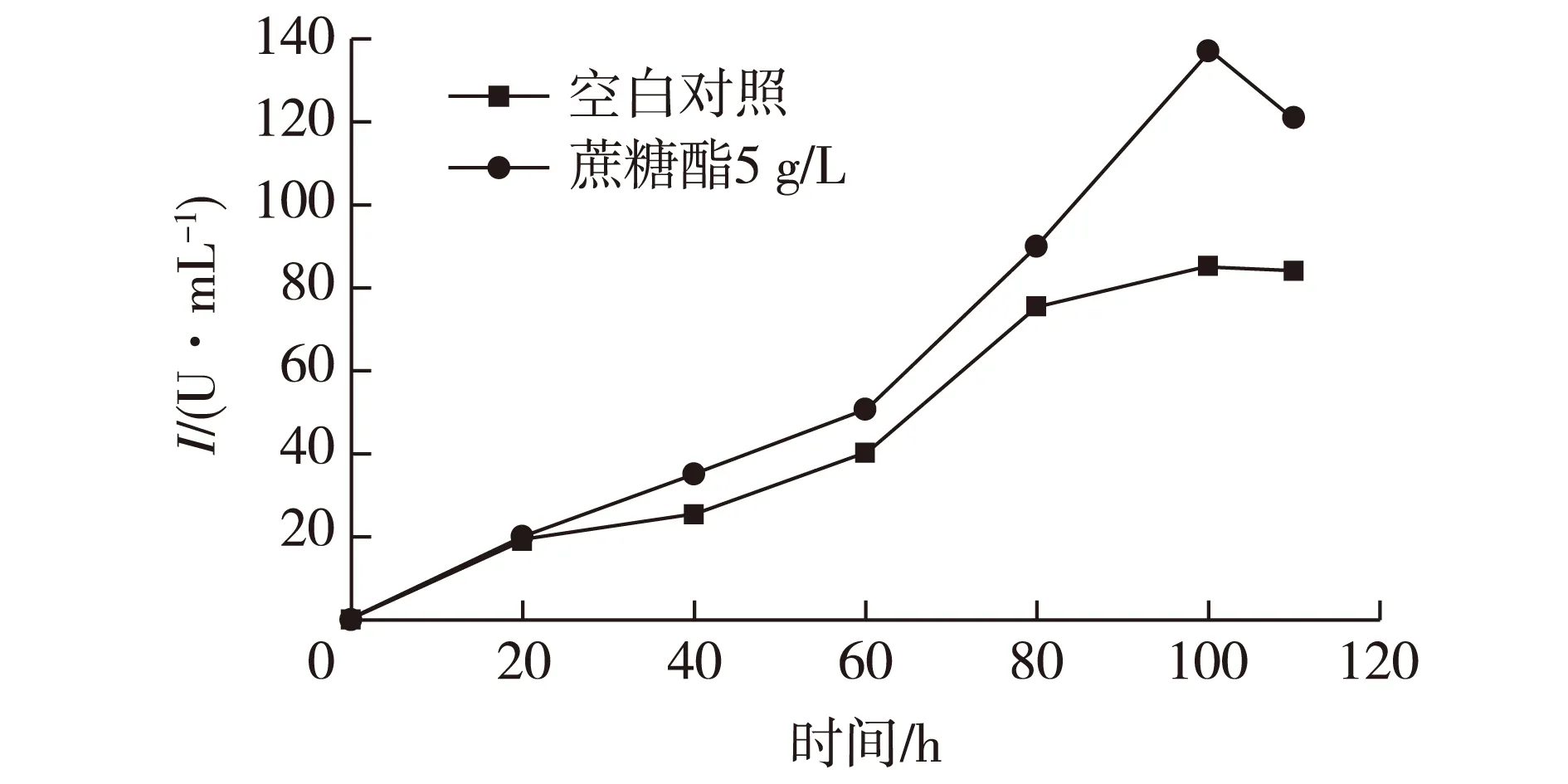
图2 蔗糖酯对发酵产菊粉酶的影响Fig.2 Effects of sucrose ester on the inulinase fermentation production
由图2可知:在0~60 h,以菌丝体生长为主,对照和添加蔗糖酯没有明显的差异。从60 h开始菌体以产酶为主,尤其是80 h以后,蔗糖酯对于黑曲霉产酶有明显的促进作用,100 h菊粉酶的产量达到了顶峰。
2.6 响应面实验结果分析
实验中使用Box-Behnken Design法对影响菊粉酶发酵的3个关键因素进行了优化,不同因素的水平值和实验结果见表8,并利用Design Expert软件对模型的适应性进行了方差分析检验,结果见表9。
由表9可知,模型的F值为46.53,P(Prob>F)值为0.000 3,比较显著,且失拟检验不显著(P=0.265 1)。拟合系数(R2)为0.988 2,表明观察值与预测值之间相关性较好。模型的矫正系数(AdjR-Squared)0.967 0与PredR-Squared 0.841 3值较接近,说明实验的预测值在可信区间内。模型的精密度(Adeq Precision)为20.567>4,说明实验的精度较高。综上分析可知,该模型与实际情况拟合较好,可用于预测菊粉酶的发酵情况。
对实验结果多次回归分析得出内切菊粉酶活力对菊芋粉、蔗糖酯及NaCl的标准回归方程
Y=163.70+2.32A+19.47B+8.03C-6.17AB+2.38AC-0.18BC-28.26A2-32.91B2-24.91C2
Y为内切菊粉酶活力(I)的预测值,A、B、C为上述3个自变量的编码值。这3个因素对发酵产菊粉酶的影响顺序依次是B、C、A,此外,A2、B2和C2对菊粉酶的产量也有显著影响,A和B交互作用最为明显。这是因为蔗糖酯既可以作为诱导剂又可以作为表面活性剂,能够有效增大菌体细胞和菊粉酶与菊芋粉之间的接触,从而可以显著促进黑曲霉的产酶水平。这些因素之间的响应面图及对应的等高线图如图3~图5所示。

表8 响应面设计方案和实验结果Table 8 Results of response surface experiments

表9 回归模型方差分析Table 9 Analysis of variance for regression model
注:R2=0.988 2,C.V.=4.51%。
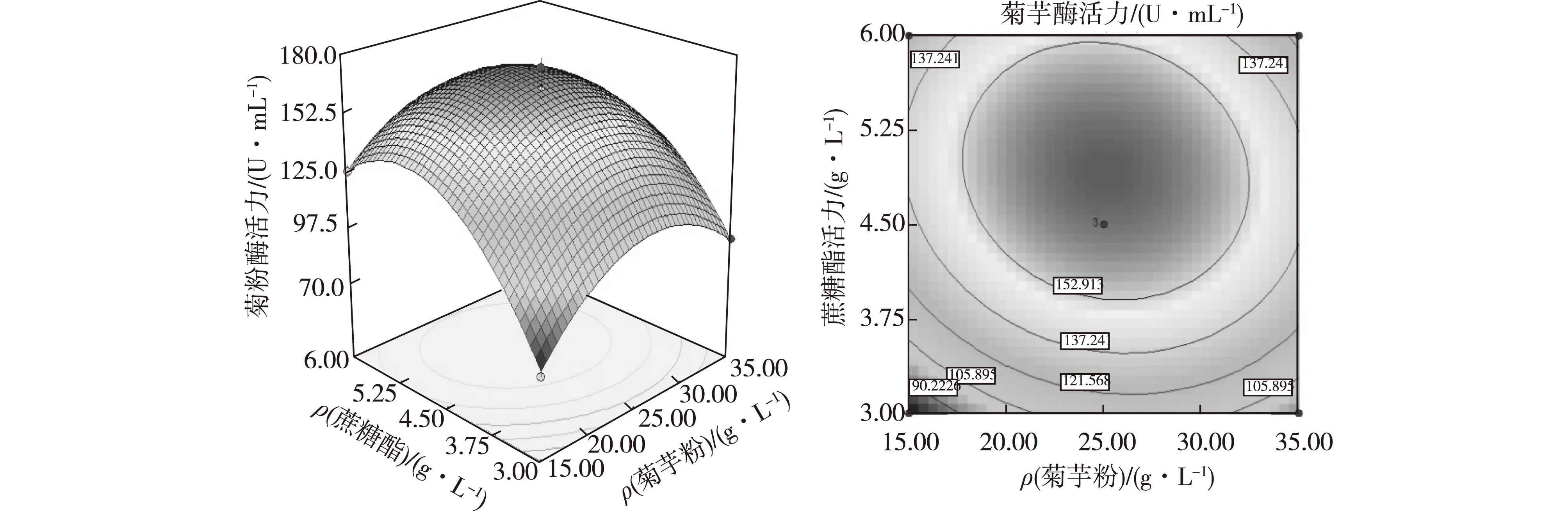
图3 菊芋粉(A)与蔗糖酯(B)对内切菊粉酶活力合成的影响Fig.3 Effects of Jerusalem artichoke flour and sucrose ester on inulinase production

图4 菊芋粉(A)与NaCl(C)对内切菊粉酶活力合成的影响Fig.4 Effects of Jerusalem artichoke flour and NaCl on inulinase production

图5 蔗糖酯(B)与NaCl(C)对内切菊粉酶活力合成的影响Fig.5 Effects of sucrose este and NaCl on inulinase production
由图3~5可知,回归模型存在稳定点即最大值,将二次回归方程分别对因素A、B、C求偏导,令导数等于0,得出3个因素的最佳值为A=0.016,B=0.294,C=0.160,Y=167.2。换算成真实浓度:菊芋粉25.2 g/L、蔗糖酯4.9 g/L、NaCl 5.5 g/L,内切菊粉酶活力(I)的预测值为167.2 U/mL,I/S=0.39。采用三因素的最佳值,进行3次发酵验证实验测得内切菊粉酶活力(I)为165.0 U/mL,I/S=0.39,与预测值接近。表明预测值与实验值之间有较好的拟合性,模型可信度较高。
3 结 论
对1株产菊粉酶的A.nigerYH-1进行DES诱变,经过初筛复筛,最终得到一株产菊粉酶菌株YH-2发现,内切菊粉酶活力由最初的60.9 U/mL提高到77.4 U/mL,比出发菌株提高了27%,诱变前后I/S=0.39没有变化。接着对YH-2进行了高温高菊芋粉相结合的梯度驯化,经过筛选得到一株产菊粉酶的菌株YH-3,内切菊粉酶活力由77.4 U/mL提高到85.2 U/mL,比YH-2提高了10%。实验中发现蔗糖酯对于黑曲霉YH-3发酵产菊粉酶是一种有效的促进剂。最后对产菊粉酶的发酵培养基进行了响应面优化,确定最佳培养基组成:菊芋粉25.2 g/L、豆饼粉40 g/L、蔗糖酯4.9 g/L,NaCl 5.5 g/L。发现内切菊粉酶活力可达165 U/mL,I/S=0.39,比出发菌株提高了1.7倍。
[1] Kushi R T,Monti R,Contiero J.Production,purification and characterization of an extracellular inulinase fromKluyveromycesmarxianusvar.bulgaricus[J].Journal of Industrial Microbiology and Biotechnology,2000,25(2):63-69.
[2] Ohta K,Suetsugu N,Nakamura T.Purification and properties of an extracellular inulinase fromRhizopussp.Strain TN-96[J].Journal of Bioscience and Bioengineering,2002,94:78-80.
[3] 王静,金征宇.黑曲霉产菊粉酶的发酵条件的优化及诱变育种[J].生物技术,2002,12(3):8-9.
[4] Rocha J R,Catana R,Ferreira B S,et al.Design and characterisation of an enzyme system for inulin hydrolysis[J].Food Chemistry,2006,95(1):77-82.
[5] Kango N.Production of inulinase using tap roots of dandelion (Taraxacumofcinale) byAspergillusniger[J].Journal of Food Engineering,2008,85(3):473-478.
[6] Pessoni R A B,Figueiredo-Ribeiro R C I,Braga M R.Extracelluar inulinase fromPenicilliumjanczewskii,a fungus isolated from the rhizosphere ofVernoniaherbacea[J].Journal of Applied Microbiology,1999,87(1):141-147.
[7] 周杰民,康传利,葛向阳,等.高温混菌发酵生产果胶酶的研究[J].食品工业科技,2012,33(3):160-163.
[8] 诸葛健,李华钟.微生物学[M].北京:科学出版社,2004.
[9] 吴立新,吴祖方.短小芽孢杆菌脂肪酸羟基化发酵特性与培养条件优化[J].食品与生物技术学报,2011,30(4):602-608.
[10] Treichel H,Mazutti M A,Filho F M,et al.Technical viability of the production,partial purification and characterisation of inulinase using pretreated agroindustrial residues[J].Bioprocess and Biosystems Engineering,2008,32(4):425-433.
[11] Huo Z,Yang X,Raza W,et al.Investigation of factors influencing spore germination ofPaenibacilluspolymyxaACCC10252 and SQR-21[J].Applied Microbiology and Biotechnology,2010,87(2):527-536.
[12] 穆晓玲.60Co-γ射线对柠檬酸产生菌的诱变育种[D].无锡:江南大学,2005.
[13] Puterka G J,Farone W,Palmer T,et al.Structure-function relationlships affecting the insecticidal and miticidal activity of sucrose esters[J].Journal of Economic Entomology,2003,96(2):636-644.
[14] Hames B D,Hooper N M,Houghton J D.Instant notes in biochemistry[M].3rded.Oxfordshine:Taylor & Francis Group,2005.
(责任编辑 周晓薇)
Breeding of Aspergillus niger strain for producing inulinase andoptimization of culture medium
XU Yanxin,ZHANG Weiguo,GE Xiangyang
(Key Laboratory of Industrial Biotechnology of the Ministry of Education,Jiangnan University,Wuxi 214122,China)
In order to acquire a high-yieldAspergillusnigerstrain for producing inulinase,the original strainAspergillusnigerYH-1 was treated withN-methyl-N′-nitro-soguanidine (NTG) and domesticated by combining high temperature andJerusalemartichokepowder,a inulinase production strain YH-3 was selected.The culture medium of YH-3 was optimized by response surface methodology.The results showed that the optimum culture medium components were determined:Jerusalemartichokeflour 25.2 g/L,soybean cake powder 40 g/L,sucrose ester 4.9 g/L and NaCl 5.5 g/L.Under the optimum conditions,the yield of inulinase was increased from 60.9 U/mL to 165.0 U/mL,increased 1.7 times compared with the starting strain.The research proved that sucrose ester was an effective accelerator forAspergillusnigerYH-3 producting inulinase.
:Aspergillusniger;domestication;inulinase;mutation;response surface methodology
10.3969/j.issn.1672-3678.2014.02.004
2012-07-08
中国博士后科学基金(20110491368)
徐艳新(1987—),女,山东聊城人,硕士研究生,研究方向:菌种选育及发酵条件优化;张伟国(联系人),教授,E-mail:zhangwg186@163.com
Q556+.2
A
1672-3678(2014)02-0017-07

