γ-Fe2O3-凹土超顺磁性纳米复合材料固载猪胰脂肪酶
胡集铖,王 欢,李 亚,韩萍芳
(南京工业大学 生物与制药工程学院,南京 211800)
脂肪酶因其催化反应的高效性[1-2]、高立体选择性[3]、反应条件温和等特点备受关注。然而,游离酶稳定性差、反应后难以与产品分离、不易重复利用,这些缺点制约了其在工业生产中的应用。为了提高其稳定性和利用效率,酶的固定化逐渐成为酶工程研究领域的热点。固定化酶的性能主要取决于固定化方法和所使用的载体材料。目前,制备固定化酶的方法主要有吸附法、共价法、交联法、包埋法等,其中吸附法因操作简便、条件温和,不会引起酶失活被广泛使用。理想的载体则应具备良好的机械强度、热稳定性、化学稳定性等特点,如二氧化硅[4-6]、多糖类[7-9]、高分子纳米纤维[10-13]、纳米粒子[14-15]等材料已被成功地用于固定化酶。
作为一类纯天然的矿物材料,硅酸盐黏土因具有价格低廉、比表面积大、孔隙率高、良好的吸附性和生物亲和性等优点被广泛用于吸附固定化酶。但是,凹土等传统载体固定化酶仍然存在从反应体系中分离较为复杂的缺点。对传统载体进行功能化修饰是目前克服该缺点的理想方案之一,如磁性复合载体的制备与应用。一方面,在外加磁场作用下,可以使固定化酶简单地从反应体系分离;另一方面,外部磁场使固定化酶的运动方式和方向得到控制,替代传统的机械搅拌,可以提高固定化酶的催化效率。
笔者通过制备γ-Fe2O3-凹土超顺磁性纳米复合材料(γ-Fe2O3-ATP),并将其用于猪胰脂肪酶的固定化,考察酶固定化条件及固定化酶的性质,以期为其在工业化方面的应用奠定基础。
1 材料与方法
1.1 药品与试剂
猪胰脂肪酶(PPL,BR),南京奥多福尼生物技术有限责任公司;凹凸棒石黏土(以下简称“凹土”),江苏澳特邦非金属矿业有限公司;NaHCO3、NaH2PO4、Na2HPO4、NaOH(均为AR),广东汕头西陇化工厂;FeCl3·6H2O(AR)、聚乙烯醇,国药集团化学试剂有限公司;橄榄油(化学纯),上海凌峰化学试剂有限公司;冰醋酸(AR),上海申博化工有限公司。
1.2 实验仪器
DSHZ-300A型恒温振荡器,太仓市试验设备厂;GL-21M型离心机,上海离心机械研究所;752紫外-可见光分光光度计,上海精密科学仪器有限公司;开启管式电阻炉,山东省龙口市先科仪器公司;H-800透射电子显微镜,日本日立公司;ASAP2010全自动比表面积及孔径分布测定仪,美国Micromeritics公司;振动试样磁强计,Lakeshore Cryotronic公司。
1.3 γ-Fe2O3-ATP的制备与表征
γ-Fe2O3-ATP的制备方法参照文献[16]的方法:配制0.02 mol/L FeCl3·6H2O溶液,调节 pH至2.5并室温搅拌1 h,再将其缓慢逐滴加到凹土悬浮液中并不断搅拌,离心得到 Fe3+-ATP,水洗至无Cl-,室温真空干燥后,研磨成粉末。将试样粉末暴露于80℃ 冰醋酸蒸气中,熏蒸3 h后暴露于相同温度的空气中几分钟,去除表面吸附的冰醋酸,得到FeAc3-ATP。在N2保护下400℃煅烧1 h后,即得到磁性试样γ-Fe2O3-ATP。
透射电子显微镜(TEM)表征:将制备好的γ-Fe2O3-ATP用透射电子显微镜进行观察,研究其表面形貌特征。
比表面积和孔径分布测定:通过ASAP2010全自动比表面积及孔径分布测定仪测定γ-Fe2O3-ATP的比表面积和平均孔径。
磁性能测定:将γ-Fe2O3-ATP在室温下通过振动试样磁强计测定其饱和磁化强度。
1.4 脂肪酶的固定化
向100 mL具塞三角烧瓶中加入2 mg/mL酶液40 mL、γ-Fe2O3-ATP 80 mg,在 25 ℃、110 r/min恒温水浴振荡器中固定一定时间以后,取出三角烧瓶,利用外加磁场使上清液和固定化酶分离。上清液中蛋白含量用考马斯亮蓝测定,其减少的蛋白质量即为γ-Fe2O3-ATP上所固载的脂肪酶含量。
固载上的酶蛋白量与载体量的比例可以由式Pa=(ρi-ρf)V/m 计算得出。
式中:Pa为每克载体上固载的酶蛋白的量,mg/g;ρi和ρf分别为反应前和反应后酶溶液的质量浓度,mg/mL;V为反应液体积,mL;m为使用的载体的质量,g。
1.5 脂肪酶活力的测定
脂肪酶活力的测定以橄榄油为底物,采用直接酸碱滴定法[17-18]。一个酶活力单位(U)定义为在温度为37℃的条件下,1 h从橄榄油中水解产生1 μmol脂肪酸所需的酶量。
2 结果与讨论
2.1 γ-Fe2O3-ATP的表征
2.1.1 透射电子显微镜(TEM)表征
图1为制备好的γ-Fe2O3-ATP用透射电子显微镜进行观察的结果。由图1可知:凹土呈棒状,γ-Fe2O3呈黑色球状,平均粒径为 10 nm,γ-Fe2O3粒子分布在凹土外表面上。这种分布原因可能是凹土表面存在一些负电荷和一些暴露出来的可交换的Al3+、Mg2+等阳离子,Fe3+通过静电作用和凹土的离子交换性质结合在凹土表面,经过醋酸熏蒸形成醋酸铁,煅烧后与凹土形成稳定的复合结构覆盖在其表面。

图1 γ-Fe2O3-ATP透射电镜照片Fig.1 TEM images of superparamagnetic γ-Fe2O3-attapulgite nanocomposites
2.1.2 N2等温吸附-脱附(BET)表征
γ-Fe2O3-ATP等温吸附-脱附曲线为 Langmuir IV型曲线(图2)。由图2可知:在相对压力达到0.5左右时,吸附等温线和脱附等温线开始不重合,出现了H3型的滞后环,说明载体中存在介孔。经测定γ-Fe2O3-ATP的平均孔径为10.862 nm与猪胰脂肪酶尺寸相似,使得脂肪酶很容易进入其孔道中。γ-Fe2O3-ATP有较高的比表面积为102.63 m2/g ,较 Zhao等[19]化学法合成的48.5 m2/g高,使得固载率提高。
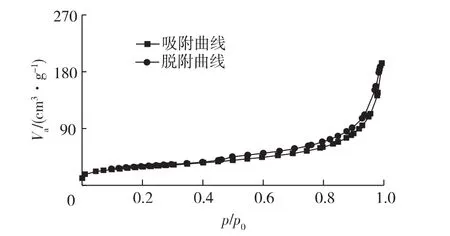
图2 γ-Fe2O3-ATP吸附-脱附等温曲线Fig.2 N2adsorption-desorption isotherms of superparamagnetic γ-Fe2O3-attapulgite nanocomposites
2.1.3 振动试样磁强计(VSM)表征
图3为γ-Fe2O3-ATP在室温下表现出超顺磁性特征结果。由图3可知:当外界有磁场时载体能够迅速被磁化且有较强磁性,当外界磁场消失时载体的磁性能够迅速随之消失。这种性质有利于载体从反应介质中分离,载体不会因磁化而团聚,有利于载体的重新分散。经测定,γ-Fe2O3-ATP的饱和磁化强度为8.915 emu/g,较 Bourlinos等[16]磁性蒙脱土1.75 emu/g高,能够迅速响应外界磁场,使得γ-Fe2O3-ATP在使用过程中易于在外界磁场的作用下分离,这一点对固定化酶的回收和重复利用极为重要。

图3 γ-Fe2O3-ATP磁滞回线Fig.3 Magnetic hysteresis loop of superparamagnetic γ-Fe2O3-attapulgite nanocomposites
2.2 脂肪酶固定化条件的研究
2.2.1 固定化时间的确定
图4是在pH 7.0的磷酸缓冲液中考察固载时间对固定化酶活的影响结果。由图4可知:在4 h之前酶活和固载率随着时间的延长而增大,当时间为4 h时酶活和固载率都达到最大。猪胰脂肪酶分子与γ-Fe2O3-ATP可能是通过范德华力、疏水作用相结合,在载体表面和孔道形成单分子层吸附,使得酶的活性中心能够充分暴露出来,表现出较大的酶活[20]。4 h之后,酶活和固载率随时间延长下降。可能一方面是脂肪酶与载体之间仅通过微弱的物理作用相结合,经过长时间摇床固载后,使其又回到溶液中去,导致酶活下降。另一方面可能是因为固载环境不是无菌的,固载后期酶液中有H2S的气味即是被细菌分解所致。
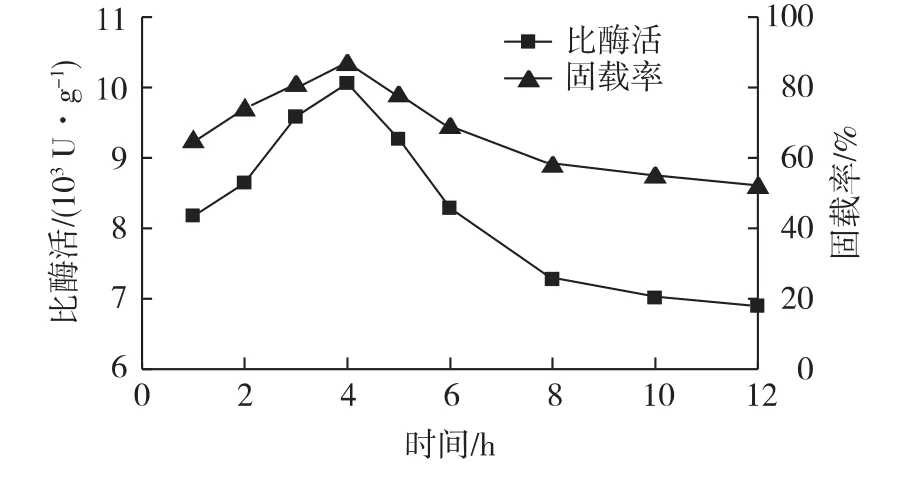
图4 时间对酶固定化的影响Fig.4 Effects of time on PPL immobilization on γ-Fe2O3-ATP
2.2.2 体系pH的确定
图5是在其他条件不变的情况下,考察体系pH对固定化酶活的影响结果。由图5可知:当pH为6.0时酶活和固载率最大,在pH值超过7.0后酶活和固载率急剧下降。这可能是因为蛋白质在溶液中有两性电离现象,当溶液pH值低于蛋白质等电点时,蛋白质带正电,反之蛋白质带负电。载体孔道内表面由于带有负电荷使其pH值比溶液中小[21]。PPL 的等电点为 5.0[22]。当溶液的 pH 在5.0~6.0之间时,由于载体孔道内表面的pH值比溶液小,所以孔道内的脂肪酶带正电荷并随着pH的增加而逐渐减少为零,酶分子之间的库伦力随之变弱,在载体的内表面形成较紧密的单层排列[23],在溶液pH为6.0时,可能是酶分子所带电荷为0,酶分子之间斥力为0,酶活和固载率最高。当pH在6.0~9.0之间时,可能是载体孔道pH大于酶分子等电点,酶分子带负电荷,脂肪酶和载体内表面都带负电荷而相互排斥,固载率下降,酶活变低[20]。
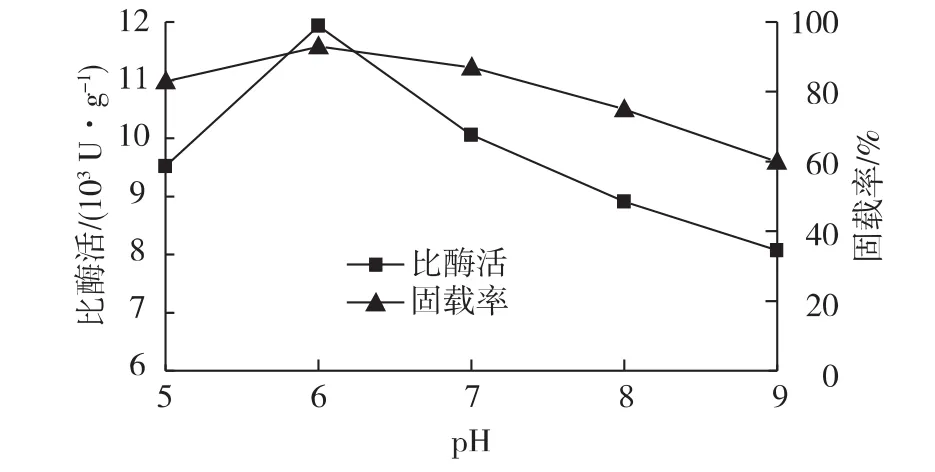
图5 pH对酶固定化的影响Fig.5 Effects of pH on PPL immobilization on γ-Fe2O3-ATP
2.3 固定化酶酶学性质的研究
2.3.1 固定化酶的热稳定性
图6是将制备好的固定化酶和游离酶放置60℃环境中考察高温对酶活的影响结果,并以各自未经热处理的初始酶活力为100%计。由图6可知:随着在60℃高温环境下时间的延长,固定化酶和游离酶的酶活都呈下降趋势,经过6 h高温保存后固定化酶保留初始酶活的52%,游离酶保留初始酶活的19%,固定化酶的剩余酶活高于游离酶,表明固定化酶有更好的热稳定性。推测原因可能是部分脂肪酶进入材料的介孔中使得其在高温中空间构象得到孔道的束缚,酶活力得以保留。

图6 高温对固定化酶和游离酶的影响Fig.6 Effects of temperature on stability of immobilized lipase
2.3.2 固定化酶的重复利用性
在pH 7.0、温度37℃的条件下,考察固定化酶的重复利用效果,结果见图7。由图7可知:随着使用次数的增加酶活有所下降,在重复使用5次后比酶活仍达6000 U/g。原因一方面可能是利用了载体的磁性特点回收固定化酶避免了其他方法回收过程中的损失,另一方面可能是固定化酶机械强度较游离酶高,使其稳定性提高。酶活有所下降可能是酶分子与γ-Fe2O3-ATP仅通过微弱的疏水作用和范德华力结合的,经过多次分离洗涤,酶分子很容易脱落,造成酶活部分损失,但每次能回收完全且方便,所以就固定酶自身而言,其重复利用性能很理想。
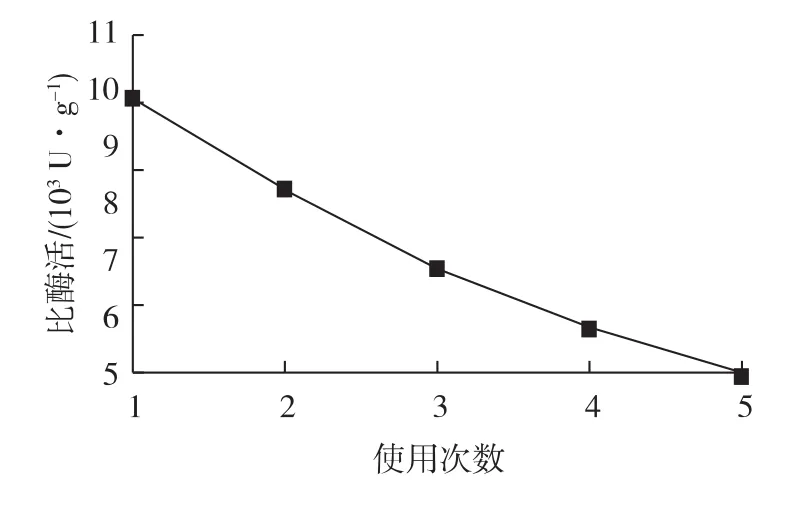
图7 使用次数对固定化酶的影响Fig.7 Reusability of immobilized lipase
3 结论
以自制γ-Fe2O3-ATP作为固定化猪胰脂肪酶的载体,其固定化最佳条件为固定化时间4 h及pH 6.0。制备的γ-Fe2O3-ATP比表面积为102.63 m2/g,发现能提高其固载率。其饱和磁化强度为8.915 emu/g,对外界磁场响应更灵敏,能更好地解决传质及回收再利用问题。由此表明γ-Fe2O3-ATP是固定化酶的良好载体。由于保留了凹土的骨架结构,γ-Fe2O3-ATP仍然具有凹土的性质,可通过改性派生出各类衍生物,具有较好的应用前景。
[1]Bornadel A,Hatti-Kaul R,Sörensen K,et al.Optimization of a two-step process comprisinglipase catalysis and thermal cyclization improves the efficiency of synthesis of six-membered cyclic carbonate from trimethylolpropane and dimethylcarbonate[J].Biotechnol Prog,2013,29(1):66-73.
[2]Panizza P,Syfantou N,Pastor F I J,et al.Acidiclipase Lip I.3 from a Pseudomonas fluorescens-like strain displays unusual properties and shows activity on secondary alcohols[J].J Appl Microbiol,2013,114(3):722-732.
[3]Vijayakumar K R,Gowda L R.Rice(Oryza sativa)lipase:molecular cloning,functional expression and substrate specificity[J].Protein Expr Purif,2013,88(1):67-79.
[4]Zhao D Y,Huo Q S,Feng J L,et al.Nonionic triblock and star diblock copolymer and oligomeric surfactant syntheses of highly ordered,hydrothermally stable,mesoporous silica structures[J].J Am Chem Soc,1998,120:6024-6036.
[5]Schmidt-Winkel P,Lukens W W,Zhao D Y,et al.Mesocellular siliceous foams with uniformly sized cells and windows[J].J Am Chem Soc,1999,121:254-255.
[6]Jie L,Jie F,Yu C Z,et al.Immobilization of enzymes in mesoporous materials:controlling the entrance to nanospace[J].Microporous Mesoporous Mater,2004,73(3):121-128.
[7]Kurita K,Yoshino H,Nishimura S,et al.Mercapto-chitins:a new type of supports for effective immobilization of acid phosphatase[J].Carbohydr Polym,1997,32:171-175.
[8]曹国民,王钒,宋国强,等.交联烯丙基葡聚精凝胶固定化脂肪酸的研究[J].离子交换与吸附,1997(5):515-518.
[9]姜泓海,邹汉法,汪海林,等.复合纤维素膜固定化胰蛋白酶反应器及其应用于蛋白质酶解[J].高等学校化学学报,2000,21(5):702-706.
[10]Seng B L,Cho I,Rhee J S,et al.Properties of penicillin amidohydrolase immobilized nylon fiber[J].Bull Korean Chem Soc,1980,l(1):10-17.
[11]Grasset L,Cordier D,Vllie A.Silk:a natural protein for enzyme immobilization[J].Process Biochem,1979,14(8):2-5.
[12]Toldra F,Jansen N B,Tsao G T.Use of porous glass fiber as a support for biocatalyst immobilization[J].Biotechnol Lett,1986,8(11):785-790.
[13]Malcata F X,Reyes H R,Gacia H S,et al.Kinetics and mechanisms of reactions catalysed by immobilized lipases[J].Enzyme Microb Technol,1992,14(6):426-446.
[14]Jia H,Zhu G,Wang P.Catalytic behaviors of enzymes attached to nanoparticles:the effect of particle mobility[J].Biotechnol Bioeng,2003,84(4):406-414.
[15]Daubresse C,Grandfils C,Jérome R,et al.Enzyme immobilization in reactive nanoparticals produced by inverse microemulsion polymerization[J].Colloid Polym Sci,1996,274:482-489.
[16]Bourlinos A B,Karakassides M A,Simopoulos A,et al.Synthesis and characterization of magnetically modified clay composites[J].Chem Mater,2000,12(9):2640-2645.
[17]中华人民共和国轻工业部食品工业司.QB/T 1803-1993 工业酶制剂通用试验方法[S].北京:北京轻工业出版社,1993.
[18]高贵,韩四平,王智,等.脂肪酶活力检测方法的比较[J].药物生物技术,2002,9(5):281-284.
[19]Zhao G H,Wang J Z,Li Y F,er al.Enzymes immobilized on superparamagnetic Fe3O4@Clays nanocomposites:preparation,characterization,and a new strategy for the regeneration of supports[J].J Phys Chem C,2011,115:6350-6359.
[20]Katiyar A,Ji L,Smirniotis P,et al.Protein adsorption on the mesoporous molecular sieve silicate SBA-15:effects of pH and pore size[J].J Chromatogr A,2005,1069(1):119-126.
[21]O'Reilly J P,Butts C P,IAnson I A,et al.Interfacial pH at an isolated silica-water surface[J].J Am Chem Soc,2005,127:1632-1633.
[22]Fan J,Yu C,Wang L,et al.Mesotunnels on the silica wall of ordered SBA-15 to generate three-dimensionallarge-pore mesoporous networks[J].J Am Cheml Soc,2001,123:12113-12114.
[23]Vinu A,Murugesan V,Tangermann O,et al.Adsorption of cytochrome c on mesoporous molecular sieves:influence of pH,pore diameter,and aluminum incorporation[J].Chem Mater,2004,16:3056-3065.

