一种新型亚酞菁荧光探针的合成、表征及动物活体成像研究
张泱泱,申剑冰,姚 成
(南京工业大学 理学院,南京210009)
一种新型亚酞菁荧光探针的合成、表征及动物活体成像研究
张泱泱,申剑冰,姚 成
(南京工业大学 理学院,南京210009)
以4-氨基邻苯二腈、无水ZnCl2、叶酸等为原料,经固相合成法制备了三取代氨基亚酞菁锌(NH2-Sub-Pc-Zn),进一步通过酰胺反应合成了叶酸修饰的三取代氨基亚酞菁锌(FA-Pc)。采用MTT方法评价了NH2-Sub-Pc-Zn、FA-Pc以及四取代氨基酞菁锌(NH2-Pc-Zn)对Hela细胞的毒性,毒性试验表明,加入2 mg/mL FA-Pc,Hela细胞的抑制率超过60%;同时研究了FA-Pc的活体成像特性,近红外荧光成像结果表明,FA-Pc定向聚集在裸鼠的肿瘤肝肾部位且可以稳定12 h。因此说明FA-Pc可用于活体肝癌的选择性成像。
癌细胞;叶酸;亚酞菁
酞菁及金属酞菁由于具有奇特的光电性能,多年来一直受到广泛研究,在电致发光、催化、生物分子探针等领域显示了很好的应用前景[1]。对高荧光三阶量子化产率[2]的酞菁配合物进行功能性修饰[3],可以使得酞菁配合物在生物近红外探针领域中成为明星分子。Chen等[4]以四氨基铝酞菁为红区荧光底物,构建了过氧化物酶和H2O2的荧光分析测定方法。Chen等[5]以四磺酸基铝酞菁为荧光探针,构建了血清蛋白、白蛋白及球蛋白荧光测定方法,并讨论了酞菁配合物与牛血清白蛋白的相互作用。吕丰等[6]设计合成了半乳糖酞菁近红外荧光探针,其设计的分子探针改善了酞菁的分子溶解性、生物相容性,并且可以靶向性地定位肿瘤细胞。黄剑东[7]利用Si的配位能力,合成了一种新型轴向酞菁硅配合物,该配合物用叶酸进行修饰,可以作为特异性选择宫颈癌细胞的近红外探针。但是由于这些酞菁类探针的相对分子质量过大,生物相容性不好,往往限制了其应用领域。
合成酞菁类配合物(酞菁配合物及亚酞菁配合物)产率较高的方法主要就是惰性溶剂法和催化剂法2种[8]。惰性溶剂法往往对工艺流程要求比较复杂[9-10]。而催化剂法在合成过程中的合成周期比较长,且后处理比较复杂[11]。如何高效简洁地在温和条件下合成出酞菁配合物,且在后处理中使用简单的分离技术就可得到高纯度酞菁配合物现已成为研究酞菁的方向。
为了解决这个问题,笔者优化一种新的合成和纯化亚酞菁的途径。利用固相法在加热的反应条件下合成三取代氨基亚酞菁锌(NH2-Sub-Pc-Zn),该方法成本较低且毒性小,提纯简单,得到的亚酞菁锌产率也较高(达到50%)。通过酰胺反应将叶酸基团连接上亚酞菁锌,得到三取代叶酸亚酞菁锌(FA-Pc),以期达到对亚酞菁锌进行功能性修饰的目的,为以后的发展奠定基础。
1 材料与方法
1.1 主要试剂及仪器
4-氨基邻苯二甲腈,试剂级,石家庄埃法化学科技有限公司;钼酸铵,试剂级,西陇化工股份有限公司;尿素,试剂级,西陇化工股份有限公司;叶酸(FA),试剂级,中国国药试剂;2-(7-偶氮苯并三氮唑)-N,N,N′,N′-四甲基脲六氟磷酸酯(HATU)、试剂级,N,N-二异丙基乙胺(DIPEA)、试剂级,北京百灵威科技有限公司;四取代氨基酞菁锌(NH2-Pc-Zn),实验室自制。
TU-1901型双光束紫外可见分光光度计,北京普析通用仪器有限公司;LS 50B型荧光分光光度计,Perkin公司;AV-500/AV-300型核磁共振波谱仪(1H NMR),德国Bruker公司;LCTIM型飞行时间质谱仪(TOF-MS),英国Micromass公司;MODEL7404型激光器,英国Intense公司;FX-Kodakinvivo型动物活体成像,伊士曼柯达医疗集团公司;MK3-Thermo Labsystems Multiskan Spectrum型酶标仪,美国Bio Tek公司。
1.2 实验方法
1.2.1 修饰亚酞菁的合成
合成路线见图1所示。
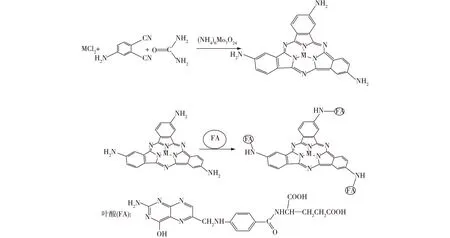
图1 合成路线Fig.1 Synthesis methods
1.2.2 合成方法
1)三取代氨基亚酞菁锌
4-氨基邻苯二腈2.14 g(15 mmol)、钼酸铵(0.05 g)、尿素(10 g)混合研磨均匀后放入坩埚中,用酒精灯加热直至完全熔融,加入无水ZnCl20.677 g(5 mmol),继续加热直至不再有深色固体析出。冷却后用100 mL、1 mol/L HCl煮洗1 h,过滤,水洗至中性,滤饼再用100 mL、1 mol/L NaOH煮洗0.5 h,过滤水洗至中性,滤饼用丙酮、二氯甲烷、水洗涤,真空干燥。称质量1.16 g,产率50%。1H NMR(500 MHz,二甲基亚砜):δ=7.61~7.63(m,3H,Ar-H),δ=7.77(s,3H,Ar-H),δ=8.27~8.35(q,6H,-NH2),δ=8.42(s,3H,Ar-H)表征谱图见图2、图3。TOF-MS:m/z=404.1[M—3NH2—Zn+Na+],表征谱图见图4。
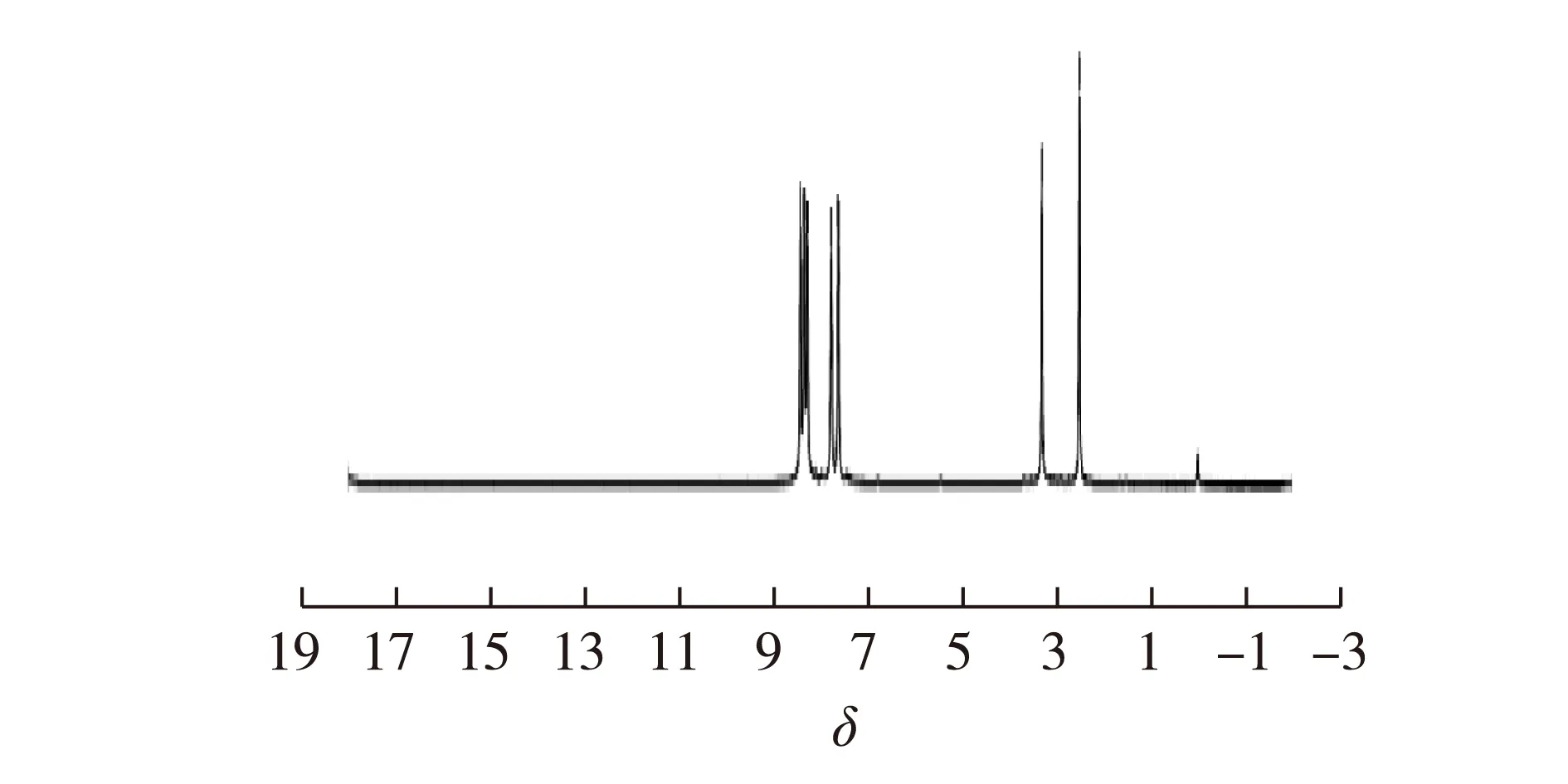
图2 三取代氨基亚酞菁锌1H NMRFig.2 1H NMR spectra of 3-amino- sub-phthalocyanine-Zn
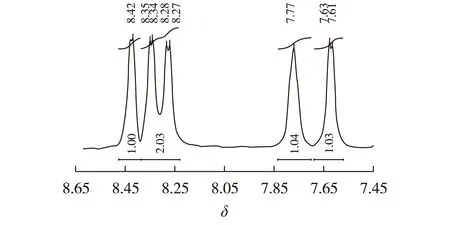
图3 三取代氨基亚酞菁锌放大1H NMRFig.3 1H NMR amplifying spectra of 3-amino- sub-phthalocyanine-Zn
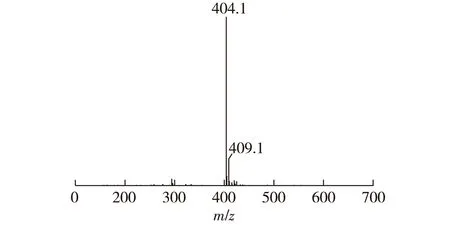
图4 三取代氨基亚酞菁 TOF-MSFig.4 TOF-MS spectrometry of 3-amino- sub-phthalocyanine-Zn
2)三取代叶酸亚酞菁锌
三口烧瓶中依次加入叶酸705 mg(1.5 mmol)、DIPEA(1 600 mg),再加入3 mL无水DMF,搅拌20 min;向混合物中加入三取代氨基亚酞菁锌128 mg(0.3 mmol)和HATU 600 mg,补加DMF 5 mL,N2气保护;室温反应17 h,避光;过滤,用水、二氯甲烷多次萃取,产物集中在水层,脱溶,真空干燥;称质量330 mg,产率60%。TOF-MS碎片离子峰:叶酸m/z=440.2[M+H+];2片缩合的1,3-二亚胺基异吲哚啉亚单元(C6H4)2C4N5H4,m/z=286.6[M+H+],表征谱图见图5。
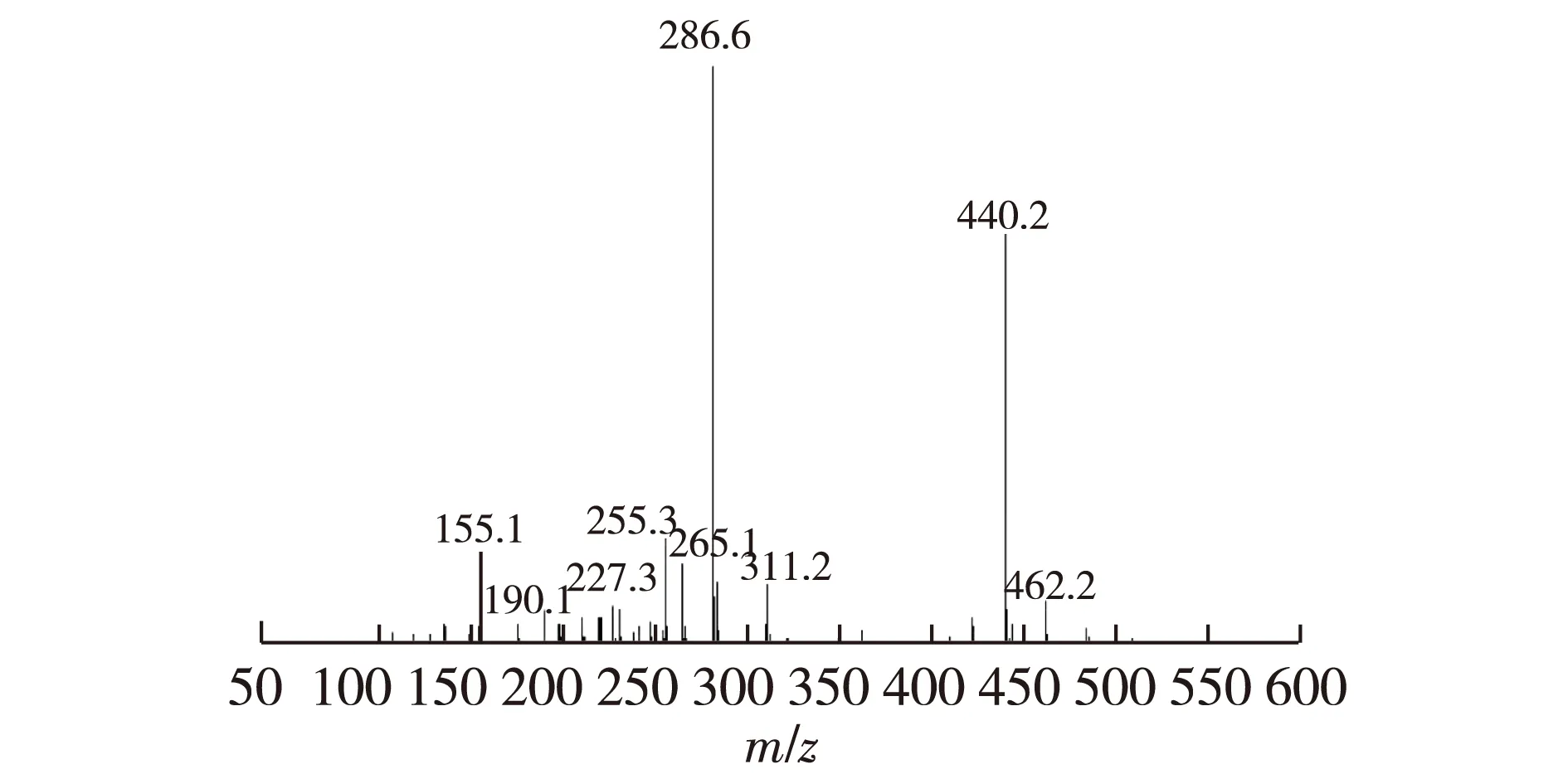
图5 三取代叶酸亚酞菁锌 TOF-MS Fig.5 TOF-MS spectrometry of folic acid modified sub-phthalocyanine
1.2.3 生物实验方法
1)MTT实验
称取50 mg MTT溶解于10 mL PBS中,配制成5 mg/mL MTT溶液。酞菁溶液的配制:用DMSO溶解NH2-Pc-Zn、NH2-Sub-Pc-Zn、FA-Pc。所用PBS配方如下:PBS(0.02 mol/L,pH 7.2~7.4)KH2PO40.2 g ;Na2HPO4·12H2O 2.9 g ;NaCl 8.0 g;KCl 0.2 g。
状态良好的Hela细胞(人宫颈癌细胞)接种于96孔培养板,每孔加入50 μL细胞悬浮液,贴壁培养生长24 h。向96孔培养板加入试样,第一排加入10 μL的PBS作为空白,第二排依次加入浓度不同的NH2-Pc-Zn、NH2-Sub-Pc-Zn、FA-Pc的溶液,培养24 h。培养终止后,小心吸弃孔内的培养液。每孔加入150 uL DMSO,振荡器振荡10 min,使结晶物充分溶解,待紫色结晶全部溶解后,用酶标仪测量吸光度。
2)FA-Pc活体成像实验
①肝癌肿瘤模型的建立 本实验小鼠为纯种昆明小鼠,无菌条件下将浓度为2.0×106L-1的H-22肝癌细胞液腹腔注射0.2 mL。培养2周后,无菌条件下,抽取含肝癌细胞的腹水2 mL,生理盐水稀释3倍,抽取上述稀释液0.2 mL,将其接种于不同分组BALB/c裸鼠的小鼠右前肢腋下部位,使其在肝肾部位形成直径约为1 cm的实体瘤。
②裸鼠活体分段成像 为了避免小鼠皮毛对实验荧光效果的影响,本实验小鼠为BALB/c裸鼠。以质量浓度0.9%生理盐水作为溶剂,配置0.2 mg/mL的三取代氨基亚酞菁锌、0.2 mg/mL三取代叶酸亚酞菁锌溶液,无菌条件下依次抽取上述溶液各0.2 mL,尾静脉注射。分别在1、6、12 h时间段采点观测效果,空白组作为对照。将实验组与空白组并排置于荧光成像系统中,选择625 nm为激发波长,进行图像采集,并对其进行处理。
2 结果与讨论
2.1 产物表征结果
2.1.1 三取代氨基亚酞菁锌紫外-可见吸收光谱
采用紫外-可见吸收光谱对一定浓度的三取代氨基亚酞菁锌进行分析,测量范围350~800 nm,所用试剂DMF为分析纯,测试结果见图6。

图6 三取代氨基亚酞菁锌紫外吸收光谱Fig.6 Ultraviolet absorption spectrum of 3-amino-sub-phthalocyanine-Zn
2.1.2 三取代氨基亚酞菁锌荧光光谱
图7为三取代氨基亚酞菁锌在DMF中的荧光激发光谱和发射光谱。由图7可知,三取代氨基亚酞菁锌激发波长为620 nm,最大发射波长为700 nm。
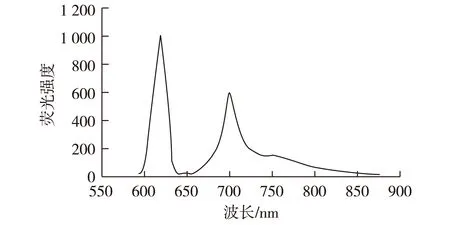
图7 三取代氨基亚酞菁锌荧光光谱Fig.7 Fluorescence spectrometry of 3-amino- sub-phthalocyanine-Zn
2.1.3 三取代叶酸亚酞菁锌的质谱
采用基质辅助激光解吸电离飞行时间质谱确定所合成的FA-Pc的裂解分子离子峰。由图2可知:2个主要的分子离子峰与理论值基本一致,叶酸裂解失去H+的离子峰(理论值为439.9);亚酞青裂解为2个合并的1,-3-二亚胺基异吲哚啉亚单元的离子峰(理论值为286.1),由此可以确定三取代叶酸亚酞菁锌的分子式为Zn(Ⅱ)[C6H3(CN)2(NH)]3[C19H16N7O3]3,谱图见图8。
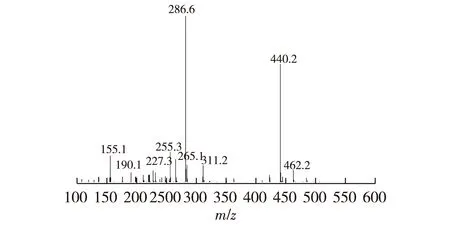
图8 叶酸修饰的亚酞菁锌的质谱Fig.8 Folic acid modified sub-phthalocyanine To F-MS mass spectrometry
2.2 MTT实验结果与讨论
实验分为对照组和实验室组,对照组中不加入酞菁配合物,由表1~表3可以看出:随着细胞浓度的增加,其吸光度是不断增加的,证明本文0.02 mol/L浓度的PBS溶液对所培养的Hela癌细胞无毒害作用,可用作实验溶剂。实验组将FA-Pc、NH2-Pc-Zn、NH2-Sub-Pc-Zn分别设为3个浓度组,即0.02、0.2和2 mg/mL。根据表1~表3中MTT的对照组和实验组吸光度计算它们对Hela细胞的抑制率,结果见图9。
由图9可以看出,在相同的浓度下FA-Pc相对于另外2个探针对Hela细胞的抑制率最大,且随着质量浓度的增大,抑制率呈增长趋势。NH2-Pc-Zn、NH2-Sub-Pc-Zn质量浓度增大到0.2 mg/mL时,它们的抑制率是保持增长趋势的。但是,当它们的质量浓度增大到2 mg/mL时,NH2-Sub-Pc-Zn抑制率下降,吕琳等[12]报道并测定了酞菁配合物的二聚常数,发现当其浓度增大,单体会快速聚集形成二聚体,从而减低了其对Hela癌细胞的抑制作用;而NH2-Pc-Zn的抑制率只有微量的提高。以上结果表明,FA-Pc可以随着质量浓度的增大至2 mg/mL时仍无聚集效应,在溶液中以单体形式存在,能够有效抑制癌细胞的生长,且在2 mg/mL时对Hela细胞的抑制率超过了半数,具有良好的抑制效果。
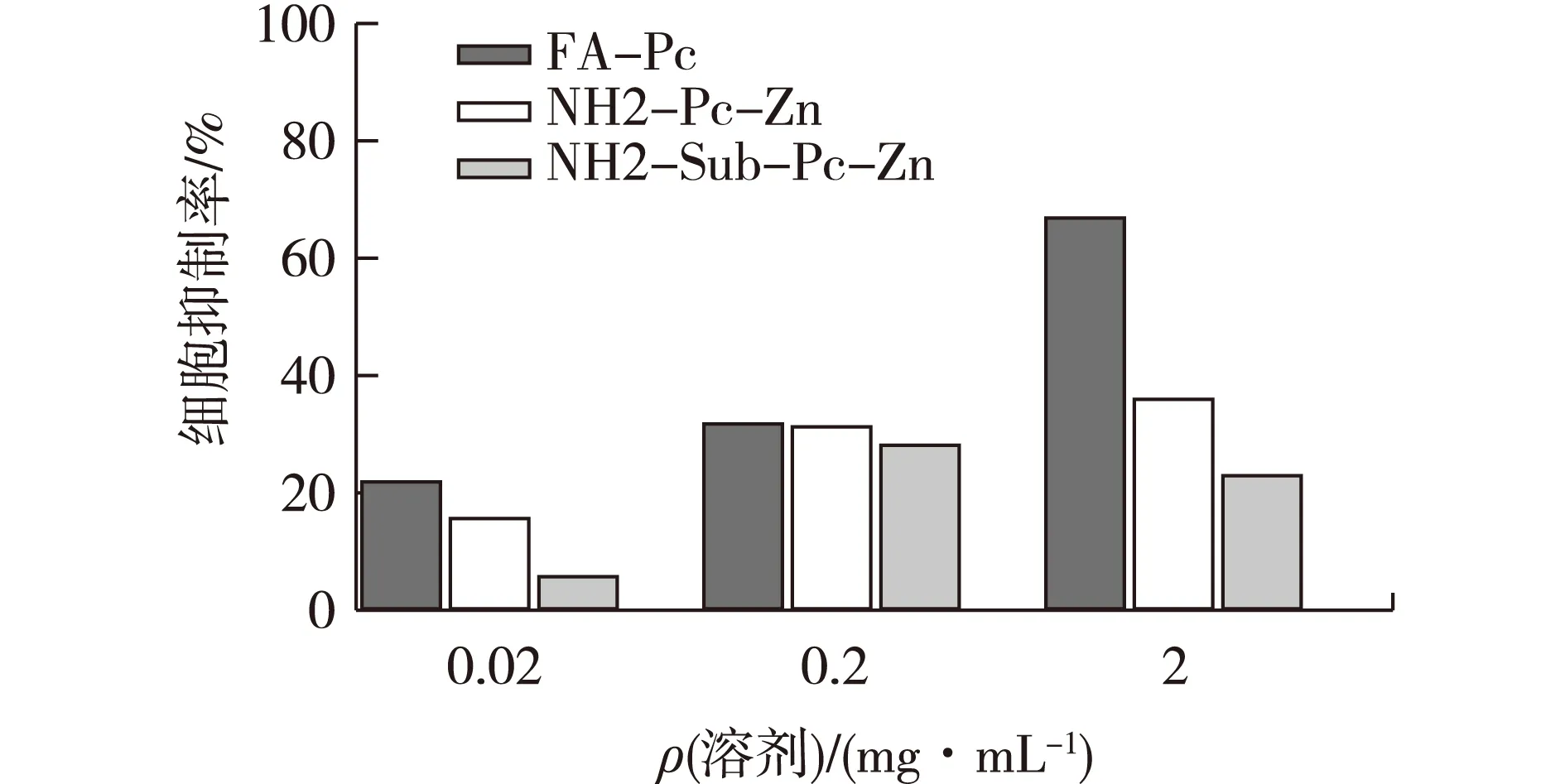
图9 MTT实验结果Fig.9 Experimental results of MTT in figure
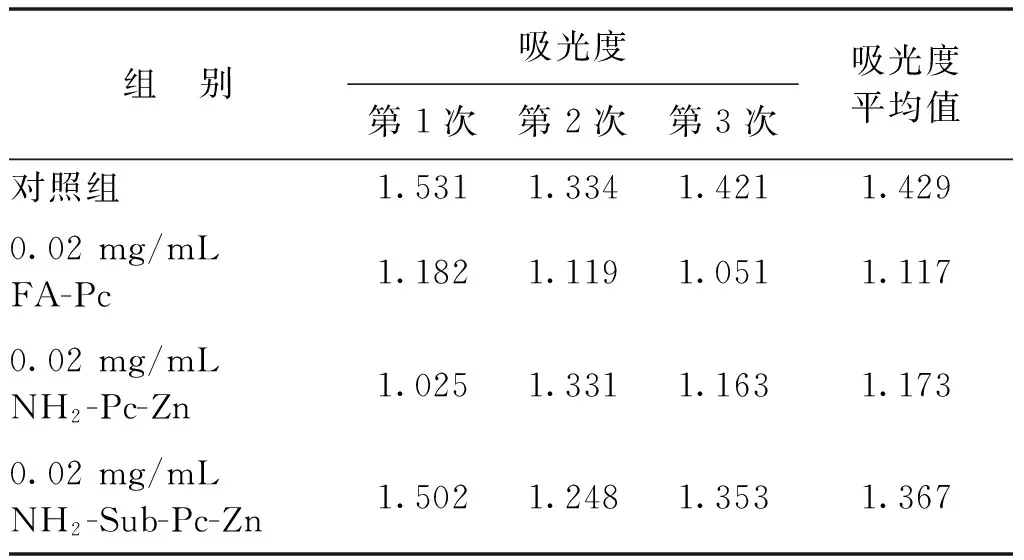
组 别吸光度第1次第2次第3次吸光度平均值对照组1.5311.3341.4211.4290.02mg/mLFA-Pc1.1821.1191.0511.1170.02mg/mLNH2-Pc-Zn1.0251.3311.1631.1730.02mg/mLNH2-Sub-Pc-Zn1.5021.2481.3531.367
注:细胞接板数目为5 000个/孔。
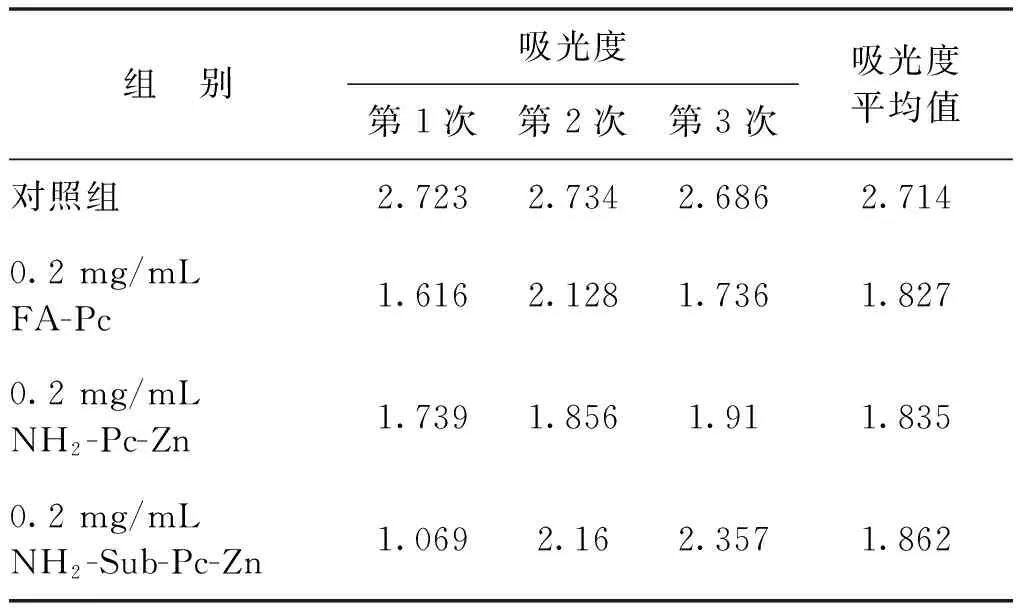
表2 B组MTT实验吸光度数据Table 2 MTT assay absorbance data of Group B
注:细胞接板数目为10 000个/孔。
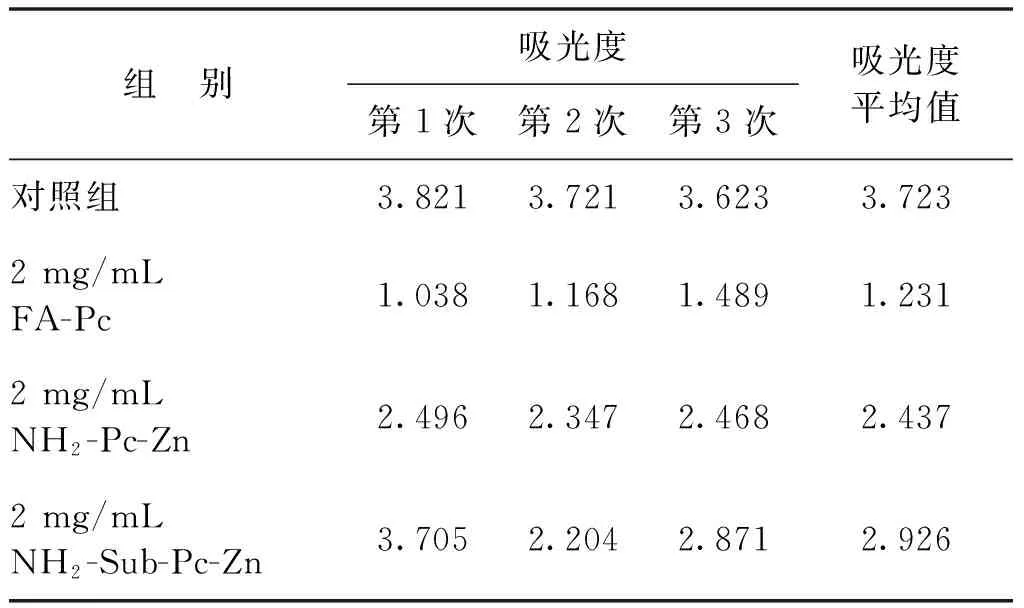
表3 C组MTT实验吸光度数据Table 3 MTT assay absorbance data of Group C
注:细胞接板数目为15 000个/孔。
2.3 FA-Pc活体成像实验
2.3.1 FA-Pc定位原理
图10为合成的探针可定位肿瘤细胞原理,叶酸定位叶酸受体的主要官能基团是叶酸分子中的蝶酸部分,它含有1个羧基,可以特异性的选择叶酸受体,并与其结合。合成探针选择酰胺反应的催化剂时,需保持定位羧基的低活性,让叶酸的另一个位于с位的羧基参与酰胺反应,与氨基亚酞菁键合生成目标探针分子。
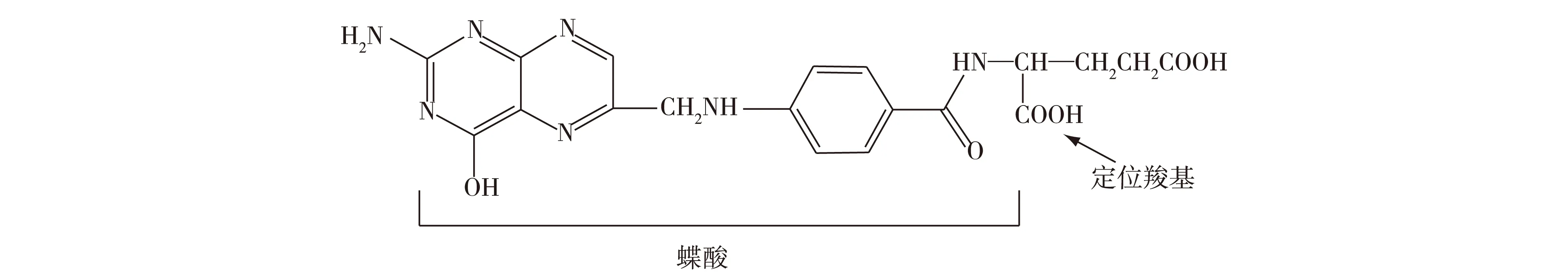
图10 叶酸亚酞菁探针原理Fig.10 Principle diagram of folic acid sub-phthalocyanine probe
2.3.2 裸鼠活体预成像结果
将实验组(注射0.2 mg/mL FA-Pc探针的裸鼠)与对照组(空白注射裸鼠)并排置于荧光呈像系统中,分别对实验组和对照组进行白光采集,再对实验组和对照组在不同激发波长下的荧光成像图片进行自动分析和叠加,形成预成像结果图,如图11所示,通过在裸鼠体内的预成像实验,初步测定了叶酸亚酞菁锌作为近红外探针的体内成像效果。通过1 h后对实验组图像的采集和叠加,发现在裸鼠的肝肾部位有明显荧光,证明FA-Pc主要于裸鼠的肝肾部位聚集。

图11 裸鼠活体预成像结果Fig.11 Nude mice in vivo pre-imaging results
2.3.3 裸鼠活体分段成像结果
在图12中,B组为注射NH2-Sub-Pc-Zn组,A组为注射FA-Pc组。通过分段时间观察裸鼠的肝癌肿瘤模型发现,A组相对B组具有明显的靶向性。观察发现1 h后,NH2-Sub-Pc-Zn发生全身性的扩散,主要集中在裸鼠的膀胱部位,证明在1 h内NH2-Sub-Pc-Zn已经开始被裸鼠代谢掉,这是因为其分子中没有靶向性叶酸基团,而FA-Pc中的叶酸分子却起到了很好的导向作用,能将亚酞菁定位在肿瘤部位。
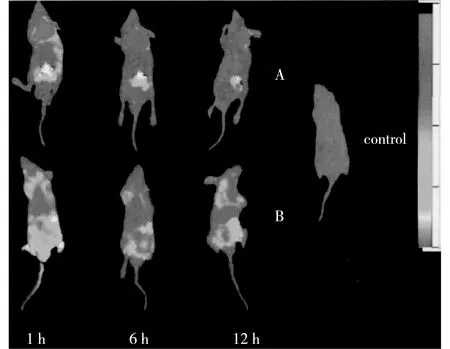
图12 FA-Pc活体分段成像Fig.12 Subparagraph FA-Pc in vivo imaging
6 h后,NH2-Sub-Pc-Zn组膀胱部位的荧光强度减弱,证明NH2-Sub-Pc-Zn在裸鼠体内的代谢速率较快。FA-Pc实验组裸鼠肿瘤部位的荧光强度有微弱减少,证明FA-Pc在裸鼠体内的代谢速率适中。
12 h后,NH2-Sub-Pc-Zn在裸鼠体内的荧光基本消失,证明NH2-Sub-Pc-Zn在进入裸鼠体内后是被裸鼠不断代谢掉的,没有靶向性。FA-Pc在12 h后肿瘤部位仍有较弱的荧光,证明12 h后FA-Pc仍有对肝癌细胞的靶向功能。
3 结 论
利用三取代氨基亚酞菁锌为原料合成了一种新型的三取代叶酸亚酞菁锌探针;同时利用合成的三取代叶酸亚酞菁锌探针进行了细胞毒性实验,实验结果表明其具备一定的癌细胞抑制效果,当质量浓度达到2 mg/mL的时候,抑制率超过了半数;研究还发现合成的三取代叶酸亚酞菁锌探针具有较好的肿瘤定位效果,荧光强度随着其在裸鼠体内被不断代谢掉而不断减弱,同时通过裸鼠活体分段成像发现荧光持续时间相对较长,可达到10 h以上,可以在短时间内作为检测肿瘤细胞的荧光探针以观测肿瘤大小和肿瘤位置的变化,具有一定的应用前景。
[1] 王俊东,黄金陵,陈耐生.取代酞菁配合物的结构研究进展[J].结构化学,2004,9:1035-1043.
[2] 邱文丰,刘云圻,朱道本.不对称酞菁化合物的合成及研究进展[J].功能材料,2000,S1:123-130.
[3] Fischer M,López-Duarte I,Wienk M.Functionalized dendritic oligo thiophenes:ruthenium phthalocyanine complexes and their application in bulk heterojunction solar cells[J].J Am Chem Soc,2009,131:8669-8676.
[4] Chen X L,Li D H,Yang H H,et al.Study of tetra-substituted amino aluminum phthalocyanine as a new red-region substrate for the fluorometric determination of peroxidase and hydrogen peroxide[J].Anal Chim Acta,2001,434:51.
[5] Chen X L,Li D H,Xu J G.Studies on tetra-substituted amino aluminum phthalocyanine as a new red-region substrate for mimetic peroxidase[J].Chem J Chin Univ,2001,22:1120.
[6] 吕丰,刘天君.用于肿瘤成像的半乳糖/酞菁近红外荧光探针[J].高等学校化学学报,2011,32:1010-1012.
[7] 黄剑东.叶酸修饰额酞菁硅及其制备方法和应用:中国,102643280A[P].2012-08-22.
[8] 沈永嘉.酞菁的合成与应用[M].北京:化学工业出版社,2000.
[9] Robertson J M.An X-ray study of the structure of the phthalocyanines:the metal-free,nickel,copper and platinum complexes[J].Chem Soc,1935,615-621.
[10] Torres T.From sub-phthalocyanines to sub-porphyrins[J].Angew Chem Int Ed,2006,45:2834-2837.
[11] Cristian A,Myriam E R,Lelia E D.Synthetic approach towards novel octa-substituted zinc phthalocyanines with different solubility and photophysical properties[J].J Porphyrins Phthalocyanines,2005,9:361-367.
[12] 吕琳,吴星,袁诗海.磺化酞菁镓、钒、铝、锌在水、醇、胶束中的聚合行为的研究[J].光谱学与光谱分析,1999,19(5):224-226.
(责任编辑 周晓薇)
Synthesis,characterization and animal whole-body fluorescence imagingapplication of a new sub-phthalocyanine fluorescent probe
ZHANG Yangyang,SHEN Jianbin,YAO Cheng
(College of Sciences,Nanjing Tech University,Nanjing 210009,China)
Zine amino-sub-phthalocyanine(NH2-Snb-Pc-Zn) was prepared by solid-state reaction of 4-aminophthalonitrile,anhydrous zinc chloride,folic acid,amidation of the carboxyl.Folic acid(FA) modified Pc (FA-Pc) complexes were obtained by MTT method to evaluate the toxicity to Hela cells with NH2-Sub-Pc-Zn,FA-Pc and four substituted amino-zinc-phthalocyanine(NH2-Pc-Zn).Toxicity test results showed that 2 mg/mL of FA-Pc led to the inhibition rate of Hela cells of more than 60%.The FA-Pc in vivo imaging characteristics were studied,near-infrared fluorescence imaging results showed that FA-Pc gathered directional in nude mice’ s tumor hepatorenal areas was stable for 12 h.FA-Pc could be used for whole-body fluorescence imaging.
cancer cells;folic acid;sub-phthalocyanine
10.3969/j.issn.1672-3678.2014.02.014
2013-05-24
江苏省高校研究生科研创新计划(2012CXZZ12-0444);南京工业大学材料化学工程国家重点实验室开放课题(2009KL09-9)
张泱泱(1986—),男,安徽芜湖人,硕士,研究方向:新型探针分子设计与合成;姚 成(联系人),教授,E-mail:yaocheng@njtech.edu.cn
Q279
A
1672-3678(2014)02-0070-07

