离子液体修饰的SBA-16材料在猪胰脂肪酶固定化中的应用
邹 彬,初旭明,张 洋,胡 燚
(南京工业大学生物与制药工程学院,南京211800)
离子液体修饰的SBA-16材料在猪胰脂肪酶固定化中的应用
邹 彬,初旭明,张 洋,胡 燚
(南京工业大学生物与制药工程学院,南京211800)
合成了功能化的甲基咪唑类离子液体,并将功能化离子液体修饰介孔材料 SBA-16。以三乙酸甘油酯的水解为探针反应,考察离子液体修饰的 SBA-16 固定化猪胰脂肪酶(PPL) 的酶活、最适反应条件及重复稳定性等酶学性质。结果表明:固定化酶对温度的敏感度降低,酶活力及稳定性均显著提高,比酶活是原粉 SBA-16 固定化酶的1.75 倍,重复使用6次后仍然保持最初活性的57%;与原粉 SBA-16 固定化酶保留的38%相比,有明显的提高。同时通过N2吸附-脱附、红外光谱和热重等方法分析了离子液体修饰对 SBA-16 结构的影响,结果发现,离子液体修饰后材料保持了原有的介孔结构,修饰后载体表面性质和结构性质导致了PPL酶学性质的变化。
固定化;离子液体;介孔材料;脂肪酶;修饰
固定化酶由于具有容易分离、能够循环使用及稳定性高等优点,在食品及医药工业领域内得到了广泛的应用。通常,固定化酶的催化性能取决于固定化方法和固定化载体[1-4]。酶的固定化方法主要分为吸附、共价、包埋及交联等4大类。其中,吸附法是利用静电作用、氢键、疏水相互作用和范德华力作用使酶与水不溶性大分子载体结合的一种方法。吸附法的显著优势在于操作简便、条件温和、不易破坏酶分子的三维结构而影响活性中心的构象;但是该方法的缺点在于酶与载体之间的结合不牢固,在使用过程中酶容易从载体中溢出[5-6]。因此,固定化酶载体材料的选择与表面修饰至关重要[7-9]。无机介孔材料SBA-16不仅具有固定化载体所需要具备的机械强度高、化学稳定性好、易于再生及表面易修饰等优点,而且还具有允许大分子进入的孔径(2~50 nm)、高的比表面积(1 000 m2/g)、大的吸附容量及三维孔道立体交叉利于物料传输等特性。修饰后的载体材料SBA-16独特的表面性质可直接影响其与酶分子之间的相互作用,从而影响酶的固定化效率以及其体相孔道的变化,改变酶所处微环境及酶蛋白构象,从而影响酶的催化活性及稳定性。通过选择合适的修饰剂对介孔材料进行表面改性从而提高固定化酶的酶学性质已成为近年来的研究热点[10-12]。
作为一种可以设计的绿色溶剂,离子液体(IL)已经被广泛地应用于生物催化领域,且脂肪酶在离子液体中往往表现出较高的活性及稳定性[13-14]。
笔者拟合成咪唑类离子液体并将其作为酶载体SBA-16的表面修饰剂,将离子液体修饰的载体ILSBA-16对猪胰脂肪酶进行固定化,并考察相关的条件及固定化酶的相关性质,以期解决传统固定化介质固定化酶的缺点。
1 材料与方法
1.1 药品与试剂
猪胰脂肪酶(PPL),购自Sigma公司并在0~4 ℃下保存,酶的蛋白质含量为9.3%,而其最佳比酶活为362 U/g(45 ℃、pH 7.5);1-甲基咪唑(纯度为99%)、(3-氯丙基)三甲氧基硅烷(纯度为98%),购自阿拉丁试剂公司;甲苯、四氟硼酸钠(分析纯),购自国药试剂公司。
1.2 实验仪器
试样的 N2吸附-脱附曲线在ASAP 2020型自动吸附仪(Micromeritics公司)上测定。实验前于80 ℃ 脱气12 h,在液氮温度下进行实验。利用670 型傅里叶变换红外光谱(FT-IR) 仪(Thermo Nicolet公司)分别对修饰前后的载体进行分析。扫描范围400~4 000 cm-1, KBr压片。采用TGA7型热重仪(PerkinElmer公司)测定载体上负载的离子液体含量,加热范围为50~700 ℃,升温速率5 ℃/min, 在20 mL/min N2流中进行。
1.3 介孔SBA-16材料的制备与修饰
按文献[15]方法合成较大孔径介孔材料SBA-16。按文献[16]方法通过两步合成法合成甲基咪唑类四氟硼酸盐离子液体。取 2 g SBA-16 分散在 60 mL甲苯中,加入甲基咪唑类四氟硼酸盐离子液体(10 mmol),N2保护下,于 95 ℃ 反应 26 h,过滤,用乙醇、乙醚洗涤,经过24 h二氯甲烷索氏提取后,烘干,得到功能化离子液体修饰的SBA-16,记为ILSBA-16[16]。
1.4 脂肪酶的固定化
取50 mL Tris-HCl 缓冲液(pH 7.0) 置于 100 mL 锥形瓶中,加入 0.2 g PPL,振荡直至完全溶解,再加入0.6 g 载体(SBA-16 或者 ILSBA-16),加塞密封并将其置于摇床中,在 30 ℃、150 r/min 下振荡 3 h之后,将混合物于 5 000 r/min离心10 min,用磷酸缓冲液洗涤沉淀数次,抽滤,固体置于真空冷冻干燥机中干燥 6 h,得到固定化酶。
1.5 蛋白负载量的测定
按照Bradford的方法,以牛血清蛋白作为标准蛋白质绘制标准曲线,测定固定化后残液的吸光值,根据标准曲线计算蛋白浓度。根据式(1)计算固定化效率(IY)。
固定化效率=(ρi-ρf)/ρi× 100%
(1)
式中:ρi表示溶液中固定化前酶蛋白的初始质量浓度(mg/mL);ρf表示固定化后酶蛋白的最终质量浓度(mg/mL)[17]。
1.6 酶活的测定
取10 mL三乙酸甘油酯乳化液(6.83%)于 100 mL锥形瓶中,再加入15 mL磷酸盐缓冲液,于50 ℃ 预热5 min,然后向其中加入0.25 g固定化酶在50 ℃、150 r/min条件下反应10 min,取出。立即加入10 mL体积的乙醇终止反应。使用NaOH溶液(0.05 mol/L) 滴定,记录NaOH的消耗量。在一定条件下,每分钟酶催化三乙酸甘油酯生成1 μmol 乙酸所需要的酶量,定义为一个酶活单位(U)。比酶活(U/g)=固定化PPL的表观酶活/1 g固定化酶中PPL的含量[18]。
1.7 最适温度及最适pH
调节反应液缓冲液pH为7.0,分别在35、40、45、50和55 ℃下水浴反应10 min,取出测定酶活。在各自的最优化温度进行反应,调节反应液的pH分别为 6.0、6.5、7.0、7.5和8.0于水浴反应10 min,取出测定酶活。
1.8 重复使用性
取0.25 g 固定化酶测定酶活,在各自最优化条件反应10 min后,取出,抽滤、洗涤,分离所得固定化酶冷冻干燥6 h,用于下一次反应,反复循环使用6次。滤液加入10 mL乙醇,然后用NaOH溶液(0.05 mol/L)滴定测定酶活。设定初始酶活为100%。
1.9 动力学参数的测定
根据经典的米氏方程分别讨论游离酶在固定化前后的最大反应速率Km及米氏常数Vmax2个动力学参数的变化情况。选用双倒数法求取上述参数,即根据不同底物质量浓度6、10、16、24和27.2 mg/mL,在最优化条件下测定游离酶和固定化酶的催化活力,反应时间为3 min。
2 结果与讨论
2.1 介孔材料SBA-16修饰及固定化酶前后的表征
2.1.1 N2吸附-脱附测试
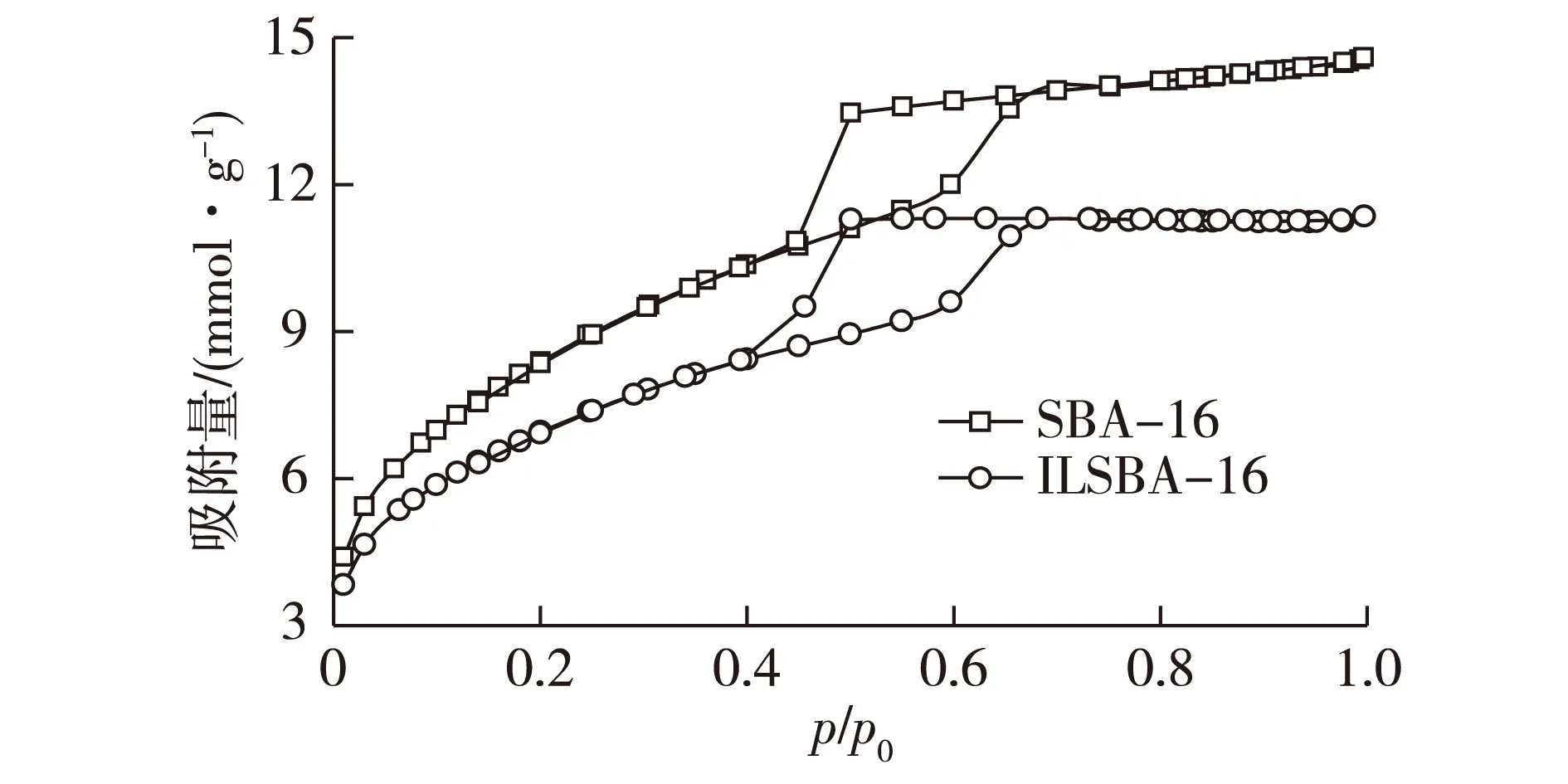
图1 载体SBA-16修饰前后的N2吸附-脱附曲线Fig.1 Nitrogen adsorption-desorption isotherms of SBA-16 and ILSBA-16
采用比表面和孔径吸附测定仪,在液氮温度下测定离子液体修饰前后载体的等温N2吸附-脱附曲线,结果见图1。由图1可知:吸附等温线的吸附曲线由于发生毛细凝聚现象而逐渐上升,而脱附曲线在较低的压力下突然下降,造成吸附等温线和脱附等温线不完全重合,这符合介孔材料载体的特性,也说明离子液体修饰后没有改变其孔道特性[19]。
通过BET(Brunauer-Emmett-Teller)模型计算载体在离子液体修饰及固定化前后的比表面积,BJH(Barrett-Joyner-Halenda)模型计算载体在固定化前后的孔径等结构参数,由表1可知:经离子液体修饰后,载体的比表面积、孔体积及孔径均有所降低;结合热重分析结果初步表明,离子液体已修饰到载体 SBA-16表面。
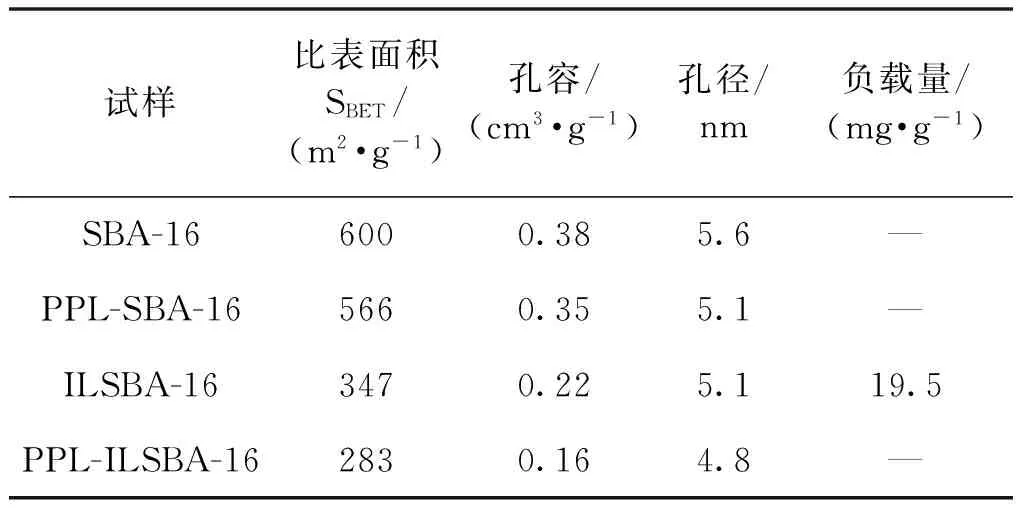
表1 载体或固定化酶孔径、孔容和比表面积测试结果Table 1 Pore structure parameters of carriers
注:所有试样都在80 ℃脱气12 h后再测试。
2.1.2 FT-IR红外图谱
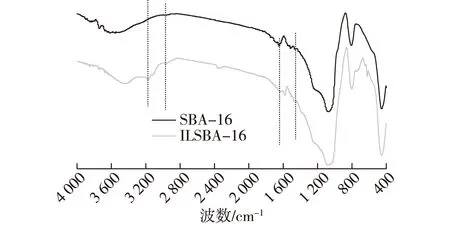
图2 载体SBA-16修饰前后的FT-IR图谱Fig.2 FT-IR spectra of mesoporous materials SBA-16 and ILSBA-16
图2为载体以及固定化酶的FT-IR光谱图。由图2可知:1 080、780和470 cm-1处的这些明显的峰是介孔材料中Si—O—Si骨架结构的特征峰[20]。表明经过修饰,介孔材料的骨架结构依然存在,离子液体修饰和酶的固定化并没有改变骨架结构。经离子液体修饰后载体在2 953 cm-1处出峰可归属为烷基链上C—H 键的伸缩振动峰;离子液体修饰后的介孔材料具有的峰位:1 653 cm-1处的吸收峰可归属为咪唑环N—H键的伸缩振动,进一步说明烷基功能化离子液体已成功修饰到 SBA-16上。
2.1.3 热重TG曲线测定离子液体修饰量
图3是离子液体ILSBA-16载体负载量的热重曲线的分析结果。由图3可知:试样ILSBA-16在250 ℃开始热裂解,600 ℃分解完毕,根据质量变化,可以推算出离子液体负载量为19.5 mg/g修饰载体。
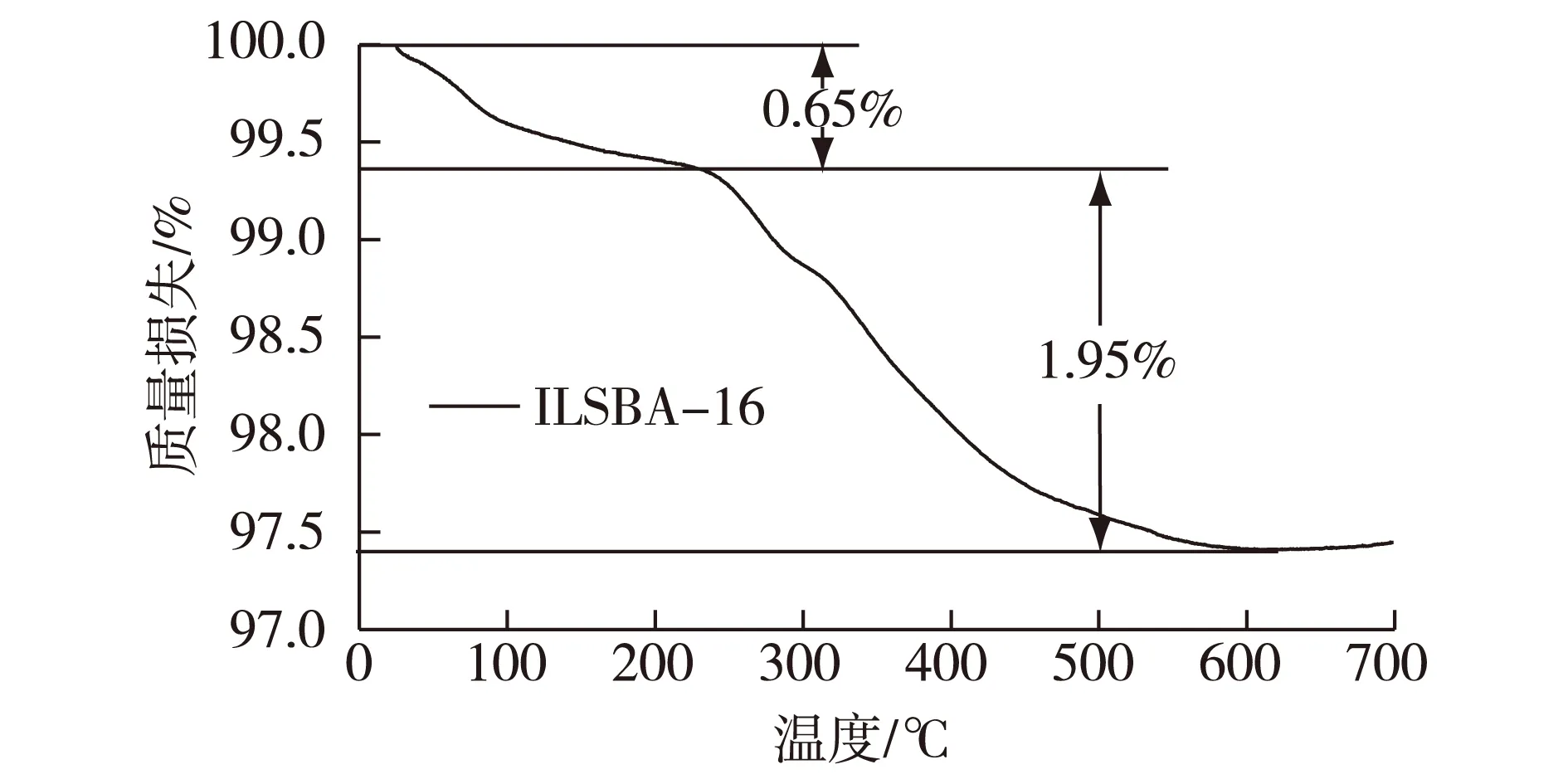
图3 ILSBA-16载体的热重曲线Fig.3 Thermal analysis of ILSBA-16 to assay loading of ionic liquid.
2.2 脂肪酶的固定化时间优化
考察固定化时间对离子液体修饰前后载体对酶负载量的影响,结果见图4。由图4可知:酶的负载量随固定化时间延长而增加。在3 h达到最大负载量,而后保持相对稳定的状态。这说明在3 h后,载体对脂肪酶处于吸附平衡的状态。
2.3 固定化酶的固定化效率及酶活
采用甲基咪唑离子液体修饰的SBA-16材料对
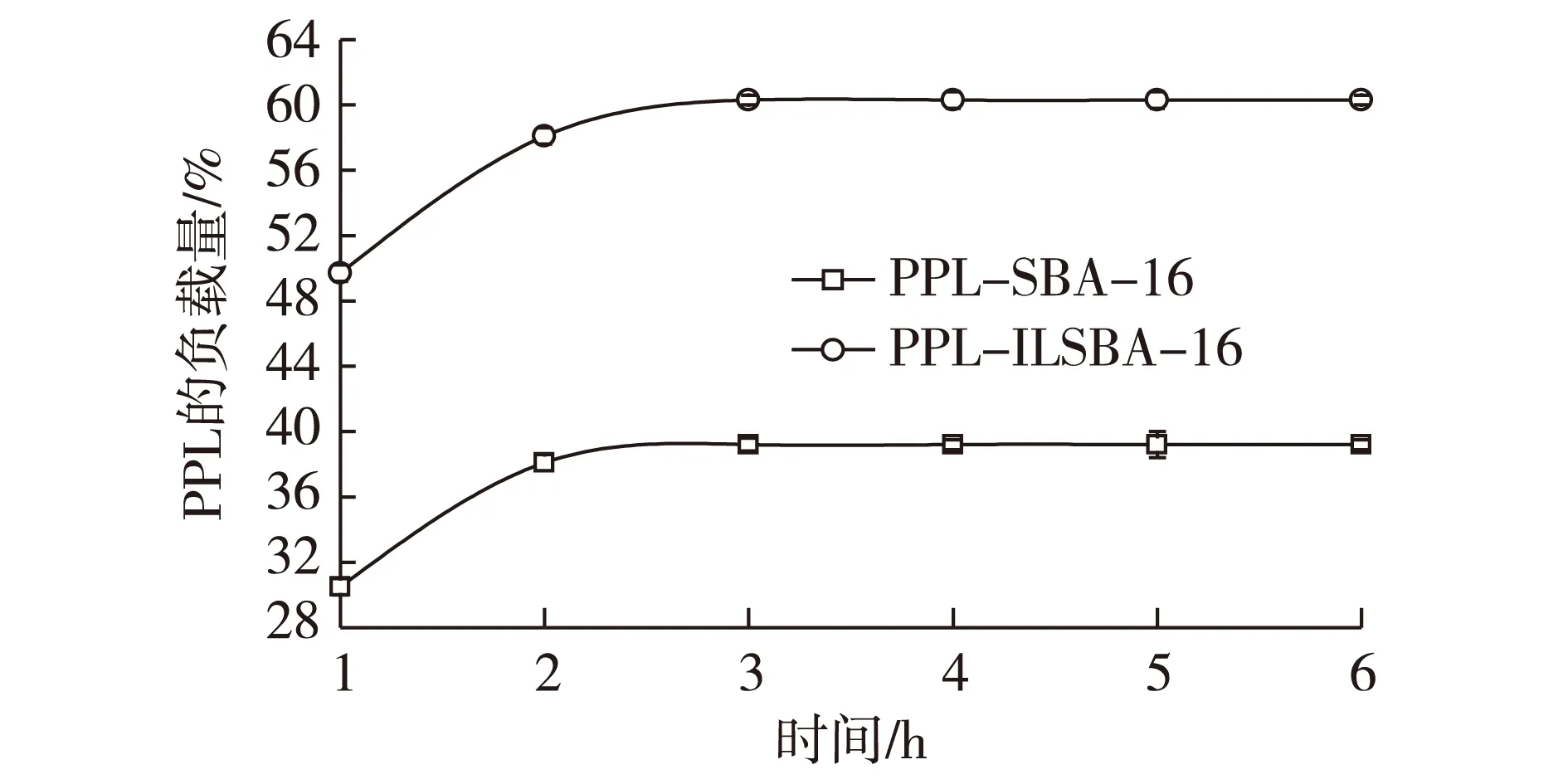
图4 固定化时间对固定化酶负载量的影响Fig.4 Effects of immobilization time on loading of PPL
PPL进行固定化,表2显示了PPL-SBA-16及PPL-ILSBA-16固定化效率及酶活。由表2可知:离子液体修饰的SBA-16对PPL 的负载量较高,固定化效率达60.3%。原粉载体上 PPL 的负载量降低明显,为39.2%。这可能与载体经过修饰后,载体表面的疏水性增强,从而有利于载体吸附更多的酶分子有关。另外,修饰载体的固定化酶的酶活显著提高,在各自的最优化条件下反应,PPL-ILSBA-16的相对活力为PPL-SBA-16的1.75 倍。酶活提升很可能因为2个原因:①离子液体引入SBA-16表面后,提高了载体表面与酶之间的作用力,猪胰脂肪酶受到孔道内各种微环境作用力的影响,更多的活性位被打开;②SBA-16表面上的亲/疏水基团有利于底物的吸附传递,加快了底物的传质速度。
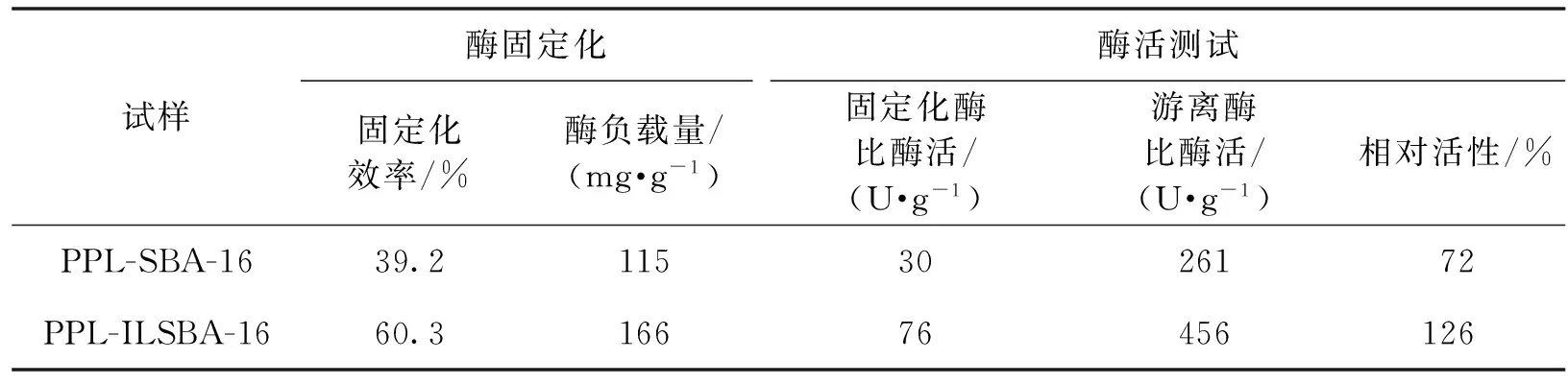
表2 固定化酶的负载量和活力Table 2 Results of immobilization process of PPL
注:固定化条件是在30 ℃、pH 7.0 Tris-HCl缓冲液中固定 3 h;反应条件是在最适反应温度和pH条件下进行反 应;游离酶比酶活为362 U/g,被定义为相对活性100%。
2.4 固定化酶最优温度和pH
2.4.1 固定化酶最优温度的变化
根据经典酸碱滴定的方法,在不同温度下考察PPL水解三乙酸甘油酯特性,结果见图5。由图5可知:游离猪胰脂肪酶和固定化酶催化反应速率随温度的变化均呈先上升后下降的“钟型”曲线,最适反应温度游离酶为45 ℃左右,而修饰载体固定化酶为50 ℃,相对较高。并且游离酶对温度变化比较敏感,这可能是由于酶经固定化后,在固定化载体孔道形成了一个良好的微环境,与溶液体系温度存在温度差,因而温度的耐受性有所提高,蛋白质结构变化减小。经过表面修饰后的载体固定化酶(PPL-ILSBA-16)对温度耐受性曲线相对未修饰的载体固定化酶(PPL-SBA)在高温区域更加趋于平缓,该点证明材料的表面离子液体修饰有助于改善酶的最佳反应温度。
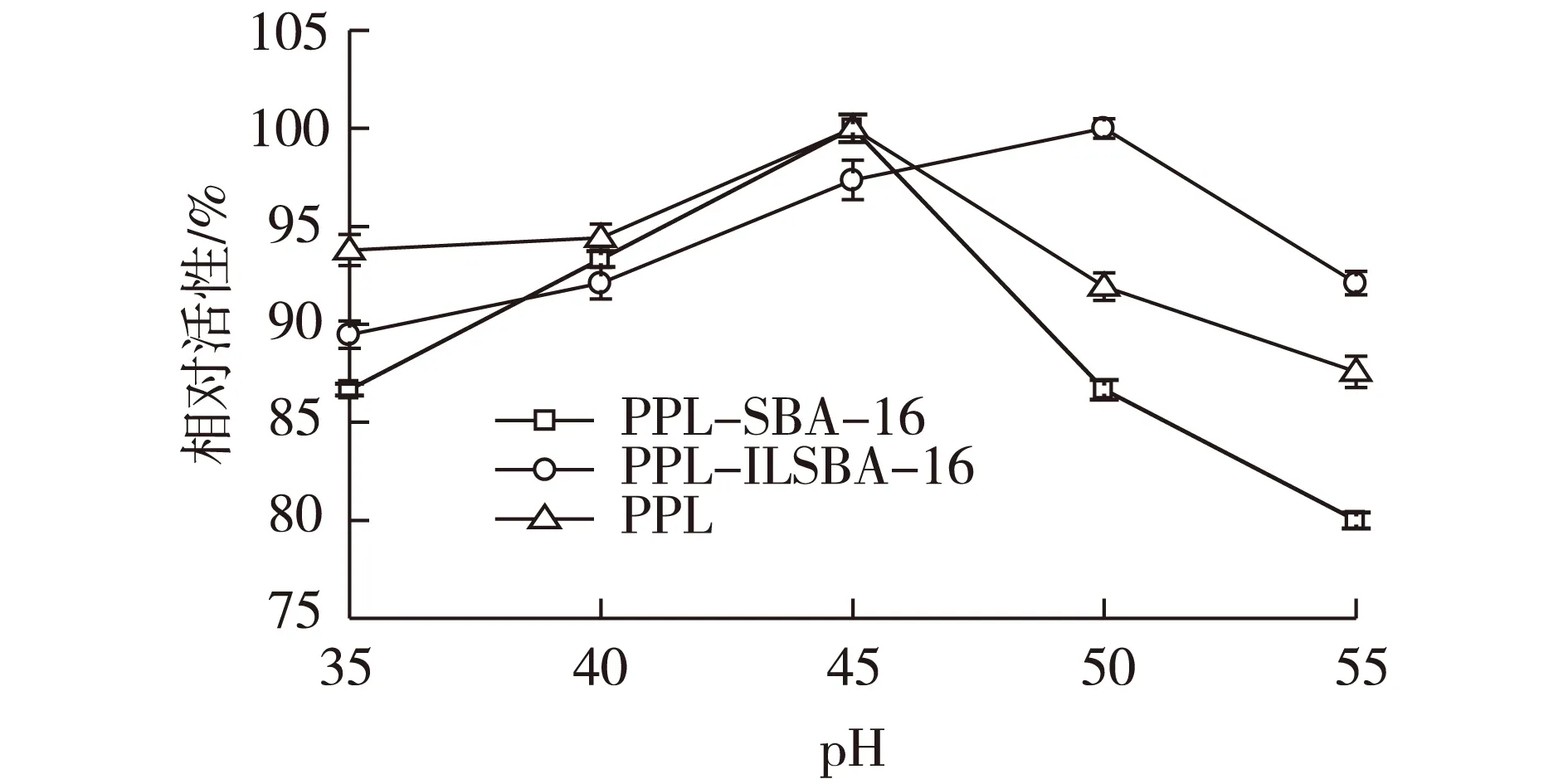
图5 反应温度对酶活的影响Fig.5 Effects of temperature on the activity
2.4.2 固定化酶的最优pH变化
酶在溶液中会发生解离作用,酶的解离状态和行为都会受到体系中pH的影响,因而体系中pH变化会对酶转化的效果产生很大的影响。根据酸碱滴定的方法,在不同pH条件下考察猪胰脂肪酶的三乙酸甘油酯水解特性,结果见图6。由图6可知:固定化酶PPL-ILSBA-16及PPL-SBA-16的最适反应pH均为7.0左右,并且酶活在7.0~8.0之间变化较小,游离酶最佳pH为7.5,酶活对低方向pH的变化更为敏感。
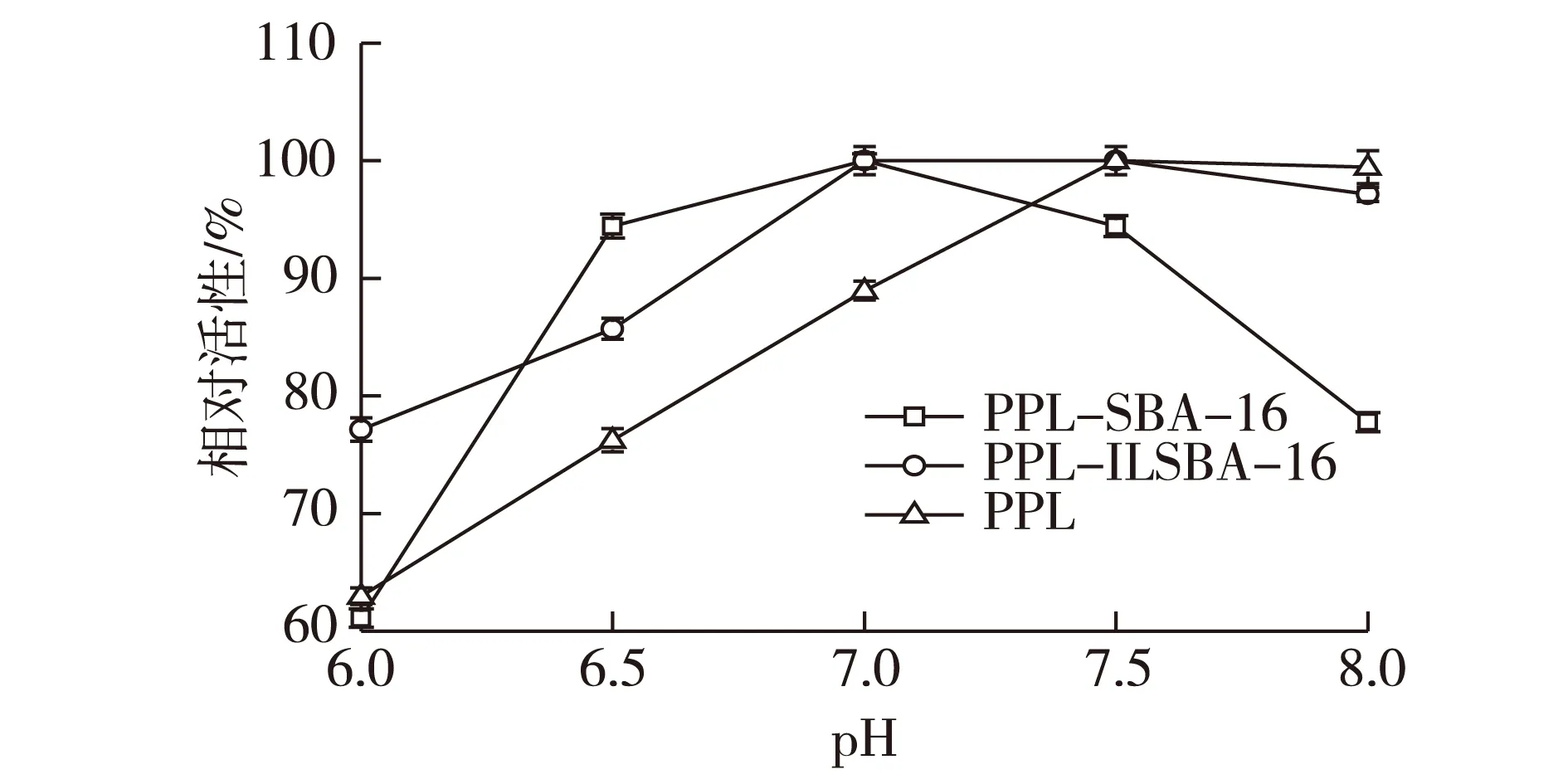
图6 反应pH对酶活的影响Fig.6 Effects of pH on the activity
2.5 脂肪酶重复稳定性的测试
PPL-SBA-16和PPL-ILSBA-16重复使用性结果见图7。由图7可知:随着脂肪酶不断重复使用,固定化酶的酶活均明显下降。其中PPL-SBA-16 第一次重复使用后固定化酶活力降低的幅度最大,分别为73%和79%;重复使用 4 次后,活性损失趋于稳定,其相对活力为初始活力的45%和61%;且每一次重复使用时,PPL-ILSBA-16相对活力均大于PPL-SBA-16。由此可见,离子液体修饰后的载体固定化酶PPL-ILSBA-16的重复使用性能明显提高。这可能由于离子液体引入到SBA-16载体表面后,增强了酶与载体之间的相互作用力,从而降低了酶从载体孔道的溢出量。
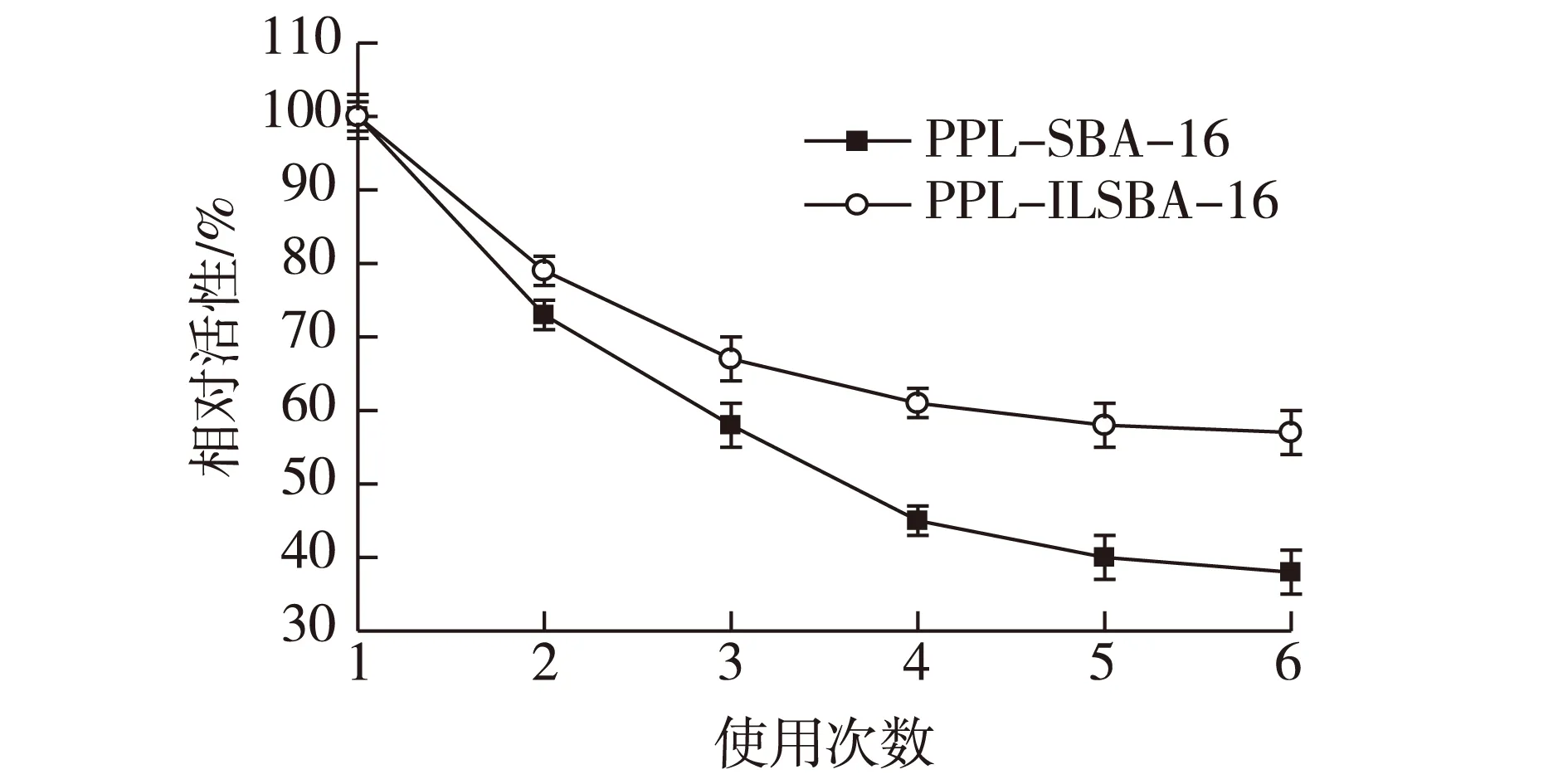
图7 重复使用次数Fig.7 Variation in activity with repeated use
2.6 脂肪酶动力学常数
选用双倒数法求取游离酶及固定化酶的Km及Vmax2个动力学参数,在不同底物浓度下,测定游离酶和固定化酶的催化活力,分别对底物浓度和酶活力求倒数,如图8所示。
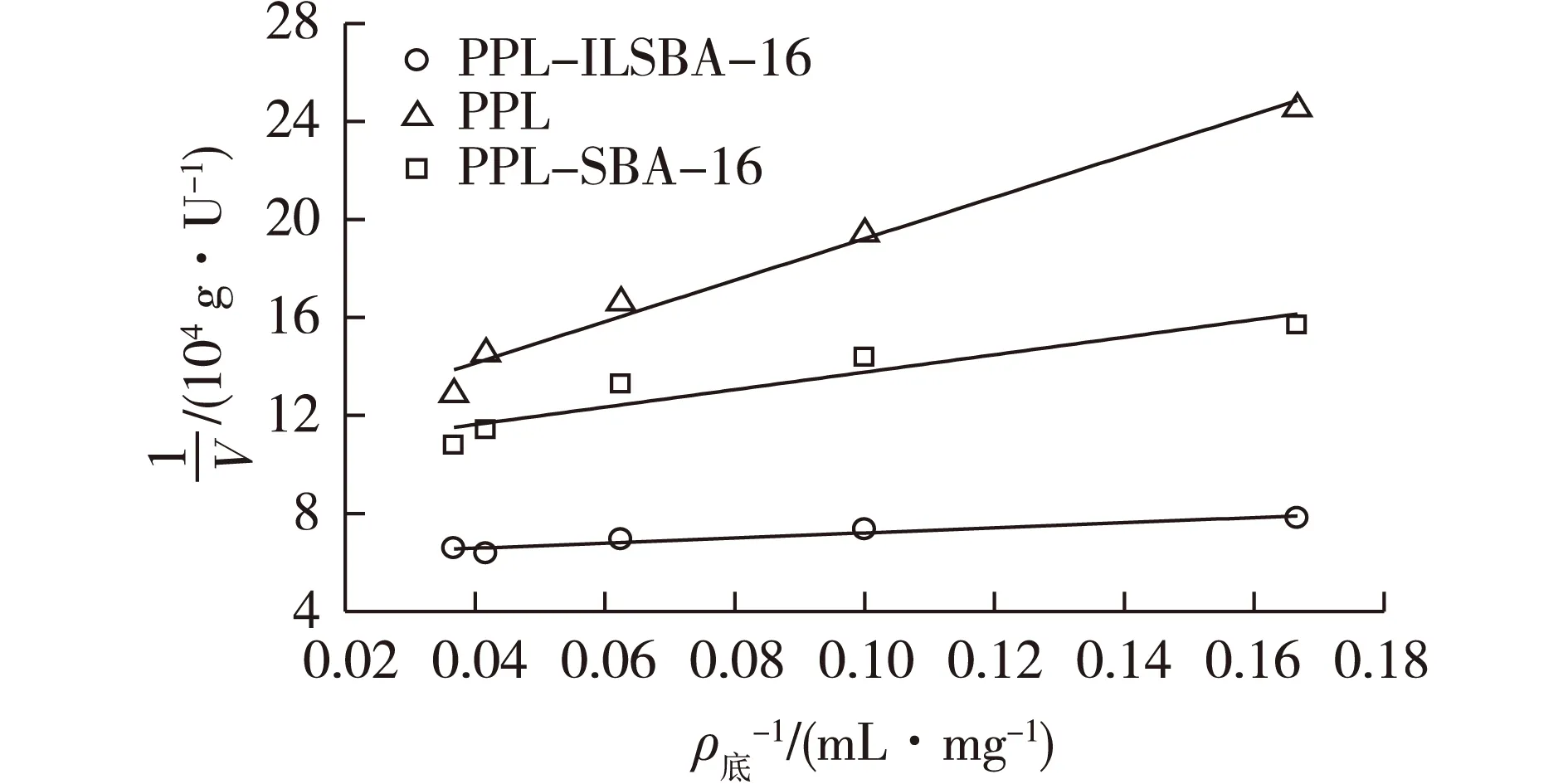
图8 动力学参数曲线Fig.8 Kinetics curves of immobilized and free PPL
由图8可知:游离酶PPL和固定化酶PPL-SBA-16及PPL-ILSBA-16的Km及Vmax可以根据米氏方程推算出。Km等于酶促反应速度为最大反应速度一半时的底物浓度,当Km值越大,表明酶和底物之间的亲和能力越弱[21]。表3为游离酶和固定化酶的动力学参数。由表3可知:固定化酶的Km相对游离PPL降低,表明经过固定化过程后,PPL对底物的亲和力变大。主要原因可能是离子液体修饰载体表面有助于PPL活性中心盖子被打开,使反应物更容易进入PPL的活性中心。结合实验测得的最大比活力可以证明上述观点,PPL-ILSBA-16的Vmax达到了PPL的1.83倍。

表3 游离酶和固定化酶的动力学参数Table 3 Kinetics Km and Vmax of immobilized and free PPL
3 结 论
采用功能化离子液体对载体SBA-16进行修饰,并将其应用于PPL脂肪酶的固定化。实验证明,离子液体修饰后的SBA-16载体固定化 PPL 的比活力显著提高,为原粉SBA-16固定化酶的1.75 倍;PPL-ILSBA-16对温度变化、较低pH的敏感度降低,重复使用性大幅度提高。经过动力学常数测定表明,离子液体修饰的SBA-16固定化酶对底物的亲和力明显增强,脂肪酶活性构象被激活,催化效果大大提升。
[1] Mendes A A,Oliveira P C,de Castro H F.Properties and biotechnological applications of porcine pancreatic lipase[J].J Mol Catal B Enzymatic,2012,78(1):119-134.
[2] Liu X,Lei L,Li Y,et al.Preparation of carriers based on magnetic nanoparticles grafted polymer and immobilization for lipase[J].Biochem Eng J,2011,56(3):142-149.
[3] Gustafsson H,Thörn C,Holmberg K.A comparison of lipase and trypsin encapsulated in mesoporous materials with varying pore sizes and pH conditions[J].Colloids Surf B Biointerfaces,2011,87(2):464-471.
[4] Chau C M,Liu K J,Lin C H.Enzymatic synthesis of sialic acid derivative by immobilized lipase fromCandidaantarctica[J].Bioresour Technol,2011,102(21):10136-10138.
[5] Bornscheuer U T.Immobilizing enzymes:how to create more suitable biocatalysts[J].Angew Chem Int Ed,2003,42(29):3336-3337.
[6] Lu S,He J,Guo X.Architecture and performance of mesoporous silica-lipase hybrids via non-covalent interfacial adsorption[J].AIChE J,2010,56(2):506-514.
[7] Quirós M,García A B,Montes-Morán M A.Influence of the support surface properties on the protein loading and activity of lipase/mesoporous carbon biocatalysts[J].Carbon,2010,49(2):406-415.
[8] Laszlo J A,Jackson M,Blanco R M.Active-site titration analysis of surface influences on immobilizedCandidaantarcticalipase B activity[J].J Mol Catal B Enzymatic,2011,69(1/2):60-65.
[9] Li Y,Gao F,Wei W,et al. Pore size of macroporous polystyrene microspheres affects lipase immobilization[J].J Mol Catal B Enzymatic,2010,66(1):182-189.
[10] Soerensen M H,Ng J B S,Bergstroem L,et al. Improved enzymatic activity ofThermomyceslanuginosuslipase immobilized in a hydrophobic particulate mesoporous carrier[J].J Colloid Interface Sci,2010,343(1):359-365.
[11] Serra E,Diez E,Diaz I,et al.A comparative study of periodic mesoporous organosilica and different hydrophobic mesoporous silicas for lipase immobilization[J].Microporous Mesoporous Mater,2010,132(3):487-493.
[12] Mitchell S,Pérez-Ramírez J.Mesoporous zeolites as enzyme carriers:synthesis characterization and application in biocatalysis[J]. Catal Today,2011,168(1):28-37.
[13] Moniruzzaman M,Kamiya N,Goto M.Activation and stabilization of enzymes in ionic liquids[J]. Org Biomol Chem,2010,8(13):2887-2899.
[14] Kaar J L,Jesionowski A M,Berberich J A,et al. Impact of ionic liquid physical properties on lipase activity and stability[J].J Am Chem Soc,2003,125(14):4125-4131.
[15] Aburto J,Ayala M,Bustos-Jaimes I,et al.Stability and catalytic properties of chloroperoxidase immobilized on SBA-16 mesoporous materials[J].Microporous Mesoporous Mater,2005,83(1/2/3):193-200.
[16] Lou L,Peng X,Yu K,et al.Asymmetric hydrogenation of acetophenone catalyzed by chiral Ru complex in mesoporous material supported ionic liquid[J].Catal Commun,2008,9(9):1891-1893.
[17] Bradford M.A rapid and sensitive method for the detection of microgram quantities of proteins[J].Anal Biochem,1976,72:248-254.
[18] Zou B,Hu Y,Yu D,et al.Immobilization of porcine pancreatic lipase onto ionic liquid modified mesoporous silica SBA-15[J].Biochem Eng J,2010,53(1):150-153.
[19] Abdullah A Z,Sulaiman N S,Kamaruddin A H. Biocatalytic esterification of citronellol with lauric acid by immobilized lipase on aminopropyl-grafted mesoporous SBA-15[J].Biochem Eng J,2009,44(2/3):263-270.
[20] He J,Xu Y,Ma H, et al.Inhibiting the leaching of lipase from mesoporous supports by polymerization of grafted vinyl groups[J].Microporous Mesoporous Mat,2006,94(1/2/3):29-33.
[21] Bai Y X,Li Y F,Yang Y,et al. Covalent immobilization of triacylglycerol lipase onto functionalized novel mesoporous silica supports[J].J Biotechnol,2006,125(4):574-582.
(责任编辑 荀志金)
Immobilization of porcine pancreatic lipase on ionic liquidmodified mesoporous silica SBA-16
ZOU Bin,CHU Xuming,ZHANG Yang,HU Yi
(College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
Ionic liquid was synthesized and grafted on the surface hydroxyl of mesoporous silica SBA-16(ILSBA-16).Porcine pancreatic lipase(PPL) was immobilization on the ionic liquid modified SBA-16 material by physical adsorption(PPL-ILSBA-16).The enzymatic properties,including optimum temperature,pH and reusability of PPL-ILSBA-16,were investigated in the triacetin hydrolysis reaction.Compared with parent SBA-16 immobilized lipase(PPL-SBA-16),the enzymatic properties were dramatically improved,especially the optimized activity increased from 261 to 456 U/g PPL after modification.Characterizations with N2adsorption,FT-IR and TG revealed that introduction of IL influenced the catalytic behaviors significantly by changing structure and surface properties of the carriers.
immobilization;ionic liquid;mesoporous material;lipase;modification
10.3969/j.issn.1672-3678.2014.02.002
2012-11-13
国家重点基础研究发展计划(973计划)(2011CB710800);国家高技术研究发展计划(863计划)(2011AA02A209);国家自然科学基金青年基金(20906049);国家自然科学基金重点项目(20936002);南京工业大学自然科学基金;南京工业大学材料化学工程国家重点实验室开放课题(KL10-13)
邹 彬(1986—),男,湖北荆州人,博士,讲师,研究方向:生物催化;胡 燚(联系人),副教授,E-mail:huyi@njtech.edu.cn
O643.32
A
1672-3678(2014)02-0006-06

