甲基磺酸乙酯诱变选育竹红菌甲素高产菌株
杨珠英,潘魏松,聂 云,罗 晗,王剑文
(苏州大学医学部药学院,苏州215123)
甲基磺酸乙酯诱变选育竹红菌甲素高产菌株
杨珠英,潘魏松,聂 云,罗 晗,王剑文
(苏州大学医学部药学院,苏州215123)
以从短穗竹(Brachystachyumdensiflorum)茎秆中分离获得的竹黄菌(Shiraiasp.S8)菌株为出发菌株,以0.5%~2.5%甲基磺酸乙酯(EMS)处理竹黄菌悬浮孢子10~30 min,结合平板初筛和高效液相色谱(HPLC)分析进行复筛。经诱变筛选得到高产菌株10-5,发现其竹红菌甲素产量达到26.8 mg/L,与原始出发菌株相比提高了46.4%,且遗传稳定性良好,具有较高的医药及工业应用价值。
甲基磺酸乙酯;竹红菌素;选育;竹黄菌
竹红菌素(hypocrellin)属于苝醌类化合物,包括竹红菌甲素(hypocrellin A,简称HA)、乙素、丙素和丁素4种化合物,竹红菌甲素是其中的主要成分,是目前已知的可用于可见光区的优良光敏剂。竹红菌甲素、乙素具有杀伤肿瘤细胞、抗病毒、抑制微血管病变等功能,并对HIV-1型病毒有抑制作用[1]。竹红菌甲素主要来源于野生竹黄菌,但野生竹黄菌采收期短、产量低、地域分布不平衡,使得竹红菌甲素目前尚未实现大规模生产,其应用也受到了很大限制。高产菌株的筛选有利于实现竹红菌素的规模化生产,从而大大加快竹红菌素及竹黄相关药品、产品的开发,同时也有利于对野生竹黄的资源保护。
甲基磺酸乙酯(EMS)是一种常用的化学诱变剂,可用于处理甘蓝型油菜获得高油酸材料[2],以及诱变筛选马铃薯茎段离体耐盐变异体[3]和诱变选育低产蛋白酶A啤酒酵母[4]等。目前,针对竹黄菌的菌株选育尚少见报道,笔者所在实验室通过采用紫外与亚硝基胍基因改组,提高了该菌的产量[5]。笔者利用分离得到的竹红菌甲素产生菌——竹黄无性型菌株ShiraiabambusicolaS8为出发菌株,使用EMS对竹黄菌的孢子进行化学诱变,选育出高产竹红菌甲素的变异菌株,以期为利用竹黄菌进行发酵生产提供菌种基础,也为竹红菌素的生物技术开发提供生产资源和参考。
1 材料与方法
1.1 实验材料
出发菌株:分离自南京紫金山麓短穗竹Brachystachyumdensiflorum(Rendle)茎秆的竹黄无性型菌株(Shiraiasp. S8),由中国微生物菌种保藏管理委员会普通微生物中心保藏,编号为CGMCC No.3984。
菌体生长固体培养基:PDA固体平板。
生孢培养基(g/L):葡萄糖10,酵母膏2.5,KCl 1.8,NaAc 8.2,琼脂15。
液体发酵培养基(g/L):土豆20,葡萄糖2,KH2PO40.3,MgSO40.15,VB10.001,酵母膏0.5。
甲基磺酸乙酯(EMS)购自美国Sigma公司。
1.2 主要仪器
SW-CJ-1FD型超净工作台,苏州净化设备有限公司;MLS-3780高压蒸气灭菌锅,日本三洋公司;Agilent液相系统,美国Agilent公司;Allegra 64R型冷冻离心机,美国Beckman公司;CKX41型倒置显微镜,日本Olympus公司;PYX-DHS-40X50-S-Ⅱ型恒温培养箱,太仓市实验设备厂;旋转蒸发器RE-52A,上海亚荣生化仪器厂。
1.3 方法
1.3.1 单孢子悬液制备
出发菌株接种到生孢培养基上,于恒温培养箱中培养5~6 d,用无菌生理盐水吹打收集孢子,得到的孢子悬液经两层孔径为75 μm的尼龙筛过滤除去菌丝体,经3 000 r/min离心10 min收集孢子,小心洗涤沉淀3次,以磷酸盐缓冲液重悬并调节孢子密度约为107个/mL。
1.3.2 EMS诱变方法
参照文献[4]的方法,略有修改:取19.6 mL孢子悬液加入0.4 mL EMS(终体积分数2%)混匀后振荡诱变10~120 min,对照组加入等量生理盐水。诱变结束后加入等体积的2% Na2S2O3终止反应,静置10 min,离心弃上清,再用2% Na2S2O3和无菌生理盐水各洗2次后,用无菌生理盐水重悬孢子,稀释适当倍数后涂布于PDA固体平板培养基,28 ℃恒温培养。同时涂布等量对照组孢子,根据诱变后孢子和对照组的再生菌落数计算存活率。
1.3.3 筛选方法
1)初筛:挑取上述诱变后培养基上生长出的菌落接种到新的PDA培养基,恒温培养6 d,观察比较平板上红色色素圈的大小,选取生长良好、色素圈直径大的菌株进行复筛[6]。
2)复筛:采用三角瓶发酵法,经初筛得到的高产菌株打孔接种到液体发酵培养基中,150 r/min振荡培养10 d后测定竹红菌甲素产量,每个菌株重复3瓶取平均值。
1.3.4 遗传稳定性测试
将筛选得到的高产突变菌株连续传代5次,经液体摇瓶发酵培养,通过HPLC测定产量,观察其遗传稳定性。
1.3.5 分析测定方法
1)致死率计算 诱变后孢子再生菌落数记为A,对照组再生菌落数记为B,按下式(1)计算存活率。
(1)
2)竹红菌甲素产量的测定:取干燥研碎的竹黄菌体粉末0.1 g,加入5 mL丙酮浸提24 h,重复此步骤一次,合并2次提取液,定容到10 mL,得到竹红菌甲素提取液,提取液经0.45 μm微孔滤膜过滤后经HPLC分析。色谱条件为色谱柱SinoChrom ODS-BP(4.6 mm×250 mm,5 μm),柱温30 ℃,流动相V(甲醇)∶V(水)=75∶25,流速为1.0 mL/min,检测波长为300 nm,进样量为20 μL[7]。此条件下,竹红菌甲素的保留时间为23.5 min。
2 结果与讨论
2.1 HPLC测定竹红菌甲素的含量
竹黄菌菌丝经过干燥、粉碎和丙酮浸提后,收集提取液,蒸干后以甲醇重溶。以竹红菌甲素标准品作为外标对照,对提取液进行HPLC分析,实验结果如图1所示。图1(a)为竹红菌甲素标准品图谱,图1(b)为提取液分析图谱,目标峰用星号表示。经测定,出发菌株的竹红菌甲素产量为18.3 mg/L。
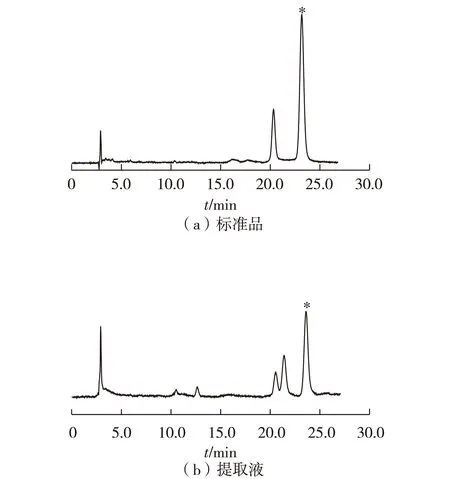
图1 竹红菌甲素HPLC分析图谱Fig.1 HPLC chromatogram of hypocrellin A
2.2 EMS最佳诱变条件的确定

图2 竹黄菌菌丝和孢子的显微镜观察Fig.2 Microscopic examination of mycelia and spores of shiraia sp.
在显微镜下观察竹黄菌的菌丝体形态如图2(a)所示,根据1.3.2的方法,使用不同浓度EMS处理竹黄菌孢子(图2 (b))悬液不同的时间,所得存活率结果见表1。由表1可知,经过EMS处理的竹黄菌孢子存活率均低于对照,而且随着EMS浓度的提高和处理时间的延长而下降。综合考虑诱变效果和存活率,本实验最终选取浓度为1.5%~2%的EMS溶液,诱变完成后在PDA培养基上进行孢子再生,挑选单菌落进行高产菌株的筛选。

表1 不同浓度EMS处理后的孢子存活率Table 1 Survival rate of spores after EMS treatments
2.3 高产菌株的筛选
孢子经EMS诱变、再生后,选取菌丝长势好、产孢能力强的菌株接种至PDA平板,总共挑取了40株诱变菌株,发现竹红菌素产量变化范围从几乎不产竹红菌素到最高为30 mg/L。
根据菌株的生长情况及竹红菌甲素产量进行诱变株的初步筛选。发现诱变后的菌株有的表现出竹红菌甲素产量提升,有的反而几乎不产竹红菌甲素,表明采用EMS进行化学诱变对菌株性状的影响具有随机性,因此在菌种选育工作中实现定向育种依然是研究中的一个重要方向。
比较诱变菌株红色色素圈大小,结果如图3所示。从挑取的单菌落中选出色素圈直径大于原代且生长良好的9株突变菌株用于复筛。

a~d:不同诱变菌株的色素圈形态图3 竹红菌甲素高产菌株的初筛Fig.3 Primary screen on mutant strain of higher production of HA
将经初筛得到的性状、产量提升的9株诱变菌株接种到液体发酵培养基,进行摇瓶发酵培养,如1.3.5中的方法通过HPLC测定竹红菌甲素产量,每个菌株重复3组,测得的竹红菌甲素产量结果取平均值,实验结果见表2。由表2可知,从初筛得到的菌株HA产量均有一定程度的提升,其中10-5菌株表现最佳,HA产量达到26.8 mg/L,与出发菌株相比提高了46.4%,且菌株生长情况也有改善,可以应用于发酵生产竹红菌甲素。

表2 竹黄菌诱变株与出发菌株竹红菌甲素产量的比较Table 2 Comparison of HA production between mutated and original strains
2.4 遗传稳定性的测试
将筛选得到的菌株10-5连续传代5次,经液体摇瓶发酵培养,通过HPLC测定产量,结果见表3。由表3可知,10-5菌株的竹红菌甲素产量较稳定,遗传稳定性良好。
3 结 论
通过实验首先确定了竹黄菌孢子EMS诱变的适宜诱变剂量:1.5%~2%EMS溶液。筛选获得的竹红菌甲素高产突变株,经液体发酵培养,产量相比出发菌株提高46.4%,且遗传稳定性良好。说明本研究应用的EMS化学诱变技术在竹红菌甲素产量提升上具有很好的效果,但诱变后菌株性状的变化具有随机性,筛选的工作量很大。今后的研究中,笔者将进一步探讨竹红菌甲素的生物合成途径和诱导技术,并将运用分子生物学技术对合成途径中的关键酶等进行表达修饰,通过生物反应器生产技术的探讨,为竹红菌甲素生物技术生产提供基础和参考。

表3 10-5菌株传代稳定性的测试结果Table 3 Verification of the mutation strain 10-5
[1] 陈占利,殷志琦,张健,等.药用真菌竹黄的研究进展[J].亚太传统医药,2011,7(7):160-163.
[2] 张宏军,肖钢,谭太龙,等.EMS处理甘蓝型油菜(Brassicanapus)获得高油酸材料[J].中国农业科学,2008,41(12):4016-4022.
[3] 杨乾,张峰,王蒂,等.EMS诱变筛选马铃薯茎段离体耐盐变异体[J].核农学报,2011,25(4):673-678.
[4] 陈旭,王德良,俞雅琼,等.甲基磺酸乙酯(EMS)诱变选育低产蛋白酶A啤酒酵母的研究[J].食品与机械,2009,25(4):35-37.
[5] 董婷,潘魏松,赵一璐,等.应用基因组改组技术选育竹红菌甲素高产菌株[J].生物加工过程,2012,10(1):25-29.
[6] 杜文,孙春龙,韩燕峰,等.竹黄无性型菌株产竹红菌甲素的聚类分析[J].中国中药杂志,2010,35(8):960-963.
[7] Liang X H,Cai Y J,Liao X R,et al.Isolation and identification of a new hypocrellin A-producing strainShiraiasp.SUPER-H168[J].Microbiological Research,2009,164:9-17.
(责任编辑 周晓薇)
Breeding of Shiraia sp.strain with high-yield hypocrellin by EMS mutation
YANG Zhuying,PAN Weisong,NIE Yun,LUO Han,WANG Jianwen
(School of Pharmaceutical Sciences,Medical College,Soochow University,Suzhou 215123,China)
One isolated strainShiraiasp. S8 from the stems ofBrachystachyumdensiflorumwas breeding candidates for higher production of hypocrellin A (HA) by ethyl methane sulphonate (EMS) mutation. EMS at 0.5% to 2.5% was used to treat the suspension spores for 10 min to 30 min.Through the combined methods with the preliminary screening on the diameter of the red pigment ring and HPLC,the mutant 10-5 with higher HA yield was obtained and the production was verified to be genetically stable.HA yield by mutant 10-5 was increased by 46.4% than that of the original strain.The EMS mutant had industrial potential and pharmaceutical importance for HA.
ethyl methane sulphonate;hypocrellin;screening;Shiraiasp.
10.3969/j.issn.1672-3678.2014.02.005
2012-10-11
教育部留学基金(K513201011);国家大学生创新创业训练计划(5731502710);大学生课外学术科研基金(KY2013558B)
杨珠英(1978—),女,浙江义乌人,硕士研究生,研究方向:天然药物生物技术;王剑文(联系人),研究员,E-mail:jwwang@suda.edu.cn
Q784
A
1672-3678(2014)02-0024-04

