滑子菇多糖的体外生物活性初步研究
李佳媚,孙润广,郭国赟,张 智
(1.陕西师范大学物理学与信息技术学院,西安710062; 2.陕西服装工程学院,咸阳712046)
滑子菇多糖的体外生物活性初步研究
李佳媚1,2,孙润广1,郭国赟1,张 智1
(1.陕西师范大学物理学与信息技术学院,西安710062; 2.陕西服装工程学院,咸阳712046)
为了研究滑子菇水提粗多糖(PNP)的体外生物活性,对滑子菇多糖的总还原力、清除1,1-二苯基-2-苦苯肼自由基(DPPH·)和由Fe2+诱发的脂质过氧化反应的抑制作用进行研究,采用MTT比色法和胎盘蓝细胞计数检测对滑子菇水提粗多糖的体外抑制K562细胞生长作用进行了研究,采用流失细胞术对滑子菇多糖作用人白血病K562细胞后的细胞周期进行了研究。结果表明:滑子菇水提粗多糖PNP具有一定的还原能力;在高质量浓度(800 μg/mL)时具有接近于Vc清除DPPH· 的能力,达41.28%;PNP对Fe2+诱发的脂质过氧化反应具有一定的抑制作用,并且随着浓度的增加抑制作用逐渐增强,但总的增长趋势不大;MTT实验表明PNP对K562细胞的体外增长有抑制作用,在质量浓度为800 μg/mL和作用时间为48 h时,可达到最高的抑制率35.03%。流式细胞术对细胞周期的检测表明滑子菇多糖能够阻滞人白血病K562细胞于G1期。
抗氧化;抗肿瘤;滑子菇;滑子菇多糖
多糖是自然界中含量最丰富的生物大分子物质,具有储存能量、构成生物体结构物质、抗病毒、抗衰老等功能,有些多糖还是非特异性的免疫增强剂,具有免疫调节和抗肿瘤的生物活性[1-2]。生物体在新陈代谢过程中会不断地产生自由基,包括单线态氧和过氧自由基等活性氧,这些活性氧能与体内的生物大分子,诸如DNA、蛋白质或者脂质发生反应从而削弱它们的功能,从而引发许多种疾病如癌症、心脑血管疾病的发生[3]。
植物多糖具有强抗氧化活性,菌类中的香菇多糖、灵芝多糖、冬虫夏草多糖等具有自由基清除能力,从而表现出抗氧化特性,因此此类天然的抗氧化剂可以有效地保护人体免受自由基伤害,防止一些慢性疾病的发生[4]。寻找有抗氧化活性和抗肿瘤活性的天然化合物具有重要的科学意义。
滑子菇又叫作珍珠菇、滑菇,是一种重要的真菌,属于珍稀品种,在植物学分类上属真菌门、担子菌亚门、散菌目、盖球菇科、磷伞属,是集食用和药用一体的菌类植物[5]。滑子菇多糖是滑子菇的主要成分之一,笔者主要运用热水提醇沉法从滑子菇中提取多糖,从体外抗氧化活性和体外抑制肿瘤细胞生长作用两方面对滑子菇多糖的体外生物活性进行研究,以期为功能食品的开发和利用提供实验依据和理论参考,具有重要的生物学意义和潜在的应用前景。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
滑子菇水提多糖(PNP),由陕西师范大学生物物理与生物医学工程研究室制备;K562细胞来自中国科学院上海生命科学研究院细胞资源中心。
1.1.2 试剂
无支原体新生牛血清,浙江天杭生物科技有限公司;RPMI Medium 1640,美国Gibco公司;MTT,美国Amresco公司;DMSO、医用酒精、1,1-二苯基-2-苦苯肼自由基(DPPH·)、硫代巴比妥酸(TBA)、牛血清蛋白(BSA)、RNase,碘化吡啶(PI)均为国产分析纯试剂;实验所用水均为三次蒸馏水。
1.2 仪器
Olympus TH4-200型倒置显微镜,日本奥林巴斯公司;HH·CP-01W型CO2细胞培养箱,上海博讯事业有限公司医疗设备厂;YP601N型电子天平,上海精密科学仪器有限公司;TDL80-2B型台式离心机,上海安亭科学仪器厂;超净工作台、DG5032型酶联免疫检测仪,南京华东电子集团医疗仪器设备有限责任公司;SZ-97型自动三重纯水蒸馏器,上海亚荣生化仪器厂;CF16RX型高速离心机,日本日立公司;TU-1810型紫外可见分光光度计,北京谱析通用仪器有限责任公司;HH-4型数显恒温水浴锅,上海浦东物理光学仪器厂;血球计数板,上海市求精生化试剂仪器有限公司。
1.3 试验方法
1.3.1 滑子菇多糖的制备
滑子菇多糖采用热水提醇沉的方法制备。
1.3.2 K562细胞的培养
人白血病细胞系K562培养在含有10%(体积分数)小牛血清和100 IU双抗(青、链霉素)的RPMI 1640溶液中,在5%CO2、饱和湿度、37 ℃环境下生长,取处于生长对数期的细胞进行试验。
1.3.3 滑子菇多糖总还原能力的测定
采用铁氰化钾还原法测定滑子菇多糖的总还原能力[6],1 mL不同质量浓度的滑子菇多糖PNP溶液和抗坏血酸Vc溶液(25、50、100、200、400和800 μg/mL)中依次加入pH为6.6的磷酸盐缓冲液2.5 mL和1%的铁氰化钾2.5 mL摇匀,置于50 ℃恒温水浴中反应20 min后取出快速冷却,随后加入10%三氯乙酸(TCA)溶液2.5 mL,4 000 r/min、4 ℃条件下离心10 min,取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL的1%FeCl3溶液,混合均匀后静置10 min,700 nm波长下测吸光度值(A700),试样还原能力与A700值成正比。
1.3.4 滑子菇多糖清除1,1-二苯基-2-苦苯肼自由基(DPPH·)能力的测定
参照陈奕等[7]的方法,称取一定量的DPPH·用少量无水乙醇溶解,然后用50%乙醇配成30 μmol/L的溶液,取2 mL DPPH溶液,分别加入0.2 mL不同质量浓度(25、50、100、200、400和800 μg/mL)的滑子菇水提粗多糖溶液和Vc溶液(Vc为阳性对照)中,摇匀,放入25 ℃恒温水浴中反应15 min后取出,测定525 nm波长下的吸光值OD,以 0.2 mL 50%乙醇代替试样作为空白对照管,以2 mL 50%乙醇代替DPPH溶液作为试样参比管,并以等体积蒸馏水和50%乙醇混合液空白调零,按照同样的方法测定525 nm波长下的吸光值,试样对DPPH·的清除作用按式(1)计算。
(1)
式中:Ai为试样管的吸光值;Aj为试样参比管的吸光值;Ac为空白对照管吸光值。
1.3.5 滑子菇多糖对Fe2+诱发的脂质过氧化反应的抑制作用
参照张尔贤等[8]的方法,取pH 7.45磷酸盐缓冲液 (PBS)0.1 mol/L配制卵黄悬液[V(卵黄)∶V(PBS)=1∶25],吸取卵黄悬液0.2 mL,分别加入0.1 mL不同质量浓度(25、50、100、200、400和800 μg/mL)的滑子菇水提粗多糖溶液和抗坏血酸Vc溶液(Vc为阳性对照)中,再加入0.2 mL 25 mmol/L的FeSO2溶液,然后加入1.5 mL 0.1 mol/L pH 7.45的PBS,37 ℃恒温振荡15 min,取出后加入 0.5 mL 200 g/L的三氯乙酸(TCA),3 500 r/min离心10 min,吸取2 mL上清液加入8 g/L TBA 1 mL,加塞,放入沸水浴中15 min,冷却后,以空白管(3 mL PBS代替)调零,于532 nm处比色测定吸光度值,以0.1 mL蒸馏水代替试样作为空白对照管,按同样处理方法测定532 nm波长下的吸光值,试样抗氧化活性(AOA)用对卵黄脂蛋白脂质过氧化的清除率按式(2)计算。
(2)
式中:A0为空白对照管吸光值;A为试样管吸光值。
1.3.6 MTT法检测滑子菇多糖对K562细胞的体外增殖活性
取处于对数生长期的状态良好的K562细胞,调整细胞密度为5×104个/mL接种到96孔板中,每孔100 μL细胞悬液,放入37 ℃、5% CO2和饱和湿度环境下培养24 h后,调零孔和对照组,每孔加入100 μL无血清培养基溶液,实验组每孔加入PNP溶液(质量浓度分别为25、50、100、200、400和800 μg/mL),每组做6个平行,继续分别培养24、48和72 h后,每孔加入5 mg/mL的MTT溶液20 μL放入孵箱培养4 h,1 000 r/min离心5 min,弃去上清液,每孔加入180 μL的DMSO,轻微振荡15 min,用酶联免疫检测仪在492 nm下测光吸收值OD。按照式(3)计算细胞增殖抑制率。
细胞增殖抑制率=[(对照组A值-实验组A值)/对照组A值] ×100%
(3)
1.3.7 台盼蓝细胞计数检测细胞存活率
质量浓度分别为25、50、100、200、400和800 μg/mL且处理过的K562细胞悬液与0.4%台盼蓝以体积比9∶1的比例混合,3 min内利用血球计数板计数。
1.3.8 细胞周期检测实验
取处于对数生长期的状态良好的K562细胞,调整细胞密度为5×104个/mL接种到24孔板中,放入37 ℃,5% CO2和饱和湿度环境下培养24 h后,对照组加入无血清培养基溶液,实验组每孔加入PNP溶液(质量浓度分别为25、50、100、200、400和800 μg/mL),继续培养48 h;随后将孔板内的细胞悬液分别收集于EP管中,1 000 r/min转速下离心5 min,弃去上清液,底层沉淀用预冷的PBS(含1%BSA)清洗2次,将细胞重悬于500 μL的PBS缓冲液中,混合均匀后逐滴加入预冷的70%乙醇,4 ℃条件下固定过夜;将固定之后的细胞离心弃去上清液,PBS(含1%BSA)清洗2次,将细胞重悬于500 μL的PBS中,加入5 μL的RNase A(10 mg/mL)在37 ℃条件下避光反应30 min后置冰浴终止反应,加入25 μL PI(碘化吡啶)染色,4 ℃避光反应30 min,上流式细胞仪检测。
2 结果与讨论
2.1 滑子菇水提粗多糖总还原力的测定
滑子菇水提粗多糖PNP和阳性对照组Vc在700 nm波长下的吸光度值如图1所示。
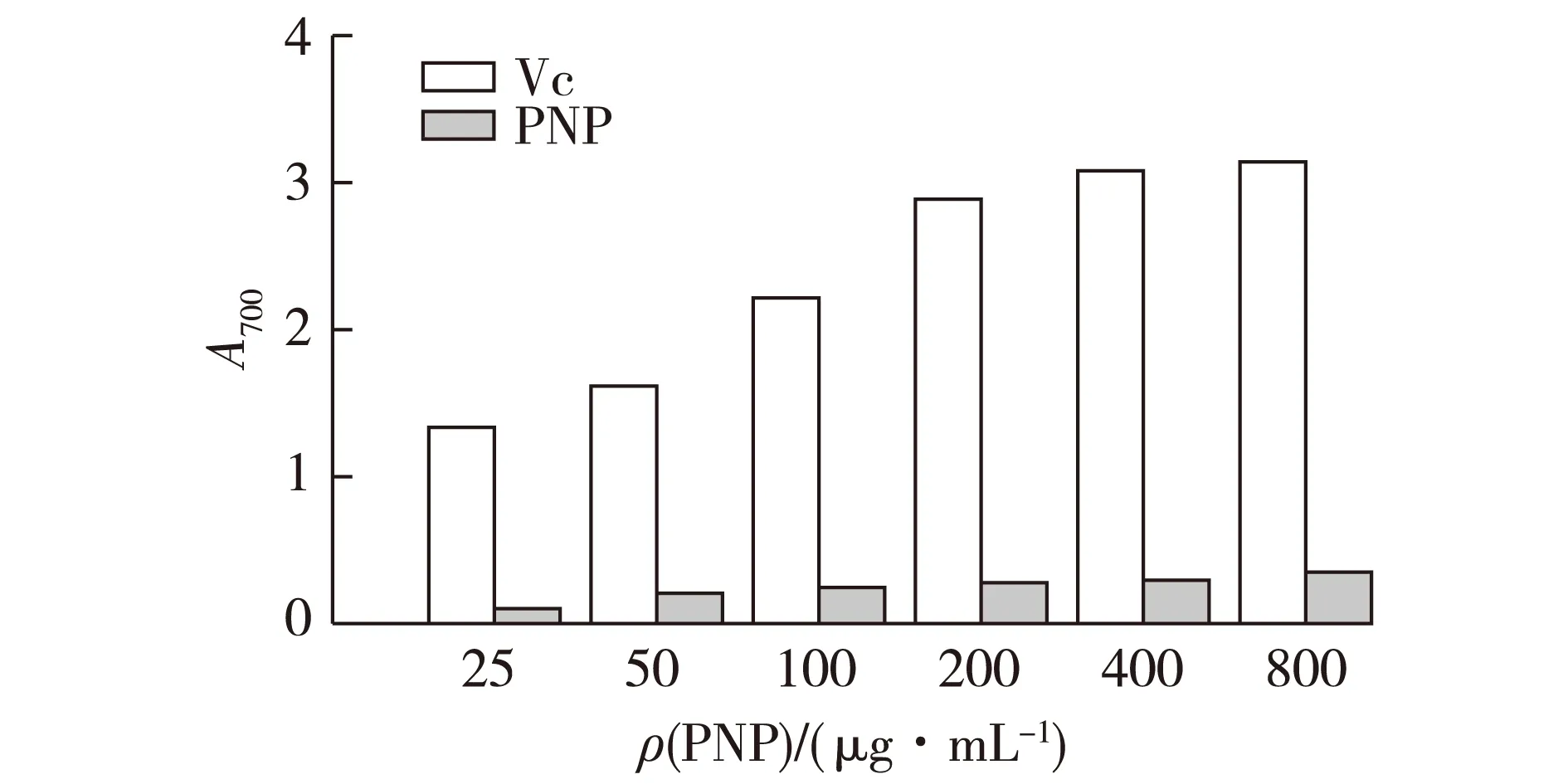
图1 PNP的还原能力Fig.1 Reduction ability of PNP
由图1可以看出:滑子菇水提粗多糖有一定的还原能力,且其还原能力随着多糖质量浓度的增大而增强,但是其还原能力远低于Vc,一般而言,物质的还原能力越强其抗氧化能力也越强,由此说明滑子菇水提粗多糖具有较弱的还原能力。
2.2 滑子菇水提粗多糖对DPPH·的清除作用
DPPH·在有机溶剂中是一种稳定的自由基,其醇溶液呈深紫色,具有单一的电子,故能够接受一个电子或是H+,在514 nm波长处有最大吸收峰,当存在自由基清除剂时,DPPH·的单电子被捕捉从而使其颜色变浅,因而在514 nm处的吸光值亦下降,从而可以用来评价化合物的抗氧化能力[9]。滑子菇水提粗多糖对DPPH·的清除作用结果见图2。
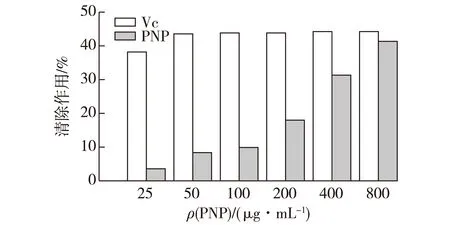
图2 滑子菇水提粗多糖对DPPH·的清除作用Fig.2 Scavenging effects of PNP on DPPH·
由图2可以看出:滑子菇水提粗多糖对DPPH·具有一定的清除作用,且随着多糖质量浓度增加,清除作用也随之增强,当多糖质量浓度增加到800 μg/mL时,滑子菇水提粗多糖对DPPH·清除率与抗坏血酸对DPPH·的清除率相接近,达到41.28%。表明水提滑子菇多糖中存在一个捕获DPPH·的单电子的基团,可以将其单电子捕捉,达到清除DPPH·的作用,从而使其颜色变浅,使在514 nm处的吸光值下降。
2.3 滑子菇水提粗多糖对Fe2+诱发的脂质过氧化反应的抑制作用
滑子菇水提粗多糖对Fe2+诱发的脂质过氧化反应的抑制作用见图3。脂质过氧化反应被认为是与肝脏亚细胞水平和组织水平损伤有关,虽然有证据表明脂质过氧化不会造成细胞死亡,但是它仍然会对肝脏损伤产生协同放大作用[10]。且脂质过氧化反应是细胞膜多不饱和脂肪酸发生的一系列自由基链式反应,与衰老、自身免疫疾病、肝损伤等很多疾病的发生、发展有关,脂质过氧化反应具有组织特异性,严重威胁着大脑、心脏、肝脏等器官,如果存在抗氧化剂,便可通过清除过氧化产物来阻断链式反应的发生,从而阻止脂质过氧化[11]。

图3 滑子菇水提粗多糖的抗脂质过氧化能力Fig.3 Inhibitory effects of PNP on lipid peroxidation
由图3可以看出:滑子菇水提粗多糖具有抑制由Fe2+诱发的脂质过氧化反应的活性,且随着多糖质量浓度的增加,抑制活性逐渐增强,但总体增强的幅度不是很大。在多糖质量浓度为800 μg/mL时抑制率达到19.72%。实验结果表明,水提滑子菇多糖中含有一定量的清除过氧化产物的基团,能够在一定程度上抑制由Fe2+诱发的脂质过氧化反应。
2.4 滑子菇水提粗多糖对K562细胞的生长抑制活性
真菌多糖对肿瘤具有直接的细胞毒性,它们可以抑制肿瘤细胞增殖,诱导分化和细胞凋亡,影响肿瘤细胞膜的生化特性,并且抑制肿瘤血管形成,同时还可增强机体免疫功能从而间接地抑制肿瘤生长[12]。
图4为滑子菇水提粗多糖对人白血病K562细胞的体外增殖抑制作用结果。由图4可知:作用时间为24 h时,抑制人白血病的K562细胞体外生长作用较弱,低质量浓度(25~200 μg/mL)时抑制作用与对照组相比没有显著性差异,质量浓度为400和800 μg/mL时抑制作用显著,由于多糖与细胞的作用时间较短,多糖的抑制活性没有完全表现出来,因此对K562细胞的生长起到了较弱的抑制作用;当作用时间延长至48 h时,PNP对K562细胞的抑制作用明显增大,在100~800 μg/mL质量浓度范围内抑制作用与阴性对照组相比有显著性差异,在质量浓度为800 μg/mL时抑制率达到最大为35.03%。赵俊霞等[13]的研究表明滑子菇多糖能诱导K562细胞出现典型的凋亡形态,可诱导凋亡相关基因Caspase-3在mRNA水平上的表达,从而达到抑制K562细胞增殖的作用;当作用时间为72 h时,PNP对K562细胞生长不再具有抑制作用,魏文青等[14]的研究表明肿瘤药物对肿瘤细胞的生长具有一个最佳的作用时间,在最佳作用时间之前,抑制作用随着作用时间的增加而增强,超过这个最佳作用时间后,抑制作用随着时间的增长而减弱。
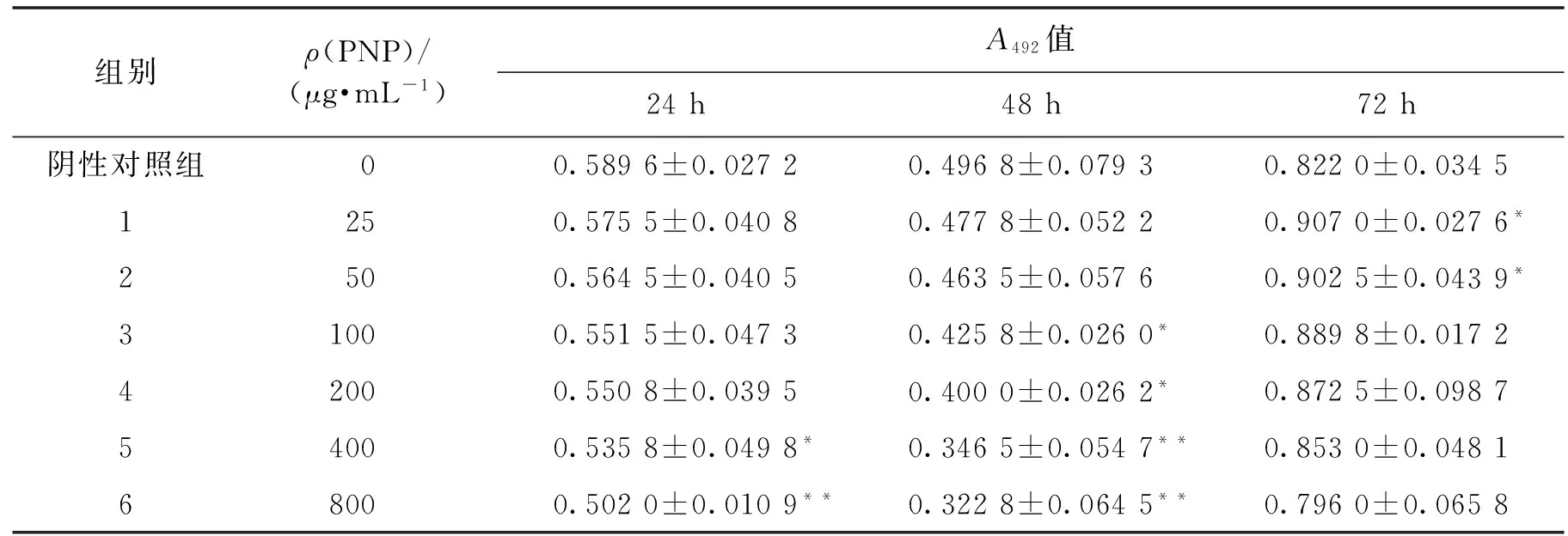
表1 滑子菇水提粗多糖MTT的试验结果Table 1 MTT results of PNP
注:与阴性对照组比较,*P<0.05;**P<0.01。
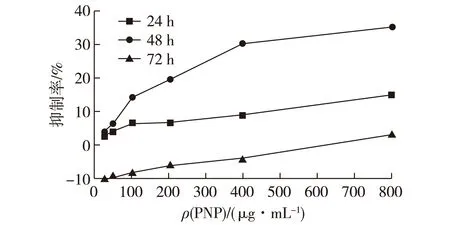
图4 不同质量浓度PNP作用K562细胞24、 48和72 h后的细胞抑制率Fig.4 Cell viability of K562 cells after treated with PNP on different concentrations for 24,48 and 72 h
2.5 胎盘蓝细胞计数结果
K562细胞在含有不同浓度的滑子菇多糖的培养液中分别培养24、48和72 h后计数,由图5可以看出,计数结果表明:在24和48 h时细胞生长受到抑制,并且随着多糖浓度的增加细胞数量逐渐减少,到72 h时基本没有影响,该结果与MTT实验结果相一致(表1)。
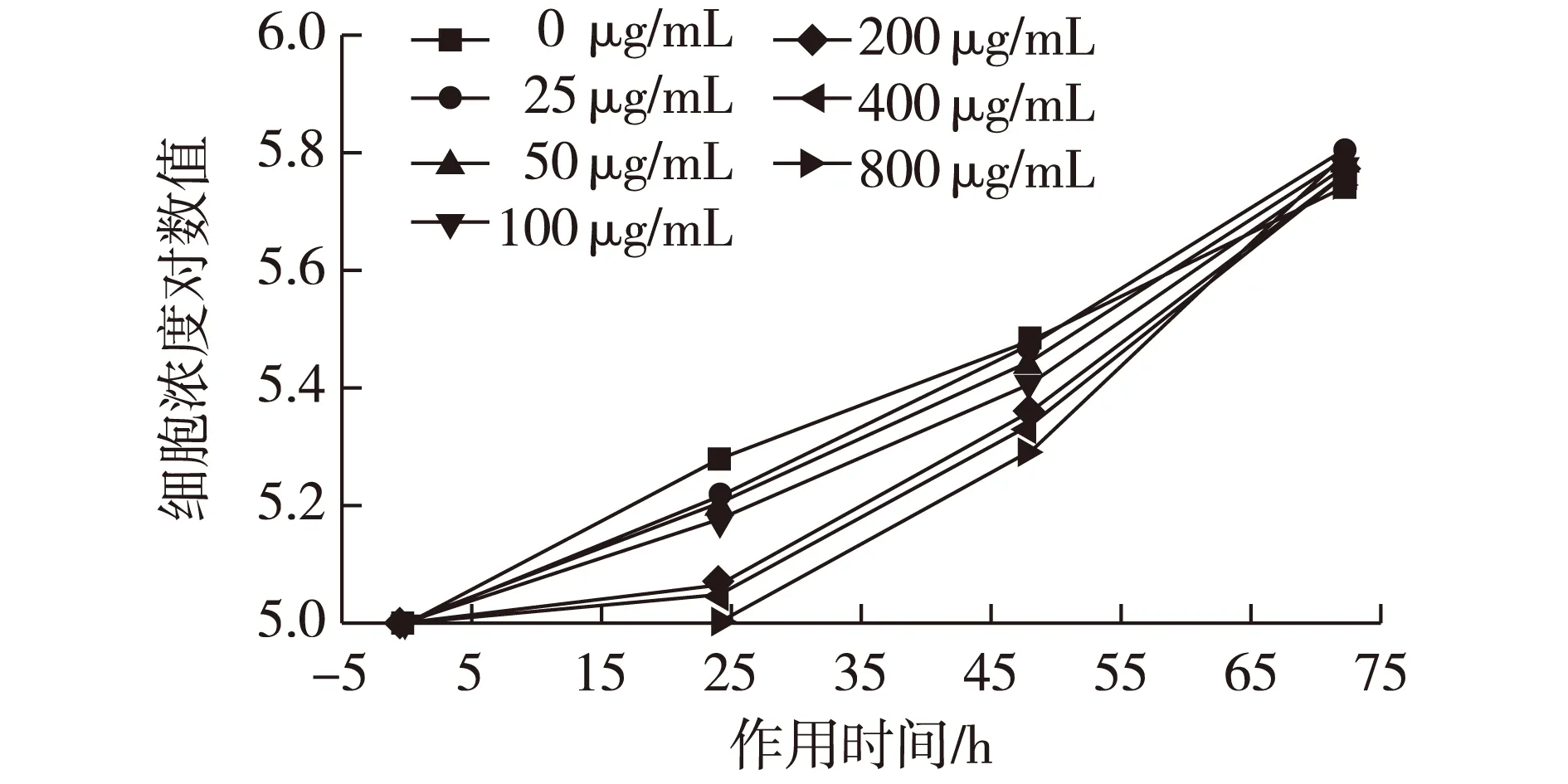
图5 滑子菇多糖PNP对人白血病K562 细胞生长曲线的影响Fig.5 Effects of PNP on K562 cell growth curves
2.6 细胞周期检测实验结果
细胞周期分为间期和分裂期(M期)2个阶段,间期又分为DNA合成前期(G1期)、DNA合成期(S期)和DNA合成后期(G2期),根据有丝分裂细胞在各个时期DNA含量的不同,用DNA染料处理细胞后就可以将细胞周期区分开来。不同浓度的滑子菇多糖作用细胞48 h后对K562细胞周期的影响如图6和表2所示。由图6和表2可知:与对照组相比,实验组的S期细胞明显减少,G2期细胞随着多糖质量浓度的增加先增多随后有减少,而G1期的细胞明显增加,表明滑子菇多糖阻滞细胞的周期在G1期。
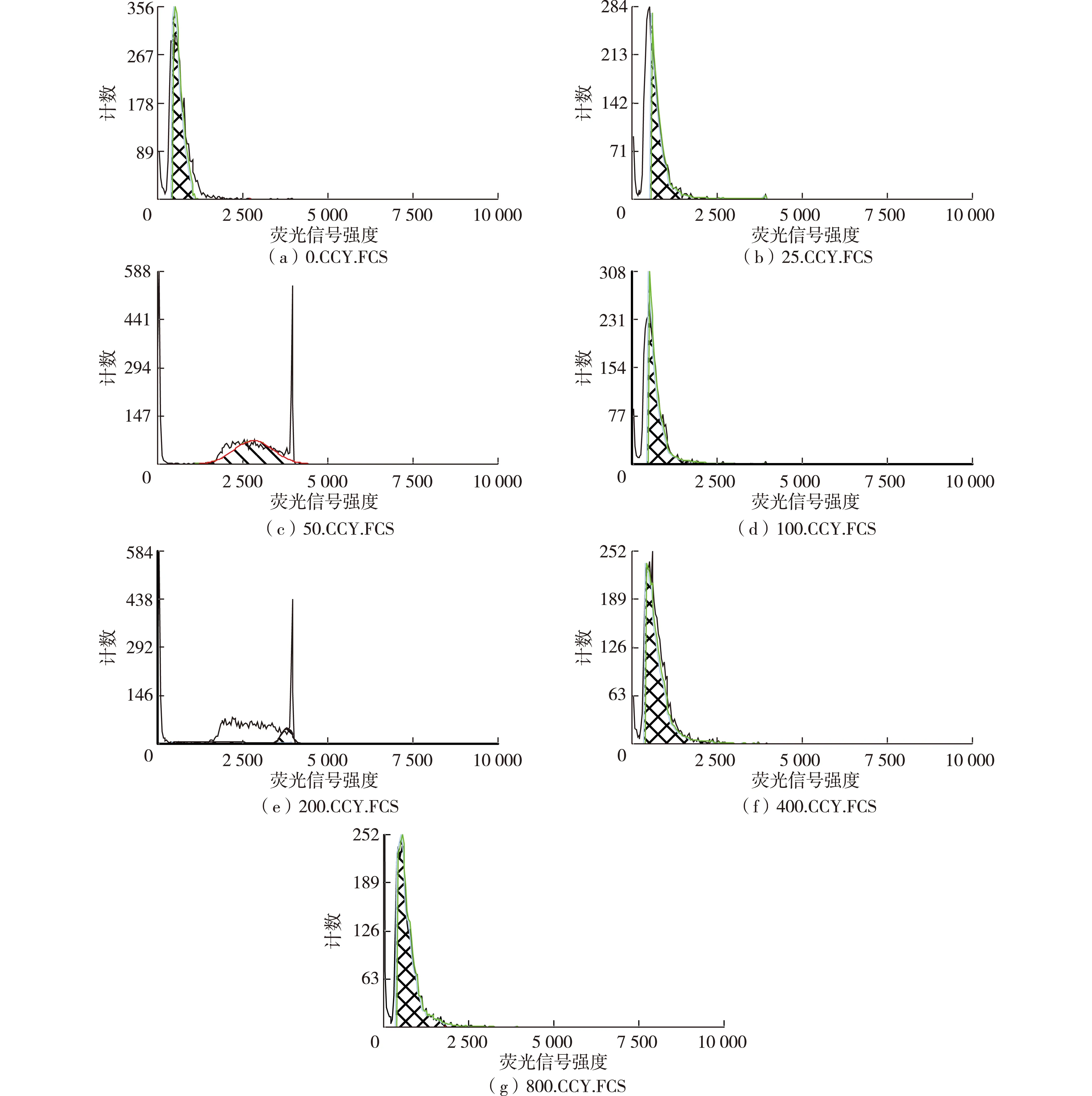
图6 PNP作用K562细胞48 h后细胞周期的检测结果Fig.6 Cell cycle test results of PNP on K562 after 48 h
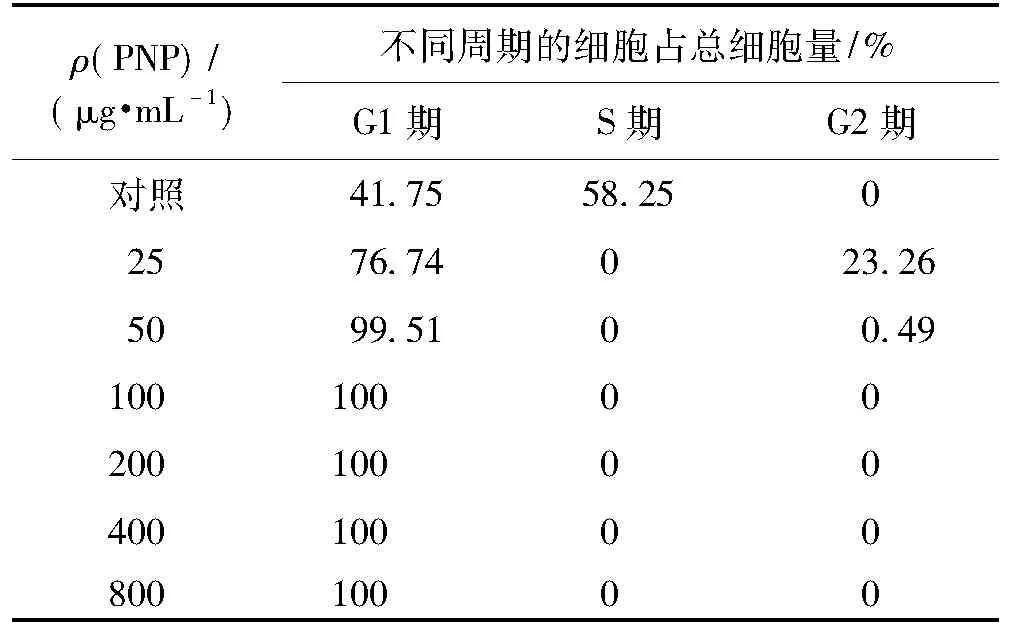
ρ(PNP)/(μg·mL-1)不同周期的细胞占总细胞量/%G1期S期G2期对照41.7558.2502576.74023.265099.5100.4910010000200100004001000080010000
2.7 光学显微镜观察
图7(a~g)分别为25、50、100、200、400和800 μg/mL的滑子菇水提粗多糖处理人白血病K562细胞48 h后和空白对照组K562细胞的倒置荧光显微镜观察图。从图7可以观察到:随着滑子菇水提粗多糖质量浓度的增加,细胞密度和数量发生了显著变化。正常生长状态下的人白血病K562细胞成规则的圆球状,分布均匀,细胞接触紧密,生长速度快。图7中滑子菇水提粗多糖作用48 h后,随着质量浓度的增加细胞密度逐渐下降,细胞形态发生了改变,部分细胞体积增大,有些细胞甚至发生溶解破裂。说明K562细胞加入滑子菇水提粗多糖后细胞生长受到抑制并且发生形态变化,分析可能的原因是滑子菇多糖可以诱导癌细胞凋亡并且具有细胞毒性,从而影响肿瘤细胞膜表面的生化特性,抑制了肿瘤细胞的增殖。

图7 滑子菇水提粗多糖与K562细胞作用48 h后倒置显微镜观察图Fig.7 Inverted microscope images of PNP on K562
3 结 论
主要对滑子菇水提粗多糖的体外生物活性进行了研究,通过实验可以得出滑子菇水提粗多糖具有很好的抗氧化能力;并且具有一定的还原能力;当多糖质量浓度为800 μg/mL时,滑子菇水提粗多糖对DPPH·的清除作用接近于抗坏血酸,达到41.28%的抑制效果;滑子菇水提粗多糖还具有抑制脂质过氧化的作用,当多糖的质量浓度为800 μg/mL时达到最高抑制率19.72%;同时滑子菇水提粗多糖对K562细胞的体外增殖具有显著的抑制作用,在多糖质量浓度为800 μg/mL与作用时间为48 h时,抑制率最高可达到35.03%,同时滑子菇多糖能够阻滞人白血病K562细胞周期于G1期。综合表明滑子菇水提粗多糖有较好的体外生物活性,为研究开发滑子菇多糖提供了一定的实验依据。
[1] 杜庆.食(药)用真菌多糖的研究进展[J].中国食物与营养,2011,17(5):75-77.
[2] 赵春海,阚振荣.食(药)用真菌多糖的研究[J].发酵科技通讯,2008,37(2):14-16.
[3] Martfnez-Cayuela M.Oxygen free radicals and human disease[J].Biochimie,1995,77:147-161.
[4] Ding X,Feng S,Cao M,et al.Structure characterization of polysaccharide isolated from the fruiting bodies ofTricholomamatsutake[J].Carbohydrate Polymers,2010,81:942-947.
[5] 向莹,陈健.滑子菇营养成分分析与评价[J].食品科学,2013,34(6):238-242.
[6] 张志军,李淑芳,魏雪生,等.灵芝多糖体外抗氧化活性的研究[J].化学与生物工程,2011,28(3):63-65.
[7] 陈奕,谢明勇,弓晓峰.黑灵芝提取物清除DPPH·自由基的作用[J].天然产物研究与开发,2006,18(6):917-921.
[8] 张尔贤,方黎,张捷,等.菊花提取物的抗氧化活性研究[J].食品科学,2000,21(7):6-9.
[9] 勾明玥,刘梁,张春枝.采用DPPH法测定26种植物的抗氧化活性[J].食品与发酵工业,2010,36(3):148-150.
[10] Poli G,Albano E,Dianzani M U.The role of lipid peroxidation inliverdamage[J].Chemistry and Physics of Lipids,1987,45(2/3/4):117-142.
[11] Song Houfang,Zhang Quanbin,Zhang Zhongshan,et al.In vitro antioxidant activity of polysaccharides extracted fromBryopsisplumose[J].Carbohydrate Polymers,2010,80(4):1057-1061.
[12] 岳丽玲,张巍,刘丹.真菌多糖抗肿瘤机制研究进展[J].齐齐哈尔医学院学报,2011,32(18):2988-2989.
[13] 赵俊霞,郑力芬,赵娟,等.滑菇多糖对K562白血病细胞增殖的抑制及Caspase-3基因表达的影响[J].第四军医大学学报,2007,28(15):1393-1396.
[14] 魏文青,赵满仓,刘晶,等.MTT肿瘤药物敏感试验的方法学研究[J].临床肿瘤学杂志,2008,13(10):871-874.
(责任编辑 周晓薇)
In vitro biological activity of polysaccharide extractedfrom Pholiota nameko
LI Jiamei1,2,SUN Runguang1,GUO Guoyun1,ZHANG Zhi1
(1. College of Physics and Information Technology,Shaanxi Normal University,Xi′an 710062,China;2. Shaanxi Fashion Engineering University,Xianyang 712046,China)
Fungus polysaccharide had an important value of biological activity,Pholiotanamekowas plant fungus of edible medicinal value.Water-extracted crude polysaccharides ofPholiotanameko,were investigated. Their antioxidant activity was studied by DPPH method,the lipid peroxidation by Fe2+method,the antitumor activity by MTT assay,and placenta blue cell count detection.The flow cytometer was used to study effects of PNP on K562 cell cycle.Experimental results showed that PNP had inhibitory ability and DPPH free radical scavenging capability similar to that of Vc on high concentration.PNP had actions on lipid peroxidation with the increasing of the concentration,the inhibitory effect increased.MTT assay showed that PNP inhibited the growth of K562 cells in vitro,exhibited dose-dependent and time-based effect,the highest inhibition rate is 35.03% when treated with PNP in 800 μg/mL for 48 h.In addition,the result of cell cycle analysis by flow cytometer showed that PNP could block the K562 cell in G1 phase.
antioxidant;antitumor;Pholiotanameko;polysaccharide
10.3969/j.issn.1672-3678.2014.02.009
2012-10-17
国家自然科学基金(10874108);陕西省自然科学基础研究计划(SJ08A16);2010国家级大学生创新实验计划(101071812)
李佳媚(1988—),女,陕西宝鸡人,硕士研究生,研究方向:天然产物有效成分的化学研究;孙润广(联系人),教授,E-mail:sunrunguang@snnu.edu.cn
Q53;R73
A
1672-3678(2014)02-0044-07

