代谢木糖重组谷氨酸棒杆菌的构建
张恒丽,蔡 恒, 汪 晨,张 凯,周志惠
(南京工业大学生物与制药工程学院,南京211800)
代谢木糖重组谷氨酸棒杆菌的构建
张恒丽,蔡 恒, 汪 晨,张 凯,周志惠
(南京工业大学生物与制药工程学院,南京211800)
为了使谷氨酸棒杆菌较好地利用木糖生产有机酸,将来自EscherichiacoliK-12的木糖异构酶基因xylA构建到表达载体pXMJ19中,导入CorynebacteriumglutamicumATCC13032 Δldh中,成功表达了该酶基因。结果表明:重组菌株在以木糖为唯一C源进行发酵时,木糖的消耗速率为0.54 g/(L·h),木糖异构酶比酶活约为0.54 U/mL;在以木糖和葡萄糖的混合糖为C源进行发酵时,菌株优先利用葡萄糖,在葡萄糖完全消耗后,菌株开始有效利用木糖;以木糖为唯一C源进行两阶段发酵时,琥珀酸的收率可达(0.62±0.003)g/g。
谷氨酸棒杆菌;琥珀酸;木糖异构酶基因;木糖
随着全球经济的高速发展,以石油为主体的化石能源危机正日益严峻,可持续替代资源的开发和利用已成为当务之急。木质纤维素是地球上最丰富的可再生资源之一,广泛存在于工农业废弃物中,主要由纤维素、半纤维素和木质素组成,利用酸解或酶解的方法可将其转化为还原性糖,产生大量的五碳糖(D-木糖和L-阿拉伯糖)和六碳糖(葡萄糖、半乳糖和甘露糖),其中六碳糖约占2/3,五碳糖约占1/3。在半纤维素的水解产物中,D-木糖约占90%[1-3]。
谷氨酸棒杆菌广泛分布在自然界中,是工业生产的优良菌株,对木质纤维素中的抑制物,如4-羟基苯甲酸、香草醛、丁香醛等具有较好的耐受性,在利用木质纤维素降解成分方面具有极大的优势[4-5]。谷氨酸棒杆菌在进行工业生产时通常以葡萄糖、蔗糖等作为底物,由于缺乏转化木糖的酶系而不能有效地利用木糖,但能发酵其异构体木酮糖[6],而木糖的利用是微生物利用木质纤维素类降解组分生物转化为乙醇、琥珀酸等大宗化学品的一个关键环节,因此构建可以利用木糖的谷氨酸棒杆菌重组菌株极为重要。当前,日本的RITE研究所对CorynebacteriumglutamicumR木糖的利用进行了研究,实验发现,将大肠杆菌的木糖异构酶和木酮糖激酶基因整合至C.glutamicumR基因组上,可以实现其代谢木糖的能力,在以40 g/L葡萄糖、20 g/LD-木糖和10 g/LD-纤维二糖作为C源时,重组菌株在12 h可以将其完全消耗,且无碳代谢阻遏效应的存在[7]。
笔者以C.glutamicumATCC13032 Δldh为出发菌株,通过克隆E.coliK-12木糖异构酶基因xylA,将其连接于诱导型表达载体pXMJ19上,电转化C.glutamicumATCC13032 Δldh,实现木糖的利用,以期为后续的谷氨酸棒杆菌的进一步构建和改良奠定基础。
1 材料与方法
1.1 菌株与质粒
CorynebacteriumglutamicumATCC13032 Δldh、E.coliJM109均为笔者所在实验室保藏,质粒pXMJ19由德国科隆大学A Burkovski教授惠赠。
1.2 酶与试剂
限制性内切酶、T4 DNA连接酶、PCR反应试剂、Prime STAR DNA聚合酶及DNA Marker,均购自大连Takara公司;氯霉素,购自南京生兴生物技术有限公司;酵母提取物、胰蛋白胨,Oxoid公司产品;其余为国产分析纯;引物合成与测序由南京金斯瑞生物科技有限公司完成。
1.3 培养基与培养条件
1.3.1 培养基
培养菌体培养基为LB(g/L):蛋白胨10、酵母提取物5、NaCl 10、pH 7.0,固体培养基再加琼脂20。
电转化所用SOC培养基(g/L):蛋白胨20,酵母提取物5,NaCl 0.5,KCl 0.19,MgCl2·6H2O 0.2,葡萄糖3.6。
发酵用BT培养基(g/L):(NH4)2SO47,KH2PO40.5,K2HPO40.5,MgSO4·7H2O 0.5,FeSO4·7H2O 0.006,MnSO4·H2O 0.004,生物素 0.000 2,维生素B10.000 2。
发酵用A培养基(g/L):尿素 2,酵母粉 2,酪蛋白氨基酸 7,(NH4)2SO47,KH2PO40.5,K2HPO40.5,MgSO4·7H2O 0.5,FeSO4·7H2O 0.006,MnSO4·H2O 0.004,生物素 0.000 2,维生素B10.000 2。
大肠杆菌培养用抗生素质量浓度为50 μg/mL,谷氨酸棒杆菌培养用抗生素质量浓度为10 μg/mL 。
1.3.2 培养条件
1)种子培养条件 在平板中将一环菌接入至装有50 mL培养基的250 mL锥形瓶中,30 ℃、200 r/min培养12 h。
2)有氧培养条件 将种子液按5%的比例接种到装有100 mL培养基的500 mL锥形瓶中,30 ℃、200 r/min培养。
3)厌氧培养条件 将有氧培养后的菌液室温8 000 r/min离心10 min,弃上清,用无菌水洗涤2次后用少量厌氧培养基重悬菌泥,并接入装有50 mL培养基的血清瓶中,通入CO2气体1 min,确保血清瓶中为厌氧环境,30 ℃、150 r/min条件下厌氧发酵18 h。
1.4 目的基因的克隆
DNA酶切、连接、转化和大肠杆菌感受态制备等基本基因操作技术参照文献[8]及有关公司提供的操作手册进行,电转化感受态细胞制备参照文献[9]。基因组DNA提取采用天根生化科技有限公司的试剂盒,PCR反应采用Biometra公司PCR仪,电转化采用Bio-Rad公司高压脉冲电击转化仪。
1.5 目的基因xylA的克隆
参照NCBI数据库中已公布的E.coliK-12xylA基因序列,分别设计含有Hind III和XbaI酶切位点及其保护碱基的上下游引物。F:5′-GATAAGCTTACCTGATTATGGAGTTCAAT-3′,下划线部分为引入的Hind III酶切位点;R:5′-GATTCTAGACATATCGATCGTTCCTTAAA-3′,下划线部分为引入的XbaI酶切位点。
以E.coliK-12基因组DNA为模板,采用Prime STAR DNA 聚合酶进行PCR扩增,50 μL体积反应体系为:上下游引物(100 pmol/μL)各2 μL;模板DNA 0.5 μL;5×Prime buffer 10 μL;dNTP 4 μL;Prime STAR 0.5 μL;双蒸水33 μL。
PCR循环参数为:预变性95 ℃,5 min;(95 ℃,1 min,56 ℃,15 s,72 ℃,2 min),30个循环;72 ℃,10 min。
1.6 谷氨酸棒杆菌中木糖代谢途径的构建
将纯化的PCR产物和pXMJ19质粒分别使用Hind III和XbaI双酶切后进行连接、转化,通过酶切鉴定阳性克隆子,命名为pXMJ19-xylA。将pXMJ19-xylA电转化到C.glutamicumATCC13032 Δldh中,经氯霉素抗性平板筛选后,提取质粒进行PCR和酶切鉴定阳性重组子,命名为C.glutamicumNC-2。
1.7 木糖异构酶的活性检测
1.7.1 粗酶液的制备
取5 mL菌液于4 ℃、5 000 r/min离心10 min收集菌体,用无菌水洗涤2次后,菌体重悬于1 mL PBS(pH 7.2)缓冲液,于冰浴中超声破碎细胞,离心取上清液即为粗酶液。
1.7.2 酶活力的测定
酶活力测定采用半胱氨酸-咔唑法[10]。PBS缓冲液(pH 7.2)50 μL ,0.1 molD-木糖50 μL,10 mmol/L MnCl250 μL于50 ℃反应1 h后,沸水浴终止反应;取50 μL立即加入1.5%的半胱氨酸盐酸盐0.2 mL,13 mol/L的H2SO46 mL,混匀,25 ℃反应30 min后于540 nm处测定光吸收,根据木酮糖标准曲线求得木酮糖含量。
在标准反应混合物中,酶活力单位(U)定义为每分钟催化产生1 μmol 木酮糖所需的酶量。
1.8 分析方法
1.8.1 菌体密度的测定
采用UV-3000扫描型紫外可见分光光度计(上海美谱达仪器有限公司 )于600 nm 处测定吸光值OD600。
1.8.2 糖浓度的测定
葡萄糖浓度采用SBA 240C型生物传感分析仪(山东省科学院生物研究所)测定,木糖浓度测定采用3,5-二硝基水杨酸(DNS)比色法[11]。
1.8.3 发酵产物的测定
采用HPLC测定发酵产物,色谱条件:美国Alltech公司Prevail Organic Acid色谱柱(250 nm×4.6 mm,5 μm),柱温 室温,流动相 25 mmol/L KH2PO4、pH 2.5,流速 1 mL/min,进样量 25 μL;检测器为紫外,检测波长 215 nm[12]。
2 结果与讨论
2.1 目的基因xylA的克隆
以E.coliK-12基因组为模板,PCR扩增的产物通过琼脂糖凝胶电泳分析显示,所克隆片段大小约为1.4 kb(图1),与预期片段大小一致,经过测序分析,与Genebank中已知基因序列一致。
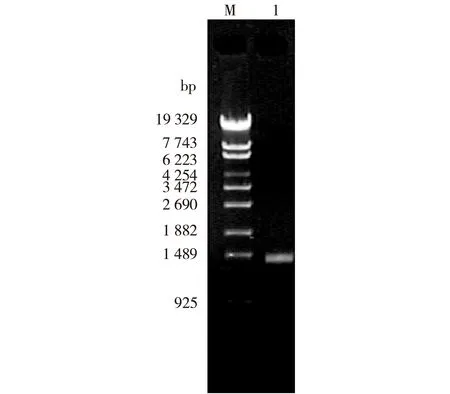
M—λ-EcoT14 I digest DNA Marker; 1—PCR product图1 木糖异构酶基因(xylA)PCR扩增产物Fig.1 PCR product of xylA gene
2.2 重组菌株C.glutamicum NC-2的构建
将酶切后的xylA片段和载体pXMJ19进行连接,转化感受态E.coliJM109,经氯霉素抗性平板筛选,提取质粒通过EcoRI单酶切验证,通过琼脂糖凝胶电泳分析显示,酶切后的片段大小约为8 kb,与预期结果一致,结果见图2。将该重组质粒电转化到C.glutamicumATCC13032 Δldh中,经氯霉素抗性筛选,提取质粒进行EcoR I单酶切鉴定,获得重组菌株C.glutamicumNC-2。
2.3 重组菌株C.glutamicum NC-2对木糖的利用
在添加20 g/L木糖或者葡萄糖的BT发酵培养基中,30 ℃、200 r/min有氧培养24 h,考察重组菌株C.glutamicumNC-2对木糖的利用情况,并与利用葡萄糖的情况进行比较,结果见图3。
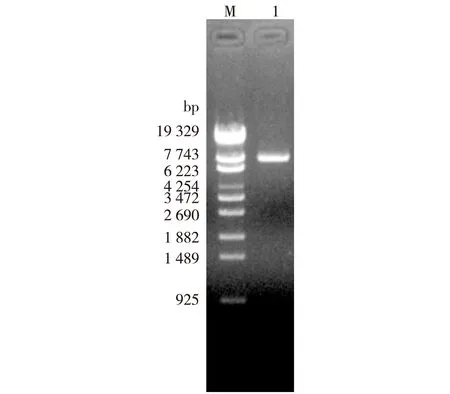
M—λ-EcoT14 I digest DNA Marker;1—pXMJ19-xylA(+)/EcoR I图2 表达重组子pXMJ19(+)-xylA的酶切鉴定Fig.2 EcoRI digest of recombinant plasmid pXMJ19-xylA(+)
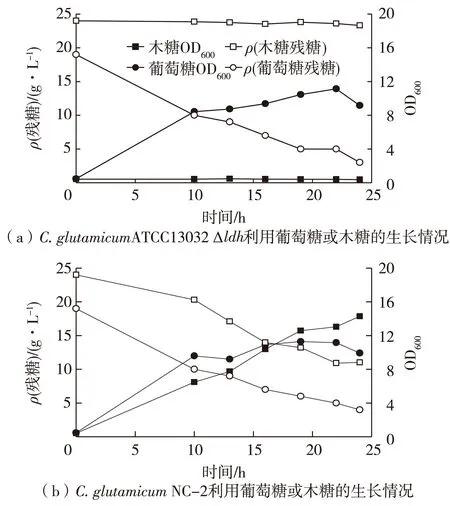
图3 C.glutamicum ATCC13032 Δldh和 C.glutamicum NC-2利用葡萄糖或 木糖的生长情况Fig.3 Growth of C. glutamicum ATCC13032 Δldh and C. glutamicum NC-2 strain in mineral medium containing either glucose or xylose
由图3可知:在好氧条件下,重组菌株C.glutamicumNC-2与对照菌株C.glutamicumATCC13032 Δldh利用葡萄糖的生长情况大致相同,但是在以木糖为唯一C源的培养基中生长时,对照菌株C.glutamicumATCC13032 Δldh不能有效地利用木糖生长,而重组菌株C.glutamicumNC-2经过24 h的培养后其菌体生长量超过其利用葡萄糖的菌体水平,木糖的消耗速率达到0.54 g/(L·h),略低于葡萄糖(0.62 g/(L·h)),经检测重组菌木糖异构酶比酶活约为0.54 U/mL。表明xylA的基因表达使菌株C.glutamicumATCC13032 Δldh具有利用木糖生长的能力,拓宽了其底物利用范围。
2.4 重组菌株C.glutamicum NC-2利用混合糖的生长情况
在添加12 g/L木糖和14 g/L葡萄糖的BT发酵培养基中,30 ℃、200 r/min有氧培养36 h,考察重组菌株C.glutamicumNC-2利用混合糖的生长情况,结果如图4所示。
由图4可知:在混合糖发酵过程中,重组菌株首先利用葡萄糖,在发酵24 h时,葡萄糖几乎被消耗完,而木糖为9.8 g/L,仅消耗了15%,发酵至36 h时,60%的木糖被利用,该结果表明,由于碳代谢阻遏效应的存在[13-14],菌株不能够同时对葡萄糖和木糖进行利用。

图4 C.glutamicum NC-2利用混合糖的生长情况Fig.4 Growth of C.glutamicum NC-2 strain in mineral medium containing mixed sugar
2.5 重组菌株C.glutamicum NC-2的两阶段发酵情况
为了考察重组菌株利用木糖生产有机酸的情况,本研究采用两阶段发酵模式,即利用添加20 g/L木糖的100 mL A培养基,30 ℃、200 r/min培养18 h进行好氧发酵,然后通过添加40 g/L木糖的50 mL BT培养基,30 ℃、150 r/min培养18 h进行厌氧发酵产酸,结果如表1所示。
由表1可知:对照菌株C.glutamicumATCC13032 Δldh不能够以木糖作为唯一C源生产有机酸,而重组菌株C.glutamicumNC-2在厌氧条件下发酵18 h内,可消耗(26.0±0.08)g/L木糖,发酵产物主要是琥珀酸,其收率可达到(0.62±0.003)g/g,与对照菌株相同条件下消耗葡萄糖发酵结果大致相同。
在谷氨酸棒杆菌中,运输己糖主要通过磷酸转移酶系统[15],但是机制尚不清楚,对于其他革兰氏阳性菌中戊糖转运的机制已有报道[16]:比如,突变的枯草芽胞杆菌通过AraE蛋白运输木糖,自身的H+同向运输载体负责阿拉伯糖的转运[17];几种重组的酿酒酵母菌株通过非特异性的单糖运输系统吸收木糖,但是对木糖的亲和力比葡萄糖低将近200倍[18]。本研究则通过表达xylA基因实现了谷氨酸棒杆菌对木糖的利用,表明在谷氨酸棒杆菌中存在与木糖吸收有关的运输载体。

表1 菌株两阶段发酵结果Table 1 Results of two-stage fermentation
3 结 论
以拓宽谷氨酸棒杆菌底物利用谱进行有机酸发酵为目标,将E.colixylA基因成功构建到诱导型表达载体pXMJ19,酶活测定证明转入C.glutamicumATCC13032 Δldh中的酶基因得到了活性表达。实验表明,该工程菌株C.glutamicumNC-2可以在木糖为唯一C源的培养基中进行生长,培养24 h后的菌体生长量与利用葡萄糖的菌体水平基本相同,木糖的消耗速率达到0.54 g/(L·h),与葡萄糖消耗速率相比略低。在添加葡萄糖和木糖的BT培养基中发酵时,重组菌优先利用葡萄糖,在葡萄糖完全消耗后开始有效利用木糖,以木糖为唯一C源进行两阶段发酵时,产物主要为琥珀酸,收率为(0.62±0.003)g/g。木糖异构酶对于木糖利用起着极为重要的作用。
[1] Gong C S,Cao N J,Du J,et al.Ethanol production from renewable resource[J].Adv Biocehm Eng/Biotechnol,1999,65:207-241.
[2] 张颖,马瑞强,洪浩舟,等.重组运动发酵单胞菌的构建及木糖利用特性研究[J].生物技术通报,2009(7):160-165.
[3] Kawaguchi H,Sasaki M,Vertès A A,et al.Engineering of anL-arabinose metabolic pathway inCorynebacteriumglutamicum[J].Appl Microbiol Biotechnol,2008,77(5):1053-1062.
[4] Cheung S W,Anderson B C.Laboratory investigation of ethanol production from municipal primary waste water solids[J].Bioresour Technol,1997,59:81-96.
[5] Sakai S,Tsuchida Y,Okion S,et al.Effect of lignocellulose-derived inhibitors on growth of and ethanol production by growth-arrestedCorynebacteriumglutamicumR[J].Appl Environ Microbiol,2007,73(7):2349-2353.
[6] Blombach B,Seibold G M.Carbohydrate metabolism inCorynebacteriumglutamicumand applications for the metabolic engineering ofL-lysine production strains[J].Appl Microbiol Biotechnol,2010,86(5):1313-1322.
[7] Sasaki M,Jojima T,Inui M,et al.Simultaneous utilization ofD-cellobiose,D-glucose,andD-xylose by recombinantCorynebacteriumglutamicumunder oxygen-deprived conditions[J].Appl Microbiol Biotechnol,2008,81(4):691-699.
[8] 萨姆布鲁克 J,拉塞尔D W.分子克隆实验指南[M].3版.北京:科学出版社,2002.
[9] 余秉琦,沈徽,诸葛健.适用于异源DNA高效整合转化的谷氨酸棒杆菌电转化法[J].中国生物工程杂志,2005,25(2):78-81.
[10] Dische Z,Borenfreund E.A new spectrophotometric method for the detection anddetermination of keto sugars and trioses[J].J Biol Chem,1951,912:583-587.
[11] 宁正祥.食品成分分析手册[M].北京:中国轻工业出版社,1998.
[12] Liu R,Liang L,Chen K,et al.Fermentation of xylose to succinate by enhancement of ATP supply in metabolically engineeredEscherichiacoli[J].Appl Microbiol Biotechnol,2012,94(4):959-968.
[13] Magasanik B.Catabolite repression[J].Cold Spring Harbor Symp Quant Biol,1961,26:249-256.
[14] Deutscher J.The mechanisms of carbon catabolite repression in bacteria[J].Curr Opin Microbiol,2008,11(2):87-93.
[15] Kotrba P,Inui M,Yukawa H.TheptsI gene encoding enzyme I of the phosphotransferase system ofCorynebacteriumglutamicum[J].Biochem Biophys Res Commun,2001,289:1307-1313.
[16] Stülke J,Hillen W.Regulation of carbon catabolism inBacillusspecies[J].Annu Rev Microbiol,2000,54:849-880.
[17] Krispin O,Allmansberger R.TheBacillussubtilisAraE protein displays a broad substrate specificity for several different sugars[J].J Bacteriol,1998,180:3250-3252.
[18] Hamacher T,Becher J,Gárdonyi M,et al.Characterization of the xylose-transporting properties of yeast hexose transporters and their influence on xylose utilization[J].Microbiol,2002,148:2783-2788.
(责任编辑 荀志金)
Construction of xylose-utilizing recombinant Corynebacterium glutamicum strain
ZHANG Hengli,CAI Heng,WANG Chen,ZHANG Kai,ZHOU Zhihui
(College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
In order to construct a strain ofCorynebacteriumglutamicumby using the xylose to produce organic acids,thexylAgene fromEscherichiacoliK-12,encoding xylose isomerase,was integrated in the expression vector of pXMJ19.The gene was expressed in theCorynebacteriumglutamicumATCC13032 Δldhstrain.The recombinant strain was capable of growth on xylose as a sole carbon source,the xylose consumption rate was 0.54 g/(L·h).The xylose isomerase activity reached 0.54 U/mL.In medium containing glucose and xylose,the recombinant strain consumed glucose first,after the glucose was consumped entirely,the effective utilization of xylose was started.The yield of succinate was (0.62±0.003) g/g during the two-stage fermentation on xylose as a sole carbon source.
Corynebacteriumglutamicum;succinic acid;xylA;xylose
10.3969/j.issn.1672-3678.2014.02.006
2012-10-30
国家重点基础研究发展计划(973计划)(2011CB707405)
张恒丽(1985—),女,河北邢台人,硕士研究生,研究方向:微生物学,基因工程;蔡 恒(联系人),副教授,E-mail:cheng@njtech.edu.cn
Q786
A
1672-3678(2014)02-0028-05

