脑小血管病的病变分布特征与临床表现关系的研究
高天理,刘春洁,李 颖
脑小血管病(cerebral small vessel disease,CSVD)是指各种病因引起的直径50~400 μm的脑小动脉、微动脉、小静脉和毛细血管的一组病理过程,被认为是最常见的神经系统疾病。主要累及皮层下结构,表现为腔隙性脑梗死(lacunar infarcts,LI)、脑白质病变(white matter lesions,WMLs)、脑微出血(cerebral microbleeds,CMBs)和血管周围间隙扩大。由于CSVD早期常常无症状,一直被忽视,随着MRI的广泛应用,发现人群中CSVD比较常见,其结果可导致皮质下血管性痴呆(vascular dementia,VaD)、头晕、步态不稳、尿便障碍等症状,是中老年人残疾的常见原因[1]。对CSVD进行早期诊断和治疗,有利于控制和逆转病变发展。本研究收集了145例CSVD患者的临床资料,探讨病变分布特征与临床表现之间的关系。
1 对象与方法
1.1 研究对象 选择2012年6月—2013年3月在北京安贞医院神经内科以LI、头晕、步态不稳住院且经颅脑MRI证实的CSVD患者共145例,其中男76例,女69例;年龄52~78岁,平均年龄(67±6)岁;既往有高血压者119例,糖尿病者83例,卒中和短暂性脑缺血发作(TIA)史者55例。排除标准:(1)多发性硬化、一氧化碳中毒、严重的睡眠呼吸暂停综合征等特定原因所引起的影像学改变;(2)大面积脑梗死;(3)反复脑出血史;(4)恶性肿瘤病史;(5)颅内、外动脉重度狭窄病史;(6)痴呆病史。
1.2 研究方法
1.2.1 颅脑MRI检查方法及CSVD病变特征 所有患者采用颅脑MRI检查符合以下CSVD病变特征[1]。
颅脑MRI检查方法:采用3.0 T超导磁共振成像系统(Verio;Siemens,Erlangen,Germany),8通道相控阵头颅线圈。患者均接受轴位快速自旋回波(FSE)T1WI、自旋回波(SE)T2WI、T2液体衰减反转恢复(fluid-attenuated inversion recovery,FLAIR)序列。扫描参数:轴位FSE T2WI(TR 4 300 ms,TE 120 ms,TE 120 ms),SE T1WI(TR 450 ms,TE 140 ms),T2FLAIR(TR 8 000 ms,TE 140 ms,TI 2 100 ms),FOV 24 cm×24 cm,矩阵256×256,扫描层厚5.0 cm,层间距1.0 cm。
CSVD病变特征:(1)WMLs:FLAIR和T2WI皮层下白质呈高信号改变,T1WI没有突出的低信号表现。所有受试者年龄相关脑白质改变(age-related white matter changes,ARWMC)评分[2]:每侧大脑半球均划分为5 个区域,即额叶、顶枕叶、颞叶、幕下区域(包括小脑和脑干)和基底节区(包括纹状体、苍白球、丘脑、内囊、外囊、岛叶),每一区域均单独评分,分为0~3分,共4级。0分,无损害;1分,局限性损害;2分,初始融合损害;3分,弥漫性融合损害。对于基底节区,0分,无损害;1分,1个局限性损害;2分,局限性损害病灶>1个;3分,融合性损害。最终评分为双侧大脑半球各个脑区评分的总和(0~30分)。依据ARWMC总评分将患者分为轻度组(1~5分)、中度组(6~10分)和重度组(>10分)。(2)LI:T1WI上局灶性低信号和T2WI高信号,直径<15 mm。幕上及幕下(皮质下、基底节、丘脑、脑干和小脑)LI的数目>2个,表现为多发腔隙状态。(3)扩张的周围血管间隙:穿通血管周围的空间扩大,<1×2 mm,特征是边界光滑清楚,呈圆形或线形(由于部位和切面不同),与穿通动脉的走行相一致,在MRI的T1WI、T2WI和FLAIR序列上与脑脊液信号一致,均为低信号改变。
1.2.2 资料采集方法及诊断标准 一般资料采集包括性别、年龄;病史采集包括高血压、糖尿病、既往卒中和TIA、认知功能减退、步态障碍、头晕和眩晕及尿失禁等。
诊断标准:(1)高血压:患者已在进行降压治疗或2次不同日收缩压>140 mm Hg(1 mm Hg=0.133 kPa),舒张压>90 mm Hg。(2)糖尿病:空腹血糖≥7.0 mmol/L(126 mg/dl)或餐后2 h血糖≥11.1 mmol/L(200 mg/dl);随机血糖≥11.1 mmol/L(200 mg/dl),糖化血红蛋白(HbA1c)≥6.5%。(3)既往卒中和TIA:卒中为符合国立神经疾病和卒中研究所(NINDS)标准的连续的卒中相关症状并被影像学检查证实。TIA为根据NINDS标准,24 h内有卒中相关症状而影像学正常。(4)认知功能评价:采用简易智能状态检查量表(MMSE)和蒙特利尔认知评价量表(MoCA,中文版)对患者进行认知功能的评价。其中,MMSE总评分为30分,>28分者为正常;MoCA总评分为30分,>26分者为正常。轻度认知损害(MCI)的诊断标准参考美国精神障碍诊断与统计手册第4版(DSM-Ⅳ)中轻度认知损害研究所采用的诊断标准:①有记忆力减退的主诉;②有轻度认知损害的客观检查证据,MMSE评分受教育程度为中学及以上者<24分,小学<20分,文盲<17分。(5)步态障碍:表现为行走困难、步态笨拙,行走或转身时平衡障碍,无小脑性共济失调和深感觉损害。(6)头晕和眩晕:定义为运动错觉,为头晕目眩、失去平衡或不稳定的感觉,行走和站立时明显。通过仔细询问病史、颅内外动脉检查和耳鼻喉科会诊,排除后循环缺血和前庭周围性眩晕。(7)尿失禁:定义为排尿自控能力受损,使尿液不自主地流出。仔细鉴别病史,排除非中枢性尿失禁的原因。
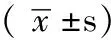
2 结果
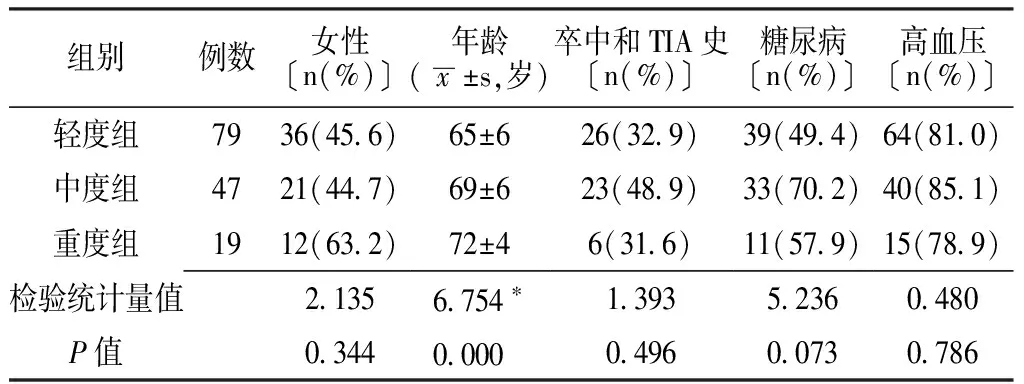
2.1 不同ARWMC评分组临床资料的比较 将145例CSVD患者按ARWMC评分分为3组:轻度组79例,中度组47例,重度组19例。3组的性别及卒中和TIA史、糖尿病、高血压患病率比较,差异无统计学意义(P>0.05);年龄比较,差异有统计学意义(P<0.05,见表1)。
2.2 不同病变部位者临床症状的比较 不同病变部位的CSVD患者的轻度认知损害、卒中和TIA史、头晕和眩晕、步态障碍的发生率比较,差异均有统计学意义(P<0.05);尿失禁发生率比较,差异无统计学意义(P>0.05,见表2)。
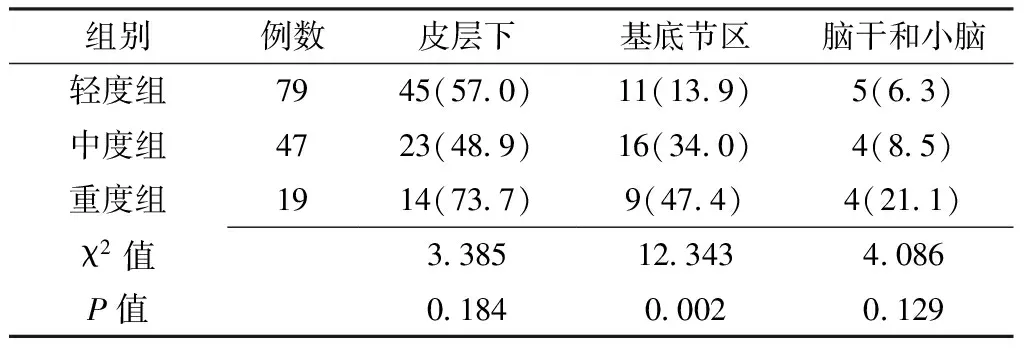
2.3 不同ARWMC评分组病变发生率比较 不同ARWMC评分组的基底节区病变发生率比较,差异有统计学意义(P<0.05);皮层下、脑干和小脑病变发生率比较,差异无统计学意义(P>0.05,见表3)。CSVD患者的影像学特点见图1。
表1 不同ARWMC评分组临床资料的比较
Table1 The comparison of clinical data among the different ARWMC score groups
组别例数女性〔n(%)〕年龄(x±s,岁)卒中和TIA史〔n(%)〕糖尿病〔n(%)〕高血压〔n(%)〕轻度组7936(45 6)65±626(32 9)39(49 4)64(81 0)中度组4721(44 7)69±623(48 9)33(70 2)40(85 1)重度组1912(63 2)72±46(31 6)11(57 9)15(78 9)检验统计量值2 1356 754∗1 3935 2360 480P值0 3440 000 0 4960 0730 786
注:ARWMC=年龄相关脑白质改变,TIA=短暂性脑缺血发作;*为t值,余检验统计量值为χ2值

表2 不同病变部位者临床症状的比较〔n(%)〕
表3 不同ARWMC评分组病变发生率比较〔n(%)〕
Table3 The comparison of lesion rate among the different ARWMC score groups
组别例数皮层下基底节区脑干和小脑轻度组7945(57 0)11(13 9)5(6 3)中度组4723(48 9)16(34 0)4(8 5)重度组1914(73 7)9(47 4)4(21 1)χ2值3 38512 3434 086P值0 1840 0020 129

注:A-B:颅脑MRI(T1,T2WI)显示基底节区扩张的周围血管间隙和腔隙性脑梗死;C-E:脑白质病变/腔隙性脑梗死在小脑、脑干和皮层下的分布特征
图1 脑小血管病患者的影像学特点
Figure1 The imaging features of cerebral small vessel disease patients
3 讨论
本研究结果发现,无论疾病严重程度,CSVD患者患高血压较普遍。ARWMC评分重度组的患者年龄较大,以高龄患者为主。进一步证实了高血压和年龄是CSVD的主要危险因素。
CSVD的主要发病机制可以解释上述特点,即脑小血管内皮细胞紧密连接构成了血脑屏障的核心部位,其主要功能是血液运输、血管舒缩调节、细胞间液生成及回流。研究表明,高血压引起脑小血管内皮细胞、平滑肌细胞及其他血管管壁结构的损伤,脑部小穿支动脉和微动脉平滑肌细胞常被纤维透明样物质替代,致使血管壁增厚、管腔狭窄[3],使脑血管舒缩调节的效应器丧失,导致脑血流调节障碍,细胞间液及可溶性物质增加,脑白质区水肿、渗出增加,最终导致脑组织损伤,加重低灌注及缺血,可发生白质疏松和LI[4]。脑白质的血供多源于软脑膜动脉的长穿支动脉,其以直角形式发出短支供应白质。侧脑室壁相邻白质区域的血供来源于室管膜下动脉的脉络膜动脉或纹状体动脉的终末分支(长约15 mm),与来源于脑表血管相互之间的吻合支稀疏或缺如,导致侧脑室壁周围3~10 mm范围成为白质区域的“远端供血区”,即动脉供血的分水岭区,即白质病变的好发部位[5]。研究证实,高血压与缺血性WMLs的风险增高有关,血压控制差的高血压患者发生缺血性WMLs的风险比控制好的患者高,血压控制好的高血压患者发展为重度WMLs的风险降低[6]。
由于CSVD常常无症状,其LI和白质病变常通过影像学检查发现,而小血管的形态不能被检测,所以CSVD长期被用来描述脑实质病变而不是潜在的小血管改变。目前认为CSVD的诊断和治疗中,神经影像可能作为一个替代标记物[7]。研究表明影像学证实的WMLs的发病率和严重程度与年龄的增长呈正相关,年龄和WMLs的关系独立于其他血管病危险因素。年龄每增加10岁,WMLs的发生率增加1倍,在65岁以上的老年人中,WMLs的发生率可以达到27%~87%,其卒中发生率为11.1%,LI的发生率为6%~20%[8]。老化性白质区的弥漫脱髓鞘可引起小血管周围间隙扩大继而引发WMLs、脑皮质萎缩,临床表现为进行性的认知功能下降。其次,老年人常合并糖尿病、高血压等,这些也可以导致脑内小动脉硬化。血压变异引起白质慢性缺血,脑内血管舒缩调节功能存在个体差异,这些可能导致患者白质病变的范围有大有小,但最终至少在3个方面有重要作用:反复卒中、痴呆和致残[9]。
以往有关CSVD的研究表明,无症状卒中和TIA[10]、步态不稳[11]、尿失禁[12]及认知功能减退[13-14]与WMLs和LI有关。本研究发现,CSVD患者最普遍的症状是进行性认知功能减退、步态障碍、卒中和TIA有关的症状,均与以前的研究相似。头晕和眩晕也是CSVD患者的临床表现之一,有此症状的患者在排除了大动脉狭窄所致的供血不足、盗血及前庭功能障碍所致的原因后,应考虑CSVD的可能,而以往仅有少数研究报道了头晕、眩晕和平衡障碍与CSVD的关系,与本研究的观察结果一致[15]。所以,全面认识CSVD的相关临床表现,有利于增强我们对此类疾病的认识,从而提高临床诊断率。
脑微血管病变患者的临床症状和危险因素的研究表明,额叶的WMLs/LI导致更频繁地出现进行性认知功能下降、步态障碍、卒中和TIA相关症状、眩晕及尿失禁。顶枕部的WMLs/LI更易导致TIA、抽搐及大小便失禁。基底节区WMLs/LI与步态障碍、眩晕和尿失禁有关[16]。我们认为WMLs/LI分布特征的重要性应得到重视。本研究结果表明,皮层下WMLs/LI导致更多患者出现认知功能下降、步态障碍、卒中和TIA相关症状、眩晕和尿失禁,与以前的报告一致;而基底节区WMLs/LI与卒中和TIA相关症状、步态障碍有关,与以前的报告不同,可能是由于研究人群不同和病例数目有限的原因。轻、中度组患者幕上和幕下区多呈局灶性病变;重度组患者的分布范围最广,皮层下和基底节区病变大多是融合病灶。不同程度患者的病变均主要发生在皮层下;重度组病变除主要发生在皮层下(73.7%)外,还累及基底节区(47.4%),累及幕下结构(21.1%)也较轻、中度组多;中度组以皮层下(48.9%)和基底节区(34.0%)病变为主。
总之,CSVD并不是简单的良性病变,而是一类潜在的严重性疾病。与大血管病不同,CSVD更易引起皮层下血管性痴呆,其长期预后差,从发病机制和临床特点到治疗都存在挑战,并且目前治疗效果欠佳,CSVD症状识别和诊断以及预防和治疗战略应是一个主要的目标,临床上应充分认识和辨别CSVD所有的临床表现类型和并发症[17],正确的降压治疗可延缓脑损伤,改善临床症状。此外,对MRI诊断的无症状CSVD的早期预防更加重要,研究表明35%的高血压患者脑损伤实际上是无症状的。培哚普利保护防止卒中复发研究(PROGRESS)的数据显示,积极降压可阻止或延缓CSVD患者WMLs的进展,以防止脑实质的小损伤转变为严重损伤及不良后果[18]。
1 周桂娟.蒙特利尔认知评估量表在脑小血管病中的筛查应用[J].河北医药,2011,33(10):1486.
2 Wahlund LO,Barkhof F,Fazekas F,et al.A new rating scale for age-related white matter changes applicable to MRI and CT[J].Stroke,2001,32(6):1318-1322.
3 Pantoni L,Garcia JH.Pathogenesis of leukoaraiosis:A review[J].Stroke,1997,28(3):652-659.
4 Wong TY,Sharrett AR,Couper DJ,et al.Cerebral white matter lesions,retinopathy,and incident clinical stroke[J].JAMA,2002,288(1):67-74.
5 Brittain JF,McCabe C,Khatun H,et al.An MRI-histological study of white matter in stroke-free SHRSP[J].J Cereb Blood Flow Metab,2013,33(5):760-763.
6 Liu W,Liu R,Sun W,et al.Different impacts of blood pressure variability on the progression of cerebral microbleeds and white matter lesions[J].Stroke,2012,43(11):2916-2922.
7 Patel B,Markus HS.Magnetic resonance imaging in cerebral small vessel disease and its use as a surrogate disease marker[J].Int J Stroke,2011,6(1):47-59.
8 Grueter BE,Schulz UG.Age-related cerebral white matter disease (leukoaraiosis):A review[J].Postgrad Med J,2012,88(1036):79-87.
9 Wardlaw JM,Smith C,Dichgans M.Mechanisms of sporadic cerebral small vessel disease:Insights from neuroimaging[J].Lancet Neurol,2013,12(5):483-497.
10 Lim TS,Hong JM,Lee JS,et al.Induced-hypertension in progressing lacunar infarction[J].J Neurol Sci,2011,308(1/2):72-76.
11 Iseki K,Hanakawa T,Hashikawa K,et al.Gait disturbance associated with white matter changes:A gait analysis and blood flow study[J].Neuroimage,2010,49(2):1659-1666.
12 Poggesi A,Pracucci G,Chabriat H,et al.Urinary complaints in nondisabled elderly people with age-related white matter changes:The Leukoaraiosis And DISability (LADIS) Study[J].J Am Geriatr Soc,2008,56(9):1638-1643.
13 Kuyumcu ME,Yesil Y,Yavuz BB,et al.Relationship between blood pressure and physical and cognitive function in the oldest old[J].J Am Geriatr Soc,2013,61(5):828-829.
14 Henskens LH,van Oostenbrugge RJ,Kroon AA,et al.Detection of silent cerebrovascular disease refines risk stratification of hypertensive patients[J].J Hypertens,2009,27(4):846-853.
15 Hainsworth AH,Brittain JF,Khatun H.Pre-clinical models of human cerebral small vessel disease:Utility for clinical application[J].J Neurol Sci,2012,322(1/2):237-240.
16 Okroglic S,Widmann CN,Urbach H,et al.Clinical symptoms and risk factors in cerebral microangiopathy patients[J].PLoS One,2013,8(2):e53455.
17 Debette S,Markus HS.The clinical importance of white matter hyperintensities on brain magnetic resonance imaging:Systematic review and meta-analysis[J].BMJ,2010,341:c3666.
18 Sierra C,López-Soto A,Coca A.Connecting cerebral white matter lesions and hypertensive target organ damage[J].J Aging Res,2011,2011:438978.

