原发性肺类癌患者的临床特征和预后研究
刘广杰,刘庆熠,解少男,孟宪利,王洪琰,卢永昌
原发性肺类癌是原发性肺癌中较少见的一种病理类型,占原发性肺部肿瘤的1%~2%[1],占全部类癌的10.2%~11.5%。原发性肺类癌与肺大细胞癌、小细胞癌一样,也起源于支气管肺黏膜的神经内分泌Kulchitsky细胞,是一种神经内分泌肿瘤,其病理类型分为典型类癌(typical carcinoid,TC)与非典型类癌(atypical carcinoid,AC)。临床上对肺类癌相关研究较少,本研究对经手术病理证实的31例原发性肺类癌患者的临床资料进行分析,研究其临床特点、治疗方法和预后影响因素。
1 资料与方法
1.1 一般资料 回顾性分析河北医科大学第四医院2002年5月—2012年5月经手术切除及术后病理确诊的31例原发性肺类癌患者的临床资料。其中TC 14例(45.2%),AC 17例(54.8%);男14例(45.2%),女17例(54.8%);年龄31~74岁,中位年龄54岁。10例(32.3%)患者有吸烟史,均为男性,21例(67.7%)无吸烟史;以咳嗽、咳痰为首发症状者20例(64.5%)(其中刺激性干咳5例,咳痰6例,痰中带血9例),胸痛2例(6.5%),心前区疼痛1例(3.2%),其余8例(25.8%)查体发现;病程5 d~3年,平均病程40 d。
1.2 肿瘤特征 瘤体位于左肺上叶9例(29.0%),左肺下叶6例(19.4%),左主支气管1例(3.2%),右肺上叶4例(12.9%),右肺中叶3例(9.7%),右肺下叶8例(25.8%);中心型肺类癌20例(64.5%),周围型肺类癌11例(35.5%);瘤体最大径为2~18 cm,平均最大径为4.3 cm。19例术前行纤维支气管镜检查,16例镜下可见新生物,并予以咬检。病理确诊8例,黏膜增生1例,黏膜慢性炎症2例,镜下可见异形细胞2例,未证实2例,诊断错误1例(诊断为小细胞癌)。
1.3 治疗方法 31例患者均行手术治疗,以肺叶切除为主。左肺上叶切除术8例,左肺上叶切除+左肺下叶支气管袖状成形术1例,左肺下叶切除术6例,左全肺切除术1例,右肺上叶切除术4例,右肺下叶切除术4例,右肺中下叶切除术6例,右肺中叶楔形切除术1例。2例行术前化疗,13例行术后辅助治疗(其中12例行术后化疗,1例行术后放疗)。全组手术患者30例行根治性肺叶切除手术伴淋巴结清扫术;1例患者肺功能较差,仅行肺叶楔形切除术,未行周围淋巴结清扫。
1.4 术后病理 根据肺部肿瘤的WHO分类(2004)[2]进行病理分型,TC 14例(45.2%),AC 17例(54.8%)。伴有淋巴结转移的患者共计7例(22.6%),其中TC 3例,AC 4例。全组共计清扫淋巴结276个,平均8.9个,转移淋巴结18个,淋巴结转移度为6.5%(18/276)。根据TNM分期(2011)进行肿瘤病理分期,其中Ⅰ期18例(58.1%),Ⅱ期9例(29.0%),Ⅲ期4例(12.9%),Ⅳ期0例。
1.5 随访及预后 生存期自手术日期至末次随访日或死亡日。随访截止至2013-02-01。生存期最短8个月,最长122个月,中位生存时间61个月,平均生存时间55.2个月。
1.6 统计学方法 采用SPSS 13.0软件对数据进行分析,采用Kaplan-meier计算生存率及绘制生存曲线,采用log-rank法比较不同时间段生存率的差异;患者预后影响因素采用Cox比例风险回归模型进行分析。检验水准为α=0.05。
2 结果
2.1 总生存率 患者术中及围术期无人死亡。31例患者总体1年、3年及5年生存率分别为90.3%(28/31)、67.7%(21/31)及54.8%(17/31)(见图1)。其中TC生存率分别为92.9%(13/14)、85.7%(12/14)及78.6%(11/14);AC生存率分别为100.0%(17/17)、52.9%(9/17)及35.3%(6/17)。淋巴结转移组和无淋巴结转移组的5年生存率分别为28.6%(2/7)和58.3%(14/24),见表1。

图1 31例原发性肺类癌患者术后生存曲线
Figure1 Survival curve of 31 patients with primary pulmonary carcinoid after operation
2.2 不同临床特征患者生存率分析 不同年龄、性别、肿瘤位置、术后是否辅助治疗以及有无吸烟史的患者生存率差异均无统计学意义(P>0.05);肿瘤瘤体最大径≤3cm组与>3cm组的患者生存率差异有统计学意义(P<0.05);周围淋巴结转移与无淋巴结转移患者生存率差异有统计学意义(P<0.05);TC与AC患者生存差异有统计学意义(P<0.05);病理分期I期和II期+III期患者生存率差异有统计学意义(P<0.05,见表 1)。
表1 不同临床特征患者的生存率比较
Table1 Comparison of survival rate in different clinical characteristics patients
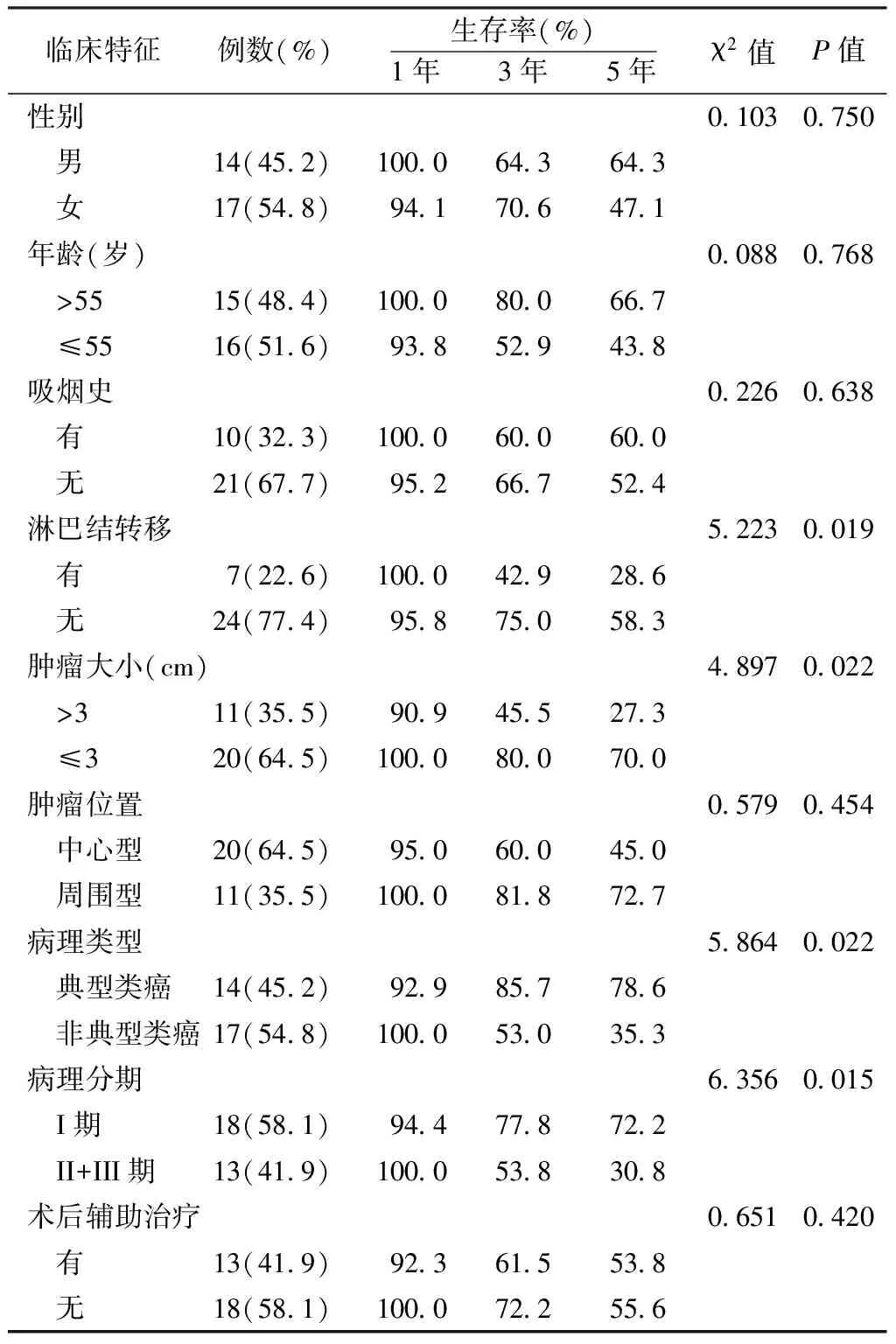
临床特征例数(%)生存率(%)1年 3年 5年χ2值P值性别0 1030 750 男14(45 2)100 064 364 3 女17(54 8)94 170 647 1年龄(岁)0 0880 768 >5515(48 4)100 080 066 7 ≤5516(51 6)93 852 943 8吸烟史0 2260 638 有10(32 3)100 060 060 0 无21(67 7)95 266 752 4淋巴结转移5 2230 019 有7(22 6)100 042 928 6 无24(77 4)95 875 058 3肿瘤大小(cm)4 8970 022 >311(35 5)90 945 527 3 ≤320(64 5)100 080 070 0肿瘤位置0 5790 454 中心型20(64 5)95 060 045 0 周围型11(35 5)100 081 872 7病理类型5 8640 022 典型类癌14(45 2)92 985 778 6 非典型类癌17(54 8)100 053 035 3病理分期6 3560 015 I期18(58 1)94 477 872 2 II+III期13(41 9)100 053 830 8术后辅助治疗0 6510 420 有13(41 9)92 361 553 8 无18(58 1)100 072 255 6
2.3 原发性肺类癌患者预后的单因素分析 结果显示病理分期(χ2=5.677,P=0.015)、病理类型(χ2=5.230,P=0.022)、肿瘤大小(χ2=4.566,P=0.022)与周围淋巴结转移(χ2=5.182,P=0.019)是预后的可能影响因素(见表 2 )。
2.4 原发性肺类癌患者预后的多因素分析 结果显示肿瘤病理类型(χ2=8.309,P=0.004)和病理分期(χ2=9.008,P=0.003)是预后的独立影响因素(见表 3)。
表2 31例原发性肺类癌患者预后的单因素分析
Table2 Single factor analysis of prognosis of 31 patients with primary pulmonary carcinoid

变量b Sbχ2值RR值95%CIP值性别0 1550 4570 1011 168(0 450,3 032)0 750年龄0 1450 4940 0871 156(0 439,3 044)0 768吸烟史-0 2510 5350 2210 778(0 272,2 220)0 638肿瘤位置0 3820 5100 5621 466(0 539,3 983)0 454肿瘤大小0 9090 5434 5662 505(0 519,4 365)0 022淋巴结转移1 0480 5965 1823 011(0 595,6 145)0 019辅助治疗-0 4310 5340 6510 650(0 228,1 851)0 420病理类型1 1700 5125 2303 223(1 182,8 788)0 022病理分期1 2270 5365 6773 586(1 254,10 252)0 015
表3 31例原发性肺类癌患者预后的多因素分析
Table3 Munivariate analysis of prognosis of 31 patients with primary pulmonary carcinoid

变量bSbχ2值RR值95%CIP值病理类型1 7110 5948 3095 535(1 729,17 719)0 004病理分期1 9280 6429 0086 878(1 952,24 227)0 003
2.5 不同预后独立影响因素分组患者的生存曲线 TC与AC患者生存曲线见图2;病理分期I期与II +III期患者生存曲线见图3。
2.6 CT表现 中心型肺癌类20例,周围型肺类癌11例。13例呈圆形或类圆形的孤立性软组织结节影,边缘光滑,界清;6例形状不规则;8例伴有阻塞性肺炎、肺不张;4例呈分叶状。纵隔窗测量肿瘤直径1.5~15 cm,平均4.0 cm。10例病灶处可见钙化点。20例患者行胸部增强扫描,肿瘤CT值上升幅度30.7~61.0 Hu不等,平均上升45.6 Hu。图4为1例右肺下叶中心型TC患者的CT资料,直径大约4 cm,瘤体平均CT值43.1 Hu,注射造影剂后瘤体可见明显强化,平均CT值升至97.1 Hu,上升54.0 Hu。

图2 14例典型类癌与17例非典型类癌患者的生存曲线
Figure2 Different survival curve between 14 patients with typical primary pulmonary carcinoid and 17 patients with atypical primary pulmonary carcinoid

图3 18例I期与13例Ⅱ、Ⅲ、Ⅳ期肺类癌患者的生存曲线
Figure3 Different survival curve between 18 patients in stage I and 13 patients in stage II,III,IV

注:A:右肺下叶中心型肺典型类癌合并肺不张和阻塞性肺炎;B:肺典型类癌注射强化剂前CT表现;C:肺典型类癌注射强化剂后CT表现
图4 CT表现
Figure4 CT performance
2.7 TC与AC光镜下观察结果 本研究14例TC标本光镜下可见癌细胞较小,大小形状一致,细胞核位于中央,圆形或卵圆形,核分裂罕见或没有。癌细胞通常向前排列形成实性片块,或呈实性条索,小梁状,带状或巢状混合存在。小的腺样或菊形团样结构多见,间质富于毛细血管,可见淀粉样沉着,瘤体界限清晰(见图5)。

图5 肺典型类癌病理切片表现(苏木素-伊红染色法 10×40)
Figure5 The observation of pathological section of pulmonary typical carcinoid tumor(Hematoxylin-eosin staining 10×40)
本研究17例AC标本光镜下可见癌细胞较小,排列呈巢,或条索、小梁状,具有器官样结构,腺样或菊形团样结构较TC少见,有的癌巢周边部细胞呈栅栏状,癌巢中央常见有灶性坏死。癌细胞核具有多形性,形状不规则,梭型细胞常见,核较深染,分裂多见。间质亦富于毛细血管,可见淀粉样沉着,瘤体界限不如TC清晰(见图6)。

图6 肺非典型类癌病理切片表现(苏木素-伊红染色法 10×40)
Figure6 The observation of pathological section of pulmonary atypical carcinoid tumor (Hematoxylin-eosin staining 10×40)
3 讨论
原发性肺类癌发病率较低,文献报道占肺原发恶性肿瘤的1%左右,占全部类癌的10.2%~11.5%[2]。根据肺部肿瘤的WHO组织学分型(2004),原发性肺类癌分为TC、AC,AC比TC具有更高的临床侵袭性。本组病例中共有原发性肺类癌患者31例,占同期住院手术的肺原发恶性肿瘤患者的0.69%(31/4 492),TC患者与AC患者比为14∶17,远低于Fink等[3]报道的90∶10,AC患者明显较多,与文献报道差异较大。有报道说由于环境污染的不断加剧,AC的发病率有上升趋势。但本研究样本数较小,其发病率与环境污染的相关性有待于大样本的流行病学调查。
肺类癌患者群的男女比例报告不一致[3-4],本研究男14例(45.2%),女17例(54.8%),比例基本相近。Cox比例风险回归模型单因素及多因素分析显示男性组与女性组的患者生存率无差异,可知性别不是影响肺类癌患者术后生存率的影响因素。相较于其他类型的肺癌,肺类癌的发病年龄普遍较小,本组患者发病年龄31~74岁,中位年龄仅54岁。Schrevens等[5]报道肺AC的平均发病年龄(51岁)比肺TC的平均发病年龄(43岁)大。本组患者AC的平均发病年龄为53.8岁,TC的平均发病年龄为49.3岁,前者的平均发病年龄比后者大4.5岁,与文献一致,统计学显示年龄与预后无关。本组全部患者中长期吸烟者10例,全部为男性,占总例数的32.3%。单因素及多因素分析显示吸烟史对发病无影响,故本研究推断吸烟可能不是肺类癌的发病影响因素,吸烟与肺类癌的关系并不像吸烟与鳞癌关系那样密切。
原发性肺类癌在临床上分周围型和中心型,由于其起源于支气管及细支气管黏膜上皮下腺体的Kulchitsky嗜银细胞,越靠近中心支气管,K细胞的分布就越多,就越易发生类癌,故临床上以中心型类癌居多[6],本组中心型类癌占64.5%,与既往报道一致。中心型类癌主要症状为咳嗽、咳痰、胸痛、低热,周围型类癌多无症状而于体检时发现。本研究显示肿瘤位置并不是预后影响因素,与陈程等[7]报道不同,有待进一步研究。文献报道肺类癌患者类癌综合征的发病率为1.5%~5%[8],与类癌细胞分泌的生物活性物质在肝脏灭活有关,故类癌综合征更易发生于肝功能异常或癌细胞向肝脏转移的患者[9]。本组中未出现肝转移及肝功能明显异常的患者,这可能是本组病例未出现类癌综合征的原因。
查阅本组患者的术前CT检查,肺类癌多表现为边界清晰的孤立结节,分叶及毛刺少见,钙化率达32.3%。增强CT扫描可见肿瘤均有中等(CT值上升30 Hu)以上的强化,这可能与肺类癌瘤体血运丰富有关[10],但这些特点不足以将其与其他类型的肺癌区分开来。19例行术前气管镜检查,16例镜下可见新生物,予以咬检,仅8例病理确诊为肺类癌,远低于文献报道[11]。病理诊断阳性率低的原因可能是K细胞多分散于上皮细胞层的基底部,类癌瘤体生长的时候表面覆有完整的未受侵的上皮,气管镜咬检只能取到肿物表面的未受侵组织,而不能深达肿瘤组织。术前气管镜检查虽然阳性率低,但仍是必要的,可为手术方案的制定提供依据。
手术为治疗本病的主要手段[12],切除范围取决于肿瘤生长部位、受累的支气管情况。以肺叶或袖式肺叶切除为主要方式,也可行肺段切除、肺楔形切除术。文献报道类癌患者的淋巴结转移率为6%~25%,故应行根治性手术,并在此基础上进行系统的肺门淋巴结及纵隔淋巴结清扫[13]且应根据患者术前的各项检查对患者进行全面的评估,并制定个体化的手术治疗方案。本组全部手术患者中,30例行根治性肺叶切除及系统的淋巴结清扫术,淋巴结转移率为6.5%;1例行肺楔形切除,未清扫周围淋巴结;2例术前行辅助化疗,13例术后行规范放、化疗;辅助治疗对于患者的生存影响仍待大样本的临床总结。
原发性肺类癌生长缓慢,手术切除后预后一般良好。本组患者总的1年、3年及5年生存率分别为90.3%、67.7%及54.8%。这与文献报道的1年生存率80.9%、3年73.5%、5年54.1%相接近[7]。影响预后的因素有:(1)病理类型。相对于TC,AC镜下可见其核分裂像多见,细胞异型性明显,癌巢中央坏死多见,均提示AC分化程度低,恶性程度高,预后差[14],本组病例TC 5年生存率高于AC,Cox风险回归模型多因素分析显示病理类型为生存率的独立影响因素。(2)病理分期。本组资料经Cox风险回归模型多因素分析显示病理分期为预后的独立影响因素。(3)肿瘤大小。单因素分析显示瘤体直径>3 cm与≤3 cm的患者术后生存率有差异,而多因素分析显示其生存率无差异,log-rank检验显示其1年、3年生存率无差异,5年生存率有差异。可知肿瘤瘤体大小并非肺类癌患者术后生存率的独立影响因素,但瘤体大小是影响患者术后生存率的因素之一。(4)淋巴结转移情况。多项研究显示淋巴结转移与否是影响预后的独立危险因素[15-16],本研究显示总体淋巴结转移率为22.6%,与文献一致,Cox比例风险回归模型单因素分析显示淋巴结转移与无淋巴结转移的患者生存率有差异,且log-rank检验显示淋巴结转移与否是影响远期预后的影响因素。(5)术后辅助治疗。多数学者认为肺类癌患者对于放化疗均不敏感[4],有报道肺类癌对于化疗的总反应率为20%,放疗的总反应率仅为22%,远低于其他类型的肺癌[17]。本组患者中,有2例行术前辅助化疗,对比化疗前后影像学检查,瘤体未见明显缩小。本组患者中有9例进行术后辅助放、化疗,单因素及多因素分析显示术后放化疗与术后未放化疗的患者术后生存率无差异,因此本研究认为放化疗对于该病无明显作用。
1 Skuladottir H,Hirsch FR,Hansen HH,et al.Pulmonary neuroendocrine tumors:Incidence and prognosis of histological subtypes.A population-based study in Denmark[J].Lung cancer,2002,37(2):127-135.
2 战忠利,孙蕾娜.WHO 2004年版肺癌组织学分类与临床意义[J].当代医学,2009,15(8):145-147.
3 Fink G,Krelbaum T,Yellin A,et al.Pulmonary carcinoid:Presentation,diagnosis,and outcome in 142 cases in Israel and review of 640 cases from the literature[J].Chest,2001,119(6):1647-1651.
4 吴志权,潘铁成.支气管肺类癌的诊断和外科治疗[J].临床肺科杂志,2010,15(5):683-684.
5 Schrevens L,Vansteenkiste J,Deneffe G,et al.Clinical radiological presentation and outcome of surgically treated pulmonary carcinoid tumours:A long-term single institution experience[J].Lung cancer,2004,43(1):39-45.
6 祁瑾,叶兆祥,肖建宇,等.支气管肺类癌:CT表现与病理对照研究[J].中国肿瘤临床,2007,34(21):1218-1221.
7 陈程,李凯.73例肺类癌的临床特征及预后分析[J].中国肺癌杂志,2009,12(6):582-586.
8 吴强,蔡运昌.类癌、类癌综合征与类癌性心脏病[J].临床心血管病杂志,2006,22(1):55-57.
9 Saqeant JM,Butany J,Cusimano RJ.Cancer of the heart:Epidemiology and management of primary tumors and metastases[J].American Journal of Cardiovascular Drugs,2003,3(6):407-421.
10 Hage R,DeLa Riviere AB,Seldenrijk CA,et al.Update in pulmonary carcinoid tumors:A review article[J].Annals of Surgical Oncology,2003,10(6):697-704.
11 McMullan DM,Wood DE.Pulmonary carcinoid tumors[J].Seminars in Thoracic and Cardiovascular Surgery,2003,15(3):289-300.
12 徐乐天,张志庸.协和胸外科学[M].北京:科学出版社,2010:1121-1122.
13 Filosso PL,Rena O,Donati G,et al.Bronchial carcinoid tumors:Surgical management and long-term outcome[J].Thomc Cardiovosc Surg,2002,123(2):303-309.
14 Scott NP,Kyle H,Rebecca SS,et al.Carcinoid tumors[J].Oncologist,2008,13(12):1255-1269.
15 曾茄,马兵,石平.慢性阻塞性肺疾病合并肺癌的临床研究[J].实用心脑肺血管病杂志,2010,18(12):1819.
16 Garcia YM,Matilla JM,Cueto A,et al.Typical and atypical carcinoid tumors analysis of the experience of the Spanish multi-centric study of neuroendocrine tumors of the lung[J].Eur J Cardiothorae Surg,2007,31(2):192-197.
17 Lori JW,Mark RC,Pasi AJ,et al.Outcome of patients with pulmonary carcinoid tumors receiving chemotherapy or chemo-radiotherapy [J].Lung Cancer,2004,44(2):213-220.

