明胶/聚己内酯纳米纤维电纺膜在表皮组织工程中的应用
吴巍段惠川张文杰曹谊林
A:表皮细胞系在膜片表面接种第1和第7天的扫描电镜图(标尺:200 μm);B:表皮细胞系在膜片表面接种第1和第7天的激光共聚焦荧光图片(标尺:100 μm);C:CCK-8法检测表皮细胞系在膜片表面接种后的增殖情况A:SEM images of HaCaT cells on GT/PCL membrane at day 1 and day 7(Scale bars:200 μm);B:Confocal microscope images of HaCaT cells on GT/PCL membrane at 1st day and 7th day(Scale bars:100 μm);C:Proliferation of HaCaT cell on GT/PCL membrane measured by CCK-8 kit
明胶/聚己内酯纳米纤维电纺膜在表皮组织工程中的应用
吴巍段惠川张文杰曹谊林
目的观察明胶/聚己内酯(GT/PCL)纳米纤维电纺膜应用于表皮组织工程的可行性。方法测定HaCaT细胞(人类表皮细胞系)与电纺膜的生物相容性,并对于接种细胞前后该膜片的机械性能进行评价。应用CCK-8法检测细胞增殖情况。体内研究检测GT/PCL纳米纤维电纺膜构建的组织工程化表皮修复裸鼠皮肤缺损的效果。结果HaCaT细胞能够在膜片上很好地附着和增殖,该膜片具有良好的生物相容性。机械性能测试显示,该膜片具有足够的力学特性以用于移植。体内研究表明,应用GT/PCL纳米纤维电纺膜构建的组织工程化表皮能够修复裸鼠的皮肤缺损。结论GT/PCL纳米纤维电纺膜是一种适合构建组织工程化表皮的支架材料。
表皮组织工程纳米纤维电纺膜明胶聚己内酯
大面积皮肤缺损的治疗常面临供体皮肤不足的问题。皮肤组织工程为此提供了一个新的方向[1]。早期研究中,人们将自体角质形成细胞(KC)进行体外培养扩增,构建形成细胞膜片应用于临床[2]。然而,细胞膜片的机械强度过低,限制了其临床使用。为了提高移植物的机械性能,各种可以支持角质细胞生长的膜片支架材料受到关注[3-6]。支架材料可以是各种天然的基质材料,也可以是各种人工合成的材料,或者是两者结合的产物。
理想的表皮组织工程支架材料,应当首先具有足够的机械性能,以便支撑移植物从培养皿转移至创面;其次,具有良好的生物相容性;另外,支架材料的质量应该是可控的。静电纺丝技术,可以经济便捷地大规模生产出具有良好稳定性的纤薄的纳米纤维膜,为表皮组织工程支架材料提供了可能的解决方案。静电纺纳米纤维具有类似细胞外基质(ECM)的天然形貌特征,可促进细胞的增殖、迁移等功能[7-9]。几种静电纺丝纳米纤维膜已开始应用于表皮组织工程的研究,包括纯天然材料制造或天然材料与人工合成材料的混合物[3,5,10-14]。混合材料充分结合了天然材料和人工合成材料的优点,显示出了具大的应用前景。目前已有应用明胶和聚己内酯相混合的静电纤维电纺膜(GT/PCL静电纤维电纺膜)的报道,其中明胶(GT)的存在,提高了膜片的生物降解性和生物相容性;而聚己内酯(PCL)则提高了膜片的机械性能,该混合材料已用于皮肤和神经组织工程[12-15]。
然而,在GT和PCL的静电纺丝过程中,因两者的亲水性不同,易出现相分离情况,影响纤维的各种性能。在超微结构水平的纤维不均一性可能导致纤维的性能不佳(如机械性能的减弱)[16-18]。为了解决相分离的相关问题,我们在之前的实验中使用了微小量的醋酸(<0.3%)来改善材料的相溶性,使最初的混浊溶液在1周以内能始终保持澄清的单一稳定液相。以此制备的纳米纤维也更薄,表面更光滑,结构均一,显示出良好的亲水性和力学性能[19]。
本研究应用上述改良的GT/PCL静电纤维电纺膜来进行体内与体外实验。体外实验中,我们将HaCaT细胞种植于改良的GT/PCL纳米纤维电纺膜,检测电纺膜的机械性能和生物相容性;体内试验,则通过移植HaCaT电纺膜组、人角质形成细胞电纺膜组和单纯电纺膜组(GT/PCL静电纤维电纺膜组)所构建的组织工程表皮来修复裸鼠皮肤损伤,对改良的GT/PCL静电纤维电纺膜在表皮组织工程的应用价值进行评估。
1 材料与方法
1.1 主要仪器、设备
中性蛋白酶(Roche公司,德国);I型胶原酶(Worthington公司,美国);DMEM培养液、dK-SFM培养液(Gibco公司,美国);HLA-ABC抗体(Abcam公司,美国)。
恒温CO2培养箱(Forma Scientific公司,美国);激光共聚焦显微镜(莱卡公司,德国);冰冻切片机(SHANDON公司,美国);真空冷冻干燥机(Virtis Benchtop公司,美国);FCM(Beckman公司,美国);酶标仪(Thermo公司,美国)。
1.2 GT/PCL膜的制备
将24孔(直径1.56 cm)圆形盖玻片上的材料置于10 cm无菌培养皿中,利用真空冷冻干燥机进行过夜冷冻干燥处理,对GT/PCL纳米纤维电纺膜进行消毒杀菌。次日收集材料,备用。
1.3 HaCaT细胞的扩增
将HaCaT细胞(上海复翔生物)以0.05%胰蛋白酶37℃消化30 sec,DMEM终止消化,吹打细胞,所得细胞悬液1 500 r/min离心5 min,弃上清,DMEM重悬,接种于10 cm培养皿,每3天换液。当细胞汇合达90%,以PBS冲洗细胞,0.05%胰蛋白酶37℃消化30 sec,DMEM终止消化,吹打细胞,所得细胞悬液1 500 r/min离心5 min,弃上清,DMEM重悬,以2.5×104cells/cm2的密度接种于培养皿,每3天换液。
1.4 人角质形成细胞的获取及培养
本研究中所使用的人角质形成细胞取自于小儿包皮环切手术后所废弃的包皮组织(上海儿科医院泌尿外科),患儿年龄6~10岁,均获得患儿家属的知情同意。
将所获得的包皮组织,以氯霉素液冲洗5遍,PBS溶液浸洗2遍,清除皮肤表面的血渍和多余的脂肪组织;将标本分离为0.5 mm×0.5 mm大小,PBS溶液浸洗2遍;使用1 U/mL的配制好的Dispase溶液置于37℃摇床中消化2 h后,分离获得表皮层。并将分离的表皮组织尽量剪碎,以0.05%胰酶置于37℃摇床中振荡消化10~15 min,用含10%无钙血清培养液终止消化,将细胞悬液经过40 μm单细胞滤器过滤,以2 000 r/min离心5 min,弃上清,以dK-SFM培养液重悬细胞,取少量细胞进行细胞计数。最后以2 000 cells/cm2的细胞密度接种于10 cm培养皿上,置于37℃、含21%O2培养箱中培养,3 d换液一次。待细胞汇合至80%时,以0.05%胰蛋白酶置于37℃培养箱中消化5 min后,以无钙血清终止消化,将细胞悬液以2 000 r/min离心约5 min,弃上清,dK-SFM培养液重悬,以2 000 cells/cm2的密度进行传代。
1.5 共聚焦显微镜分析
细胞接种后第1、7天取出膜片,PBS冲洗,4% PFA室温固定15 min后,以DAPI衬核。荧光封片剂封片后进行共聚焦显微镜观察。
1.6扫描电镜(SEM)观察
细胞接种后第1、7天,将细胞-材料复合物取出,固定,磷酸缓冲液漂洗,乙醇梯度脱水,乙醇浓度依次为:25%、50%、75%、85%、95%和100%,每个梯度脱水5 min。预先配制无水乙醇与六甲基二硅胺烷的混合液,配制比例依次为:3∶1、1∶1、1∶3和0∶1,然后将样品在各混合液中浸泡10 min,置入通风橱内自然风干。导电胶固定,喷金,行扫描电镜检测[12]。
1.7 细胞增殖实验
按CCK-8试剂盒说明,在24孔培养板上以5×104个/孔的细胞密度将HaCaT细胞接种于GT/PCL纳米纤维电纺膜表面,选取第1、3、5、7天4个时间点进行检测。检测当天吸除孔中原有培养液,每孔再加入500 μL新鲜培养液及50 μL CCK-8试剂,置于37℃恒温CO2培养箱2 h,然后每孔吸取100 μL培养液于96孔板中,450 nm处测定每孔吸光度值。1.8生物力学测试
将所得的GT/PCL纳米纤维电纺膜放入真空干燥箱中干燥,然后将试样贴在载物台上镀金90 sec,在10 KV的加速电压下,用扫描电镜观察静电纺纳米纤维的形态并拍照。基于所得SEM图像,使用分析软件(NIH,USA)对制备的静电纺丝纳米纤维的直径、孔径大小进行测量,并使用游标卡尺测量膜片的厚度。
力学测定:制备具有一定长、宽及厚度的纤维膜;将纤维膜固定在模板的两端,将纤维膜裁剪为长5 cm、宽1 cm、厚0.1~0.2 mm的样品;小心剪去模板中间3 cm部分。分为4组:单纯材料培养液中浸泡8 h、1周、2周以及细胞接种后培养1周,每组5个样本进行检测。将所得样品两端1 cm处固定于材料测试机上,20℃、65%湿度环境下以10 mm/min的拉伸速度对样品进行拉伸测试。获得各组的应力-应变曲线、平均断裂强度、杨氏模量和延伸率。
1.9 裸鼠创面愈合模型实验
分为3组:第一组,HaCaT细胞接种于GT/PCL纳米纤维电纺膜组;第二组,人角质形成细胞接种于GT/PCL纳米纤维电纺膜组;第三组,单纯材料组(GT/PCL纳米纤维电纺膜组)。
将细胞(HaCaT细胞和人角质形成细胞)接种于GT/PCL膜(圆形,直径1.56 cm),以1×106cells/cm2的细胞密度接种。2 d换液一次。构建7 d后的组织工程表皮用于移植。
12只雄性BALB/C裸鼠购买自SLAC国家啮齿类实验动物资源库(上海)。小鼠腹膜内注射戊巴比妥钠(20 mg/Kg)麻醉。在裸鼠背部用角膜环钻造一直径1 cm的全层皮肤缺损。将12只裸鼠分为3组(membrane、HaCaT、KC),每组以一种制备的材料(n=4)覆盖,5-0尼龙缝线固定,凡士林纱布和敷料覆盖。整个实验过程密切监测动物行为和绷带完整性。分别在第0、4、7、11、14天评估创面愈合情况。数码相机拍照,Image-Pro Plus软件测量面积,计算创面愈合率。创面愈合率的计算公式为:(最初面积-实时面积)/最初面积×100%。
1.10 组织学分析和免疫荧光染色
对术后14 d皮肤组织的冰冻切片进行免疫荧光检测。所采用的一抗为兔抗小鼠HLA(1∶200)。1.11统计分析
数据以均数±标准差表示。两因素方差分析用来确定差异有无统计学意义,实验中的数据统计采用t检验,P<0.05表示具有显著性差异。
2 结果
2.1 GT/PCL纳米纤维电纺膜的准备
我们使用的是圆形的GT/PCL纳米纤维电纺膜,直径1.56 cm。电镜分析评估材料纤维的微观结构,结果显示,GT/PCL(50∶50)膜片的纤维光滑,均匀,细腻,平均纤维直径为(409±88)nm,膜片的平均孔径(7.2±1.5)μm,平均厚度(25±4)μm(图1)。
2.2 GT/PCL纳米纤维电纺膜的生物相容性
为进行GT/PCL纳米纤维电纺膜的生物相容性实验,我们将HaCaT细胞接种于膜的表面。1 d后,共聚焦显微镜和扫描电镜观察显示,细胞在膜表面不断增殖,培养7 d后细胞可达到约85%融合。细胞增殖实验的结果显示,随着观察时间的延长,细胞的OD值也逐渐增加,直到进入平台期,证明了GT/PCL纳米纤维电纺膜具有良好的生物相容性(图2)。
2.3 GT/PCL纳米纤维电纺膜的力学性能
组织工程表皮在移植修复的过程中需要良好的机械强度以利于转移。观察4组GT/PCL纳米纤维电纺膜(单纯材料培养液中浸泡8 h、1周、2周以及细胞接种后培养1周)的应力-应变曲线,结果显示,各组杨氏模量和平均断裂强度没有显著性差异。GT/PCL纳米纤维电纺膜的延伸率则随着浸泡时间的延长而不断变大,可能是由于明胶的快速降解导致的。我们发现,接种HaCaT细胞的GT/PCL纳米纤维电纺膜片的弹性有所增加(P<0.05,与单纯材料培养液中浸泡1周组相比较)。因此,我们相信该GT/ PCL纳米纤维电纺膜的力学强度足以支撑其在体外培养1周以后用于移植修复(图3)。
2.4 构建的组织工程表皮修复皮肤缺损
分别在术后第0、4、7、11、14天用数码相机记录3组(包括HaCaT细胞电纺膜组,人角质形成细胞电纺膜组和单纯材料组)修复裸鼠皮肤缺损的大体观。术后14 d时各组创面愈合。统计分析表明,HaCaT细胞电纺膜组与人表皮细胞电纺膜组,在术后4、7、11 d时,愈合率均显著高于单纯材料组,差异有统计学意义(P<0.05)。但是,术后14 d时各组愈合率均未见显著差异,单纯材料组(94.4±6.8)%,HaCaT细胞电纺膜组(99.7±0.6)%,人角质形成细胞电纺膜组(99.8±0.3)%。综合分析后,我们认为所构建的组织工程表皮可以加速创面的愈合(图4、5)。
术后第14天,皮肤修复区域的的组织学检测显示,多层再生的上皮组织参与修复了缺损,但缺损部位的再生皮肤缺少正常裸鼠皮肤所具有的皮肤附件等结构。为了进一步确定HaCaT细胞和人角质形成细胞是否参与损伤修复,我们使用抗人表面抗原的HLA进行免疫荧光染色,观察发现使用构建的组织工程化表皮修复的缺损处的新生表皮层有特异的HLA的表达;而单纯材料组则未见HLA阳性表达。表明存活的供体细胞参与了创面的修复(图6)。

图1 GT/PCL纳米纤维电纺膜的表征Fig.1Characterizations of GT/PCL electrospun nanofibrous membrane
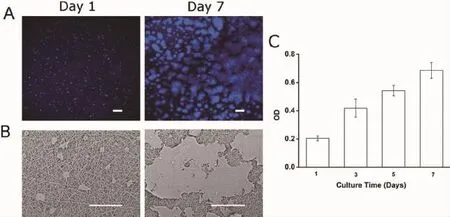
图2 GT/PCL纳米纤维电纺膜的生物相容性Fig.2Biocompatibility of GT/PCL electrospun nanofibrous membrane
A:表皮细胞系在膜片表面接种第1和第7天的扫描电镜图(标尺:200 μm);B:表皮细胞系在膜片表面接种第1和第7天的激光共聚焦荧光图片(标尺:100 μm);C:CCK-8法检测表皮细胞系在膜片表面接种后的增殖情况
A:SEM images of HaCaT cells on GT/PCL membrane at day 1 and day 7(Scale bars:200 μm);B:Confocal microscope images of HaCaT cells on GT/PCL membrane at 1st day and 7th day(Scale bars:100 μm);C:Proliferation of HaCaT cell on GT/PCL membrane measured by CCK-8 kit
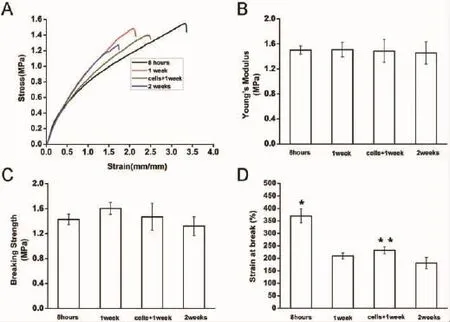
图3 GT/PCL纳米纤维电纺膜的机械性能Fig.3Mechanical properties of GT/PCL electrospun nanofibrous membrane
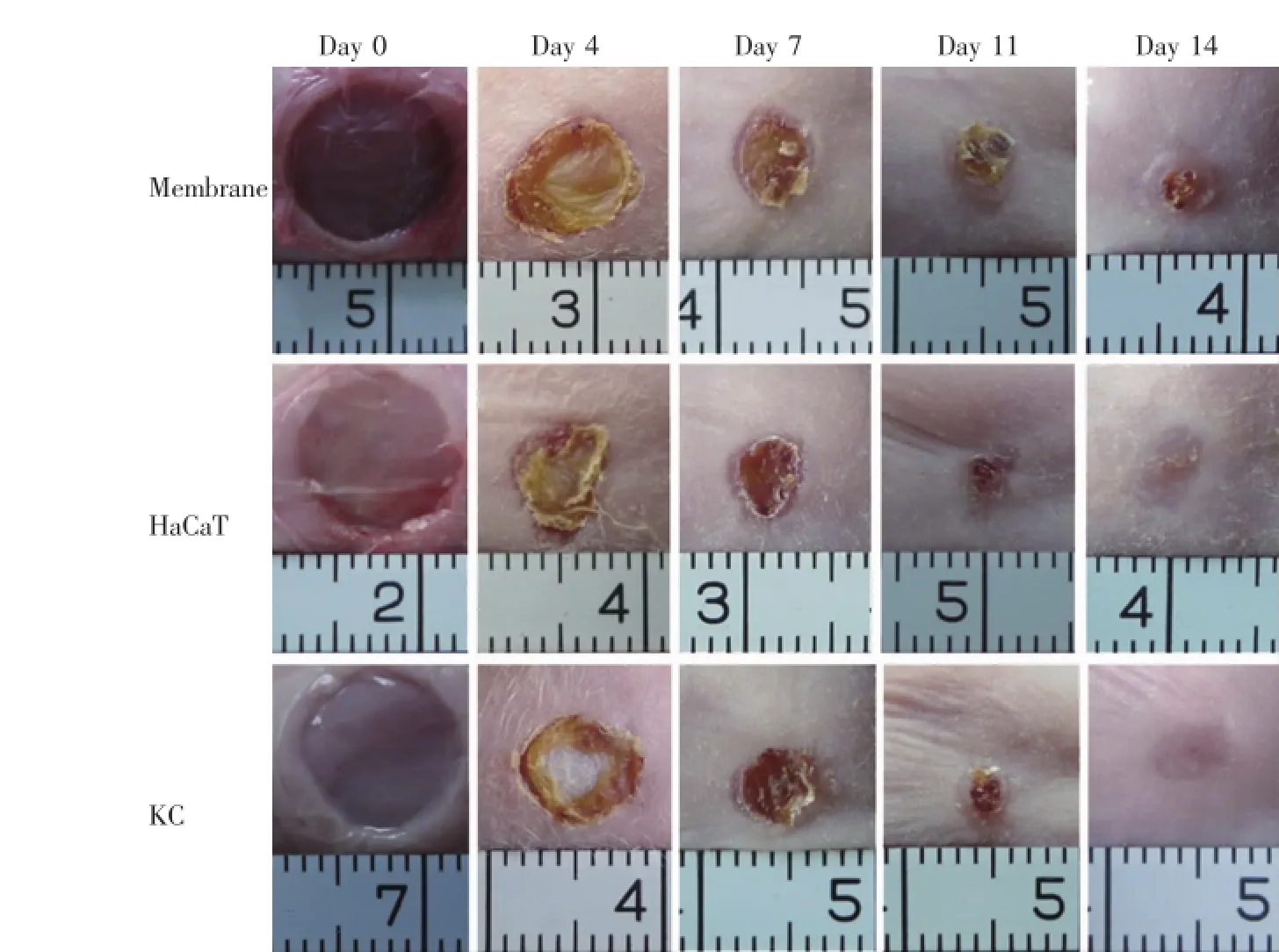
图4 各组裸鼠表皮缺损修复的观察Fig.4The observation of the repair of skin defects in each group
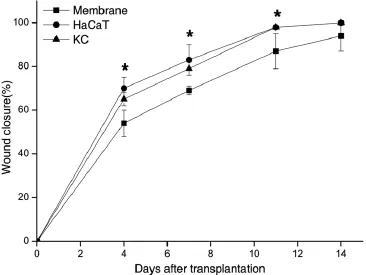
图5 各组伤口愈合率(n=4)(*:P<0.05,VS单纯材料组)Fig.5Wound closure rates in each group(n=4)(*:P<0.05,compare with membrane alone group)
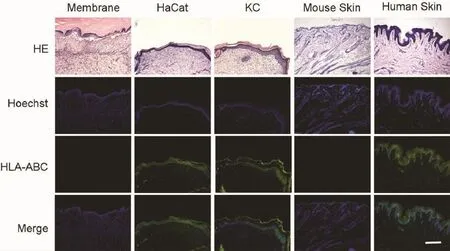
图6 术后第14天皮肤修复的组织学观察(比例尺:200 μm)Fig.6Histological observation in each group 14 days after operation.(Scale bar:200 μm)
3 讨论
良好的生物相容性和足够的力学强度是表皮组织工程对膜片材料的基本要求。GT/PCL纳米纤维电纺膜结合了天然和合成材料的优势。GT是一种细胞外基质的天然成分,可以提供一个理想的环境以利于细胞的黏附、增殖和分化;PCL的降解较慢,可为再生皮肤提供良好的力学性能[20]。前期实验表明,对于不同比例的GT/PCL膜片材料,随着GT含量的逐渐增加,材料的细胞黏附能力也逐渐增强,但同时膜片的机械强度随着PCL含量的降低而下降。与此相反,PCL含量的增加,虽然改善了机械强度,但导致细胞黏附能力明显减弱。体内外实验表明,我们采用改良的GT/PCL纳米纤维电纺膜片,能较好地适用于表皮组织工程的研究。
GT/PCL纳米纤维电纺膜的降解速率相对缓慢。在软骨组织工程的构建中,9个月时依然可以观察到未降解的PCL材料(本实验室的研究资料)。因此,GT/PCL纳米纤维电纺膜支架在表皮组织工程的应用过程中主要承担的是表皮细胞增殖载体的作用。GT/PCL纳米纤维电纺膜覆盖创面以后,随着创面的逐渐愈合,电纺膜最终会与表皮脱离。因此,GT/ PCL纳米纤维电纺膜过慢的降解速率不会影响表皮的修复过程。本实验室既往的研究表明,壳聚糖-明胶膜片(CGMS)同样也是一种降解速率过慢的材料,但在动物模型与临床治疗过程中,都有良好的效果[21-22]。而相较于CGMS膜片,GT/PCL纳米纤维电纺膜可以提供一个仿生学微环境,以利于细胞的黏附和增殖。此外,GT/PCL纳米纤维电纺膜的纤维网结构可以提供更好的透气性,并且易于液体的通过,炎性因子和渗出液能够更好的扩散。基于以上优势,GT/PCL纳米纤维电纺膜构建的组织工程表皮修复皮肤损伤时将具有更好的效果。
创伤修复包括各种生长因子和细胞分泌因子的动员,细胞的增殖以及血管再生等过程[23]。本研究中的组织工程化表皮,可以通过加快创面的早期愈合速度来提高愈合速率。但我们也发现,单纯材料组处理的创面在术后第14天也实现了愈合。这可能是由于小鼠模型的皮肤自身收缩所致。虽然在实验组中我们也发现了皮肤的收缩,但是HLA染色显示创面所覆盖的移植细胞存活,表明该供体细胞在促进愈合过程中也发挥了明显作用。研究表明,组织工程表皮不仅可以覆盖创面,而且还可以分泌刺激皮肤再生的各种生长因子[24-26]。因此,也有研究使用包被有各种细胞生长因子的膜片来治疗皮肤损伤。Choi等[27]将重组型人EGF包埋于静电纺纤维支架材料来治疗糖尿病引起的皮肤溃疡。其他细胞因子,包括G-CSF和PDGF-BB等,也都被应用于皮肤组织工程[28-30]。因此,包埋有不同生长因子的GT/PCL纳米纤维电纺膜的研究将成为后续实验的侧重点。
GT/PCL纳米纤维电纺膜由于较少引起宿主的免疫反应,被认为是一种很有前景的组织工程支架材料[31]。明胶是一种天然细胞外基质,在修复大鼠皮肤缺损的过程中仅引起极小的炎性反应[32]。而PCL由于其本身的惰性,在修复皮肤缺损的过程中几乎不会引起炎症反应[33]。研究中,我们同样没有发现明显的免疫反应。至于GT/PCL纳米纤维电纺膜对于感染创面是否具有抗炎作用,则值得进一步研究。此外,我们也可以考虑将抗生素包埋于纳米纤维电纺膜中用于感染性皮肤损伤的修复[34]。
4 结论
目前的研究表明,改良的GT/PCL纳米纤维电纺膜具有良好的生物相容性和力学性能,是一种良好的组织工程表皮支架材料。
[1]Mansbridge JN.Tissue-engineered skin substitutes in regenerative medicine[J].Curr Opin Biotechnol,2009,20(5):563-567.
[2][No authors listed].Grafting of burns with cultured epithelium prepared from autologous epidermal cells[J].Lancet,1981,1 (8211):75-78.
[3]Powell HM,Boyce ST.Engineered human skin fabricated using electrospun collagen-PCL blends:morphogenesis and mechanical properties[J].Tissue Eng Part A,2009,15(8):2177-2187.
[4]Ji SZ,Xiao SC,Luo PF,et al.An epidermal stem cells niche microenvironmentcreatedbyengineeredhumanamniotic membrane[J].Biomaterials,2011,32(31):7801-7811.
[5]Kempf M,Miyamura Y,Liu PY,et al.A denatured collagen microfiber scaffold seeded with human fibroblasts and keratinocytes for skin grafting[J].Biomaterials,2011,32(21):4782-4792.
[6]Yang J,Woo SL,Yang G,et al.Construction and clinical application of a human tissue-engineered epidermal membrane[J].Plast Reconstr Surg,2010,125(3):901-909.
[7]Mohamed A,Xing MM.Nanomaterials and nanotechnology for skin tissue engineering[J].Int J Burns Trauma,2012,2(1):29-41.
[8]Sill TJ,von Recum HA.Electrospinning:application sin drug delivery and tissue engineering[J].Biomaterials,2008,29(13): 1989-2006.
[9]Yoo HS,Kim TG,Park TG.Surface-functionalized electrospunnanofibers for tissue engineering and drug delivery[J].Adv Drug Deliv Rev,2009,61(12):1033-1042.
[10]Franco RA,Nguyen TH,Lee BT.Preparation and characterization of electrospun PCL/PLGA membranes and chitosan/gelatin hydrogels for skin bioengineering applications[J].J Mater Sci Mater Med, 2011,22(10):2207-2218.
[11]Hajiali H,Shahgasempour S,Naimi-Jamal MR,et al.Electrospun PGA/gelatin nanofibrous scaffolds and their potential application in vascular tissue engineering[J].Int J Nanomedicine,2011,6: 2133-2141.
[12]Chong EJ,Phan TT,Lim IJ,et al.Evaluation of electrospun PCL/ gelatin nanofibrous scaffold for wound healing and layered dermal reconstitution[J].Acta Biomater,2007,3(3):321-330.
[13]Franco RA,Min YK,Yang HM,et al.Fabrication and biocompatibility of novel bilayer scaffold for skin tissue engineering applications[J].J Biomater Appl,2013,27(5):605-615.
[14]Long JH,Tan WY,Jiang RW,et al.Experimental study on gelatin/polycaprolactam composite nanofiber scaffold in wound healing[J].Zhonghua Shao Shang ZaZhi,2008,24(1):42-44.
[15]Ghasemi-Mobarakeh L,Prabhakaran MP,Morshed M,et al. Electrospunpoly(epsilon-caprolactone)/gelatin nanofibrous scaffolds for nerve tissue engineering[J].Biomaterials,2008,29(34):4532-4539.
[16]Kwon IK,Matsuda T.Co-electrospunnanofiber fabrics of poly(L-lactide-co-epsilon-caprolactone)with type I collagen or heparin [J].Biomacromolecules,2005,6(4):2096-2105.
[17]Zhang YZ,Feng Y,Huang ZM,et al.Fabrication of porous electrospunnanofibres[J].Nanotechnology,2006,17(3):901-908.
[18]Bhattarai N,Li ZS,Gunn J,et al.Natural-synthetic polyblendnanofibers for biomedical applications[J].Adv Mater,2009,21 (27):2792-2797.
[19]Feng B,Tu H,Yuan H,et al.Acetic-acid-mediated miscibility toward electrospinning homogeneous composite nanofibers of GT/ PCL[J].Biomacromolecules,2012,13(12):3917-3925.
[20]Zhang Y,Ouyang H,Lim CT,et al.Electrospinning of gelatin fibers and gelatin/PCL composite fibrous scaffolds[J].J Biomed Mater Res B Appl Biomater,2005,72(1):156-165.
[21]Tutak W,Sarkar S,Lin-Gibson S,et al.The support of bone marrow stromalcelldifferentiationbyairbrushednanofiber scaffolds[J].Biomaterials,2013,34(10):2389-2398.
[22]Chen F,Zhang W,Wu W,et al.Cryopreservation of tissueengineered epithelial sheets in trehalose[J].Biomaterials,2011,32 (33):8426-8435.
[23]Broughton G 2nd,Janis JE,Attinger CE.The basic science of wound healing[J].Plast Reconstr Surg,2006,117(Suppl 7):12S-34S.
[24]Werner S,Krieg T,Smola H.Keratinocyte-fibroblast interactions in wound healing[J].J Invest Dermatol,2007,127(5):998-1008.
[25]Buschke S,Stark HJ,Cerezo A,et al.A decisive function of transforming growth factor-β/Smad signaling in tissue morphogenesis and differentiation of human HaCaT keratinocytes[J]. Mol Biol Cell,2011,22(6):782-794.
[26]Mansbridge J.Skin substitutes to enhance wound healing[J]. Expert Opin Investig Drugs,1998,7(5):803-809.
[27]Choi JS,Leong KW,Yoo HS.In vivo wound healing of diabetic ulcersusingelectrospunnanofibersimmobilizedwithhuman epidermal growth factor(EGF)[J].Biomaterials,2008,29(5):587-596.
[28]Yang Y,Xia T,Zhi W,et al.Promotion of skin regeneration in diabetic rats by electrospun core-sheath fibers loaded with basic fibroblast growth factor[J].Biomaterials,2011,32(18):4243-4254.
[29]Spadaccio C,Rainer A,De Porcellinis S,et al.A G-CSF functionalized PLLA scaffold for wound repair:An in vitro preliminary study[J].Conf Proc IEEE Eng Med Biol Soc,2010,2010:843-846.
[30]Lee J,Yoo JJ,Atala A,et al.The effect of controlled release of PDGF-BB from heparin-conjugated electrospun PCL/gelatin scaffolds on cellular bioactivity and infiltration[J].Biomaterials, 2012,33(28):6709-6720.
[31]Cao H,McHugh K,Chew SY,et al.The topographical effect of electrospunnanofibrous scaffolds on the in vivo and in vitro foreign body reaction[J].J Biomed Mater Res A,2010,93(3): 1151-1159.
[32]Chang WH,Chang Y,Lai PH,et al.A genipin-crosslinked gelatin membrane as wound-dressing material:in vitro and in vivo studies[J].J Biomater Sci Polym Ed,2003,14(5):481-495.
[33]Ng KW,Achuth HN,Moochhala S,et al.In vivo evaluation of an ultra-thin polycaprolactone film as a wound dressing[J].J Biomater Sci Polym Ed,2007,18(7):925-938.
[34]Chen DW,Hsu YH,Liao JY,et al.Sustainable release of vancomycin,gentamicin and lidocaine from novel electrospun sandwich-structured PLGA/collagen nanofibrous membranes[J]. Int J Pharm,2012,430(1-2):335-341.
Electrospun Nanofibrous Gelatin/Polycaprolactone Membrane for Epidermis Engineering
WU Wei1,DUAN
Huichuan2,ZHANG Wenjie2,CAO Yilin2.1 Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China;2 Shanghai Key Laboratory of Tissue Engineering,Shanghai 200011,China.Corresponding author:CAO Yilin(E-mail:yilincao@yahoo.com);ZHANG Wenjie(E-mail:wenjieboshi@aliyun.com).
ObjectiveTo investigate the feasibility of a modified gelatin and polycaprolactone(GT/PCL)electrospun nanofibrous membrane for epidermis engineering.MethodsThe biocompatibility of the membrane was evaluated by seeding HaCaT cells(human keratinocyte cell line)on the membrane and the mechanical properties of the membrane were determined before and after seeding HaCaT cells.Cell proliferation assay was tested by CCK-8 kit.Then the outcome of GT/ PCL membranes repairing skin defects in the nude mouse was investigated.ResultsThe cell proliferation assay showed good attachment and proliferation of HaCaT cells on the membranes and demonstrated good biocompatibility of the membranes.The membranes were strong enough to be transplanted confirming by mechanical test.Further in vivo transplantation studies revealed that engineered epidermis with GT/PCL membranes are able to repair skin defects of the nude mouse.ConclusionThe modified GT/PCL electronspun nanofibrous membrane is a kind of suitable scaffold for epidermis engineering.
Epidermis skin engineering;Electrospun nanofibrous membrane;Gelatin;Polycaprolactone
Q813.1+2
A
1673-0364(2014)02-0061-08
10.3969/j.issn.1673-0364.2014.02.001
2014年1月6日;
2014年1月24日)
国家重点基础研究发展计划(2007CB948004,2011CB964704);国家重点基础研究发展计划(30800231,31170944);上海基础研究发展计划(10ZR1424400)。
200011上海市上海交通大学医学院附属第九人民医院整复外科(吴巍,曹谊林);200011上海市上海组织工程研究重点实验室(段惠川,张文杰,曹谊林)。
曹谊林(E-mail:yilincao@yahoo.com);张文杰(E-mail:wenjieboshi@aliyun.com)。
注:吴薇和段惠川为共同第一作者。

