黏结剂对SnO2/石墨烯负极材料电化学行为的影响
陈 然,虞桢君,詹 亮*,王艳莉,张洪纲,施烁思,刘 越
(1.华东理工大学,化学工程联合国家重点实验室,特种功能高分子材料及相关技术教育部重点实验室,上海200237;2.武汉科技大学化学工程与技术学院,武汉430081)
继石墨类负极材料(理论嵌锂容量372 m A·h/g[1])之 后, 金 属 氧 化 物(如)因其理论嵌锂容量较高而成为锂离子电池负极材料的研究热点。其中,二氧化锡(SnO2)的理论嵌锂容量高达 782 mA·h/g[6],因此倍受科学界的青睐。遗憾的是,SnO2在充放电过程中存在体积膨胀率较高[7]和电导率较低的不足。体积膨胀率较高,会影响活性材料在Li+嵌入/脱出过程中与导电添加剂、集流体、黏结剂之间的接触效果,易造成电极粉化,进而影响电极材料的循环稳定性和使用寿命;较低的电导率必然影响电子的迁移速度和电极材料的倍率性能。对此,研究者们通过碳包覆[8-9]或碳掺杂[10-12]以期改善单一 SnO2负极材料所存在的不足。
黏结剂是锂离子电池的重要组成部分,其主要作用是将活性物质黏附在集流体上[13]。黏结剂主要有两类[14]:一类是采用有机溶剂作分散剂的有机溶剂性黏结剂,另一类则是采用水作分散剂的水性黏结剂。Chou[15]等对纳米 SnO2进行了碳包覆,分别使用羧甲基纤维素钠(CMC)/丁苯橡胶(SBR)和聚偏氟乙烯(PVDF)作黏结剂,考察其电化学性能。结果表明,在循环密度100 mA·h/g下循环50次后,放电容量分别为502 m A·h/g(使用CMC作黏结剂)和248 mA·h/g(使用 PVDF作黏结剂)。该研究表明通过改善黏结剂的性质也是一条提高SnO2电化学性能的有效途径。对此,本研究将SnO2纳米颗粒均匀地分散在石墨烯表面,利用石墨烯良好的导电性和高比表面积提高SnO2的电导率及其与电解液、集流体间的接触面积;在此基础上,进一步通过调配黏结剂的种类提高SnO2的电化学性能。
1 实验
1.1 SnO 2/石墨烯的制备
采用改进的 Hummers法[16-17]制备氧化石墨。将1 g氧化石墨充分溶于300 m L去离子水中,得到棕褐色的氧化石墨溶液。再加入3 g二水合氯化亚锡(SnCl2·2H2O)与4 m L盐酸(37%),并磁力搅拌1 h。将有上述溶液的烧杯置于微波炉(GalanzP70D20TP-C6)中,在900 W的功率下微波辐照3 min,再经过滤、洗涤、80℃干燥后,得到SnO2/石墨烯负极材料。
1.2 分析表征
采用Rigaku D/max 2550型X射线衍射仪(XRD,CuK_α,λ=0.15406 nm)对样品进行物相分析。采用美国TA公司SDTQ600热重分析仪(TG)在空气气氛下测试样品的二氧化锡含量。通过用JSM-6360LV型扫描电子显微镜(SEM)与JEOL JEM-2010型透射电子显微镜(TEM)观察样品的形貌和结构。
1.3 电化学性能测试
将制备的活性材料、导电炭黑和黏结剂按质量比80∶10∶10,混合制成均匀的浆料。两种黏结剂分别为:1)聚偏氟乙烯(PVDF),N-甲基吡咯烷酮(NMP)作分散剂;2)羧甲基纤维素钠(CMC)和丁苯橡胶(SBR),两者质量比例为1∶1,水作分散剂。用涂膜法将浆料均匀涂在铜箔上,烘干后,制成Φ12 mm的圆形电极片。电极片经过90℃真空干燥12 h后,在手套箱中组装成扣式电池。
电池以金属锂作为对电极,隔膜为Celgard 2300微孔聚丙烯膜,电解液为1 mol/L LiPF6/碳酸乙烯酯(EC)-碳酸二甲酯(DMC)-碳酸二乙酯(DEC)的混合液,其中 V(EC)∶V(DMC)∶V(DEC)为1∶1∶1。电池的恒流充放电和循环伏安曲线测试在Arbin BT2000电化学工作站上进行,其中电压范围在0.005~3.000 V之间,循环伏安扫描速率为0.1 mV/s。
2 结果与讨论
2.1 SnO 2/石墨烯负极材料的结构与形貌
对复合物进行了XRD和TG测试,结果见图1。
图1a)表明,石墨在2θ=26°的(002)特征峰几乎消失,说明所制石墨稀的石墨层之间得到很好的剥离;SnO2/石墨烯的4处特征峰归属于 SnO2的(110)、(101)、(211)和(301)晶面衍射峰,各衍射峰较宽,说明合成的SnO2纳米颗粒的粒径较小。另外,SnO2/石墨烯复合材料的XRD曲线中并未观察到石墨烯发生团聚形成的衍射峰,说明SnO2纳米颗粒有效地抑制了石墨稀的团聚,同时石墨稀的二维平面结构也有利于纳米SnO2的均匀分散。
图1b)中,在100~450℃范围内,单纯的石墨烯和SnO2/石墨烯复合材料都存在质量损失,这是由于石墨烯中少量含氧官能团的分解导致的。在450~600℃范围内,因石墨烯中基体碳与空气中的O2反应转化成成CO和CO2气体,导致在800℃时石墨烯的残留率几乎为0。比较石墨烯的热失重结果,可以看出SnO2/石墨烯复合材料中SnO2的质量分数为59.6%。
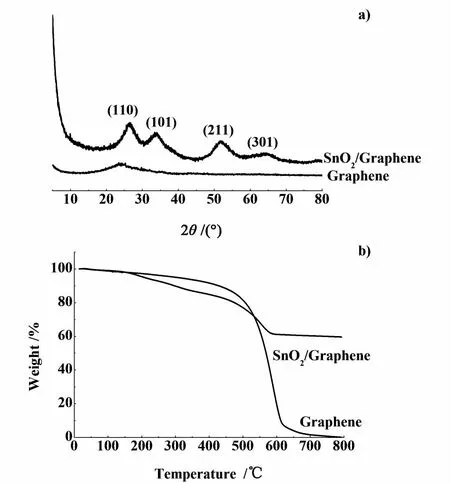
图1 石墨烯和SnO 2/石墨烯复合物的 a)XRD图谱和b)TG曲线Fig.1 a)XRD patterns and b)TG curves of graphene and SnO 2/graphene nanocomposite
图2a)和图2b)为SnO2/石墨烯复合负极材料的TEM图,从图2中可以看出石墨烯表面存在大量的SnO2纳米颗粒;由图2b)可以看出,SnO2纳米颗粒均匀地分散在石墨烯表面,仅在褶皱处有少量富集,这可能是因为褶皱处表面能较高引起的。图2c)和图2d)为SnO2/石墨烯复合负极材料的HRTEM图。由图2c)可见,SnO2纳米颗粒的直径为3~6 nm,呈完美的晶体结构,且晶格线清晰可见,间距为0.24 nm和0.34 nm的晶格线分别属于 SnO2的(200)和(110)晶面。观察图2d),既可看到典型的 SnO2结构,又可辨别出石墨烯的石墨层结构,说明该材料确实是SnO2和石墨烯的纳米复合物。
2.2 黏结剂对SnO 2电化学性能的影响
图3为200 mA/g下不同黏结剂SnO2的首次和二次充放电曲线。表1为充放电容量和库伦效率。
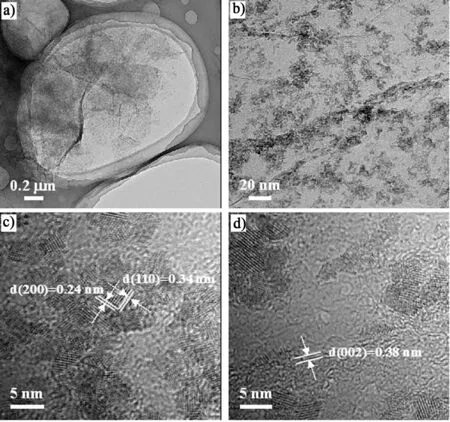
图2 SnO 2/石墨烯复合负极材料的a),b)TEM和c),d)HRTEM图Fig.2 a),b)TEMand c),d)high resolution TEM images of SnO 2/graphene
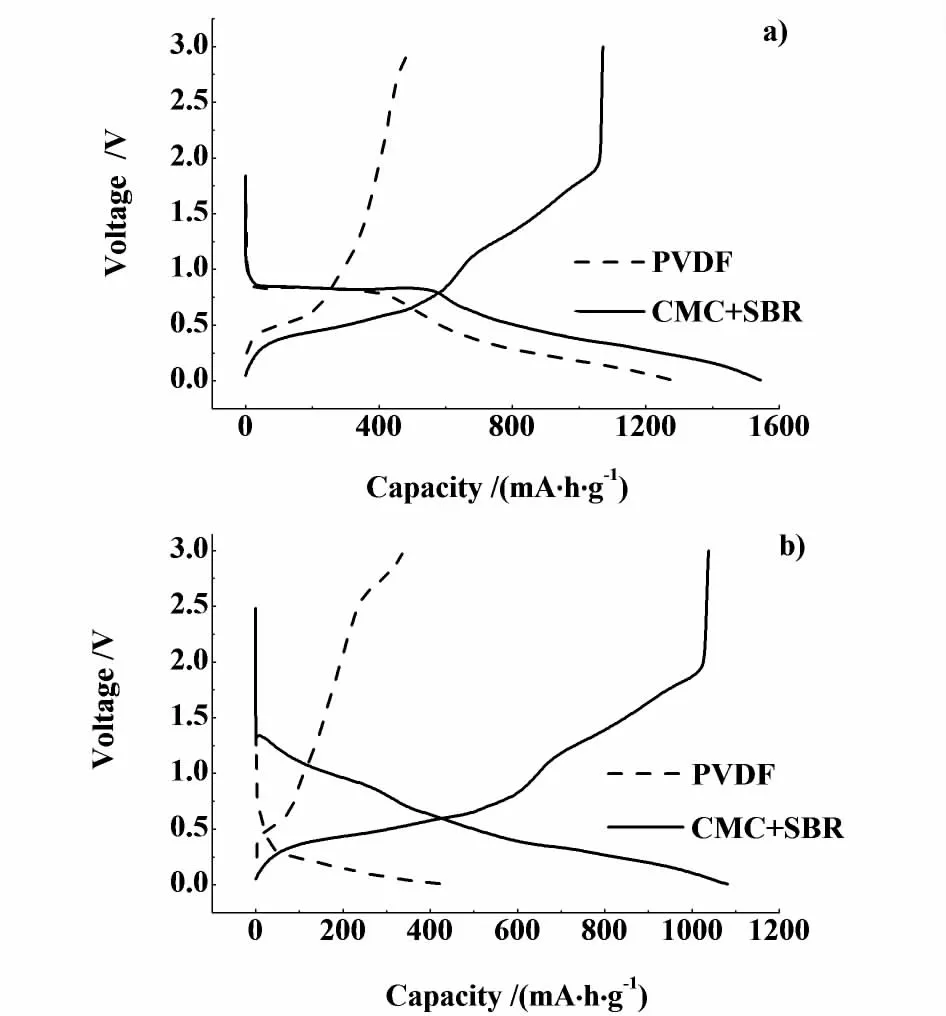
图3 200 m A/g下由PVDF和CM C+SBR作黏结剂制备的SnO 2电极的首次a)和二次b)充放电曲线Fig.3 First a)and second b)charge-discharge curves of SnO 2 electrode using PVDF and CM C+SBR as binder at 200 m A/g
如图3,在首次放电过程中,随着放电容量的增加,SnO2的电压迅速下降,在0.8 V有一个平台,对应SnO2与Li+发生氧化还原反应生成Li2O和金属Sn的过程,这是一个不可逆过程,是首次不可逆容量产生的主要原因。与首次充放电曲线不同,SnO2在第2次放电过程中并没有产生0.8 V的平台,说明几乎没有Li2O的生成。图3和表1的结果表明:CMC+SBR作黏结剂时,SnO2的首次、二次充放电容量和库伦效率都大于PVDF作黏结剂时的SnO2。这是因为PVDF长期浸泡在有机电解液中,其黏结强度会降低,使得活性物质与导电剂之间的接触变差,活性物质从集流体上脱落,导致循环性能下降,也就是说PVDF的溶胀作用十分严重。与PVDF相比,CMC的溶胀作用较小,同时也可抑制SnO2在充放电过程中的膨胀,可以起到一定的缓冲作用。

表1 200 m A/g下不同黏结剂SnO 2的充放电容量和库伦效率Table 1 Capacity and Coulombic efficiency of SnO 2 electrode using different binders at 200 m A/g
图4为SnO2(PVDF和CMC+SBR作黏结剂)电极的循环伏安曲线,其中扫描速率为0.1 mV/s。
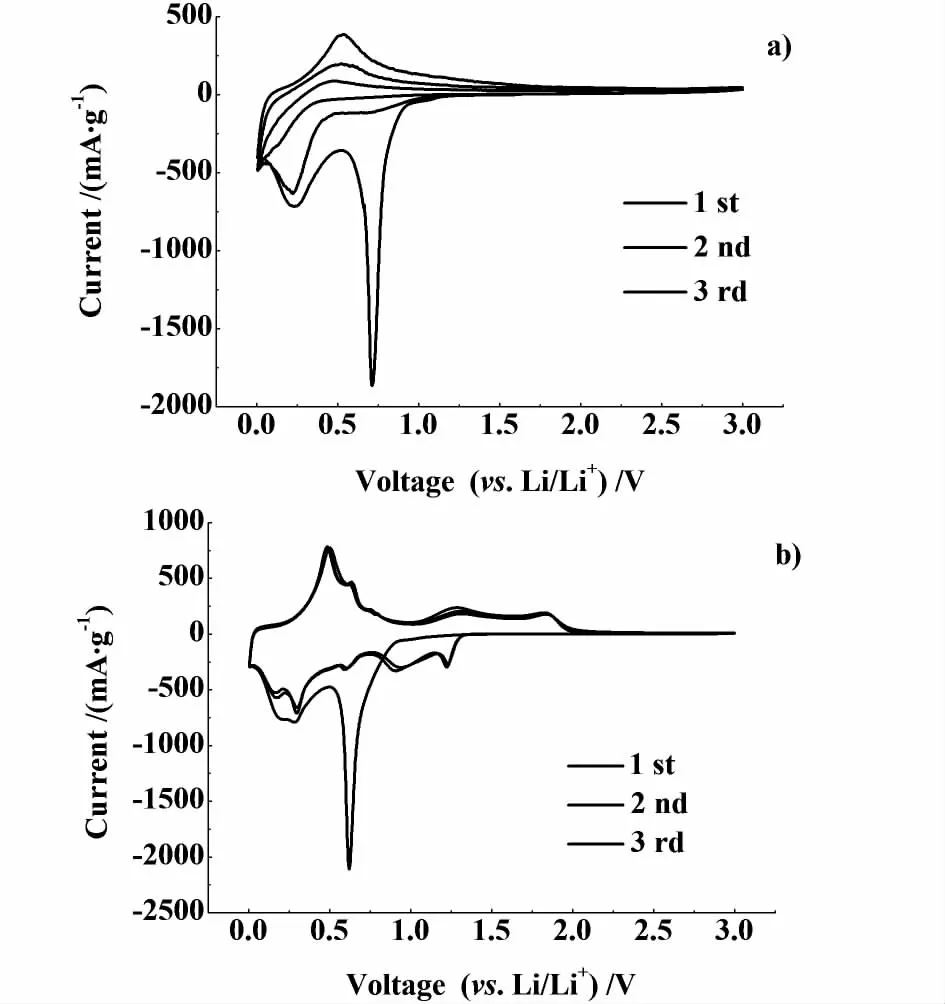
图4 由PVDF a)和 CM C+SBR b)作黏结剂制备的SnO 2电极的循环伏安曲线Fig.4 Cyclic voltammetry curves of SnO2 electrode using a)PVDF and b)CM C+SBR as binder
如图4,首次循环在0.75 V出现一个明显的还原峰,对应 SnO2被还原成金属 Sn的过程;0.25 V的还原峰和0.5 V的氧化峰分别对应LixSn的生成过程和去合金化过程。而且随着充放电次数的增加,充电容量逐渐减小,表明用PVDF作黏结剂时,SnO2的容量利用率很低,循环性能较差。与PVDF作黏结剂相比,图4b)中(CMC+SBR作黏结剂)第2、3次的循环伏安曲线基本重合,说明针对 SnO2而言,CMC+SBR作黏结剂时的效果要优于PVDF。
图5为200 mA/g下由不同黏结剂制成的SnO2电极的循环性能曲线。

图5 200 m A/g下不同黏结剂SnO 2的循环性能曲线Fig.5 Cyclic performance of SnO 2 using different binders at 200 m A/g
由图5可见,CMC+SBR作黏结剂时,SnO2的循环性能明显优于相应PVDF作黏结剂的性能。其中,经过30次循环后,由 CMC+SBR、PVDF作黏结剂制成的 SnO2电极的充电容量分别为500.9、130.8 mA·h/g,放电容量分别为581.3和135.3 mA·h/g,容量保持率分别为37.6%和10.6%。但需要指出的是,由于单一 SnO2存在体积膨胀率高的问题,导致2种不同黏结剂体系制成的电极材料的稳定性都较差。
2.3 黏结剂对SnO 2/石墨烯负极材料电化学性能的影响
图6为分别以PVDF和CMC+SBR作黏结剂SnO2/石墨烯复合负极材料的循环伏安曲线,其中扫描速率为0.1 mV/s。
首次循环在0.75 V左右出现1个明显的还原峰,对应SnO2与 Li反应生成 Li2O和金属 Sn的过程。0.25 V左右的还原峰和0.5 V左右的氧化峰分别对应 LixSn合金的生成过程、去合金化过程。1.25 V左右的氧化峰对应Li2O和Sn反应生成SnO2与Li的过程,表明SnO2被Li还原为无定形的Li2O和金属Sn的过程具有一定的可逆性。第二次循环开始,0.75 V的还原峰消失,说明第二次放电没有生成Li2O。比较图6a)和6b),对于SnO2/石墨烯复合负极材料来说,CMC+SBR的黏结性能优于PVDF,但是效果并不是非常明显,这是因为纳米SnO2颗粒包覆于并均匀分散在石墨烯表面,在很大程度上抑制了充放电过程中SnO2的巨大体积膨胀。
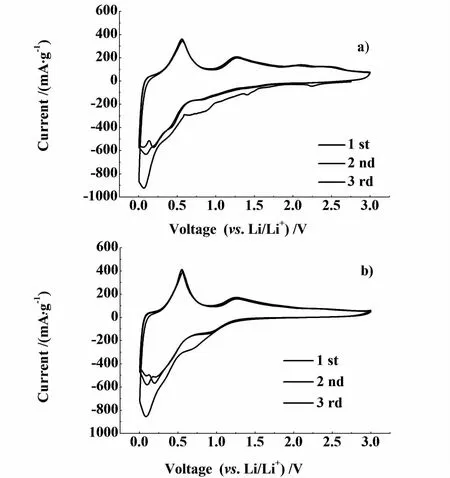
图6 由PVDF a)和CM C+SBR b)作黏结剂制成的SnO 2/石墨烯负极材料的循环伏安曲线Fig.6 Cyclic voltammetry curves of SnO2/graphene anode materials using PVDF a)and CMC+SBR b)as binder
由图7a)可见,当以CMC+SBR作黏结剂时,在200 mA/g电流密度下,SnO2/石墨烯复合负极材料的充放电循环性能明显优于PVDF黏结剂。其中,经过100次充放电循环后,以CMC+SBR作黏结剂时,SnO2/石墨烯复合负极材料充电容量、放电容量和容量保持率分别为699.6 mA·h/g、702.3 mA·h/g和43.8%;相应以PVDF作黏结剂时所对应的值分别为 548.4 mA·h/g、552 mA·h/g和32.8%。 且与图5相比,使用相同黏结剂时,SnO2/石墨烯复合负极材料的放电容量和稳定性明显优于单一SnO2负极材料,说明二维纳米结构的石墨烯能够提供较高的比表面积实现SnO2在纳米尺度内的均匀分散,进而提高了SnO2活性物质与电解液、集流体之间的接触面积。

图7 200 m A/g下由不同黏结剂制成的SnO 2/石墨烯复合负极材料的a)循环性能和b)倍率性能曲线Fig.7 Cyclic a)and rate b)performance of SnO 2/graphene using d ifferen t binders at 200 m A/g
由图 7b)可见,在 40、80、200、400 和 800 mA/g下,SnO2/石墨烯复合负极材料(CMC+SBR作黏结剂)的放电容量分别为 982.1、829.8、690.4、579.5和501 mA·h/g,均高于相应 PVDF作黏结剂时SnO2/石墨烯复合负极材料的放电容量。另外,当电流重新返回到40.0 mA/g时,SnO2/石墨烯复合物的放电容量依然能达到796.7 mA·h/g。以上结果表明,当以CMC+SBR作黏结剂时,SnO2/石墨烯复合负极材料的倍率性能要优于PVDF作黏结剂时的值;同时,石墨稀良好的导电性对改善单一SnO2负极材料的大电流倍率性能具有较大贡献。
3 结论
当以CMC+SBR作黏结剂时,无论单一 SnO2还是SnO2/石墨烯复合负极材料,其充放电容量、循环性能和倍率性能都要优于相应PVDF作黏结剂时的电化学性能。其中,在200 mA/g下经过100次充放电循环后,当以CMC+SBR作黏结剂时,SnO2/石墨烯复合负极材料的放电容量、容量保持率分别为702.3 mA·h/g、43.8%,高于PVDF作黏结剂时的电化学性能(552.0 mA·h/g、32.8%)。其原因在于:1)CMC的溶胀作用较小,可以在一定程度上抑制活性电极材料在充放电过程中的体积膨胀;2)二维纳米结构的石墨烯能够提供较高的比表面积实现SnO2在纳米尺度内的均匀分散,进而提高了 SnO2活性物质与电解液、集流体之间的接触面积;3)石墨稀良好的导电性对改善单一SnO2负极材料的大电流倍率性能具有较大贡献。
[1]Lian P,Zhu X,Liang S,et al.Large reversible capacity of high quality graphene sheets as an anode material for lithium-ion batteries[J].Electrochimica Acta,2010,55(12):3 909_3 914
[2]Wang Y,Zeng H,Lee J Y.Highly reversible lithium storage in porous SnO2nanotubes with coaxially grown carbon nanotube overlayers[J].Advanced Materials,2006,18(5):645_649
[3]Zhang W, Wu X, Hu J, et al.Carbon coated Fe3O4nanospindles as a superior anodematerial for lithium-ion batteries[J].Advanced Functional Materials, 2008, 18(24):3 941_3 946
[4]Huang X,Tu J,Xia X,et al.Morphology effect on the electrochemical performance of NiO films as anodes for lithiumion batteries[J].Journal of Power Sources,2009,188(2):588_591
[5]Yang S,Gong Y,Liu Z,et al.Bottom-Up approach toward single-crystalline VO2-graphene ribbons as cathodes for ultrafast lithium storage[J].Nano Letters,2013,13(4):1 596_1 601
[6]Idota Y, Kubota T, Matsufuji A, et al.Tin-Based amorphous oxide:A high-capacity lithium-ion-storage material[J].Science, 1997, 276:1 395_1 397
[7]Courtney IA,Dahn JR.Electrochemical and in situ X-ray diffraction studies of the reaction of lithium with tin oxide composites[J].Journal of the Electrochemical Society, 1997, 144(6):2 045_2 052
[8]Zhao N,Yang L,Zhang P,et al.Polycrystalline SnO2nanowires coated with amorphous carbon nanotube as anode material for lithiumion batteries[J].Materials Letters, 2010, 64(8):972_975
[9]Yuan L, Konstantinov K, Wang G X, et al.Nano-Structured SnO2-carbon composites obtained by in situ spray pyrolysis method as anodes in lithium batteries[J].Journal of Power Sources, 2005, 146(1/2):180_184
[10]Wang J, Zhao H, Liu X, et al.Electrochemical properties of SnO2/carbon composite materials as anode material for lithium-ion batteries[J].Electrochimica Acta,2011,56(18):6 441_6 447
[11]Lian P, Zhu X, Liang S, et al.High reversible capacity of SnO2/graphene nanocomposite as an anode material for lithium-ion batteries[J].Electrochimica Acta,2011,56(12):4 532_4 539
[12]Fabrice M C, Elena A B, Yaser A, et al.In situ polyol-assisted synthesis of nano-SnO2/carbon compositematerials as anodes for lithium-ion batteries[J].Journal of Power Sources, 2010, 195(8):2 355_2 361
[13]Guerfi A,Kaneko M,Petitclerc M,et al.LiFePO4water-soluble binder electrode for Li-ion batteries[J].Journal of Power Sources, 2007, 163(2):1 047_1 052
[14]Markevich E, Salitra G, Aurbach D.Influence of the PVDF binder on the stability of LiCoO2electrodes[J].Electrochemistry Communications, 2005, 7(12):1 298_1 304
[15]Chou S, Wang J, Zhong C, et al.A facile route to carbon-coated SnO2nanoparticles combined with a new binder for enhanced cyclability of Li-ion rechargeable batteries[J].Electrochimica Acta, 2009, 54(28):7 519_7 524
[16]Wang C,Wang Y,Zhan L,et al.Synthesis of graphene with microwave irradiation in liquid phase[J].Journal of Inorganic Materials, 2012, 27(7):769_774
[17]Hassan M A, Abdelsayed V, Terner J, et al.M icrowave synthesis of graphene sheets supportingmetal nanocrystals in aqueous and organic media[J].Journal of Materials Chemistry, 2009, 19(23):3 832_3 837

