自噬抑制剂氯奎对低氧诱导肺动脉平滑肌细胞增殖的影响*
朱焕勉,陈 然,薛 峰,申屠杨萍,范小芳,龚永生,张宏宇,孔晓霞Δ
低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、慢性肺源性心脏病等多种心肺疾病发生发展的重要病理环节[1],其发病机理十分复杂,是一种以肺血管重构(remodeling)为主的不可逆性损害的疾病。
自噬是一种细胞通过溶酶体降解途径调控的细胞器和蛋白循环过程[2,3],已经被证实与衰老、免疫、细胞死亡和分化等病理生理过程的发生发展密切相关[4],但细胞自噬在低氧性肺动脉高压平滑肌细胞增殖中的作用还未被阐明。本实验应用1%氧气作用于肺动脉平滑肌细胞,观察自噬抑制剂氯喹在肺动脉平滑肌细胞增殖中作用及机制。
1 材料与方法
1.1 材料
DMEM培养基、胎牛血清等均购于美国Thermo公司。抗LC3、GAPDH单克隆抗体购于美国CST公司。单丹酰戊二胺(monodansylcadaverine,MDC)、氯喹购于美国Sigma公司。
1.2 肺动脉平滑肌细胞的培养及分组
取150~200 g成年Wistar大鼠,购自温州医科大学实验动物中心。在无菌条件下打开大鼠胸腔取出肺动脉干和左右肺动脉,组织块法培养肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs),并经α-平滑肌肌动蛋白免疫细胞化学鉴定。培养液为含15%胎牛血清DMEM,取第3~5代细胞用于本实验。用0.25%胰酶消化细胞并传代,细胞贴壁并达到(70~80)%融合后,换含0.4% 胎牛血清 DMEM培养基使PASMCs同步生长24 h,按照实验分组进行加药处理,并分别放入常氧(21%O2)和低氧(1%O2)孵箱(德国贺氏公司),24 h后进行各指标的检测。
1.3 亚甲基四唑蓝(MTT)测定PASMCs增殖
取原代培养的3~5代对数生长期PASMCs,经胰酶消化制成细胞悬液,以每孔 100μl(1×104cells)接种于 96孔板,培养 24 h后加入 50μmol/L氯喹,于 20 h后加入 MTT(5 g/L)20μl,继续培养 4 h后吸出培养液,加入 DMSO 150μl,振荡 10 min,用酶联免疫检测仪在490 nm下测其吸光度值。
1.4 MDC荧光染色检测自噬变化
单丹(磺)酰戊二胺(MDC)是一种自噬空泡的标志物,组织块法培养PASMCs经消化制成细胞悬液,以每孔5×104细胞数接种于24孔板中玻片上,细胞贴壁后,按照实验分为4组:正常对照组、1%低氧组、50μmol/L氯喹+低氧组、氯喹组。药物和/或低氧处理24 h后,PBS洗2遍,弃上清,以4%冰冷的多聚甲醛4°C固定15 min,PBS洗2遍,加入终浓度为 50μmol/L的 MDC,37°C孵育 50 min,PBS洗 2遍。甘油封片,荧光显微镜下(Nikon ECLPSE 80i)观察细胞自噬空泡积聚的变化。
1.5 肺动脉平滑肌细胞中LC3蛋白表达
LC3是自噬过程中的关键蛋白之一,是自噬体形成双层膜结构的主要组成部分。在自噬激活时,LC3-I(18 kDa)会被水解切割为 LC3-II(16 kDa),被广泛用来衡量细胞自噬激活水平。以LC3-II/LC3-I比值反映LC3蛋白相对水平变化,作为衡量细胞自噬水平的标准之一。6 cm培养皿中不同组别的PASMCs加入100μL RIPA细胞裂解液,反复吹打后置冰浴 30 min,12 000 r/min,4°C离心 30 min,取上清,应用BIO-RAD法测定蛋白含量。取蛋白30μg做SDS-PAGE电泳,将蛋白样本转移至PVDF膜上。取出膜后用5%脱脂奶粉封闭1 h,PBST洗3次,加入抗 LC3抗体(1∶1 000),4°C孵育过夜。次日,PBST洗3次,相应加入过氧化物酶标记山羊抗兔IgG(1∶2 000),放在脱色摇床摇1 h,PBST洗3次。ECL显色,BIO-RAD凝胶成像系统拍照分析。以GAPDH为内参蛋白,实验重复3次。
1.6 划痕法检测PASMCs迁移
组织块法培养PASMCs经消化制成细胞悬液,以每孔5×104细胞数接种于24孔板中,细胞贴壁后,待细胞生长至80%融合后,用无菌200μl的移液器吸头划痕,吸去原有15%FBS培养液,去除因划痕引起的飘散细胞,分别按照实验分组处理24 h后,用倒置相差显微镜观察、拍照,每条划痕随机取3处用共聚焦软件测量划痕区域内两侧细胞边缘的距离,每组设6个复孔。具体方法参照文献[5]。在划痕实验开始时,即0 h,设定划痕区域内两侧细胞边缘的距离为L0;经过24 h后,划痕区域内两侧细胞边缘的距离为L24。则该细胞的迁移距离为:D24=L0-L24。以该视野内细胞的迁移距离的平均数为准。
1.7 统计学分析
所有数据均用均数±标准差(¯x±s)表示,采用SPSS 15.0软件处理。多组间的比较采用单因素方差分析,组间差异比较采用q检验。
2 结果
2.1 氯喹对低氧PASMCs增殖的影响
MTT结果表明:与对照组相比,单独应用自噬抑制剂氯喹,PASMCs细胞增殖率变化不明显(P>0.05);1%低氧24 h促进肺动脉平滑肌细胞增殖,为(114.2±4.6)%(P<0.05);50μmol/L氯喹作用于低氧诱导的肺动脉平滑肌细胞24 h后,明显抑制了低氧诱导的细胞增殖,为(105.6±7.3)%(P<0.05,图 1)。
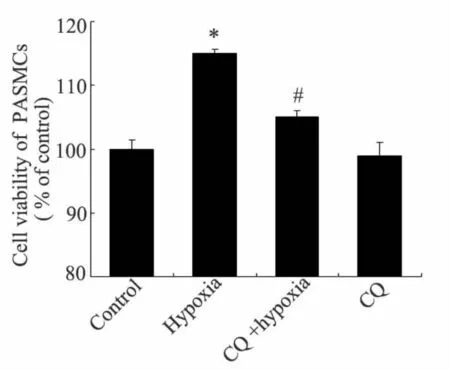
Fig.1 Vitality of PASMCs treated with hypoxia and/or CQ for 24 hCQ:Chloroquine*P<0.05 vs control group;#P<0.05 vs hypoxia group
2.2 氯喹对低氧PASMCs迁移能力的影响
与对照组相比,1%低氧24 h能促进肺动脉平滑肌细胞迁移(65.2±4.8)μm(P<0.05)。与低氧组相比,应用自噬抑制剂氯喹抑制了低氧诱导的细胞迁移(26.3±2.1)μm(P<0.05)。单独应用氯喹细胞迁移无明显变化(21.5±1.9)μm(P>0.05,图2)。

Fig.2 Cell migration of PASMCs with wound healing migration assayA:Cells images results by light microscope;B:Statistical analysis graph;PASMCs:Pulmonary arterial smooth muscle cells;CQ:Chloroquine*P<0.05 vs control group;#P<0.05 vs hypoxia group
2.3 氯喹对低氧PASMCs自噬空泡的影响
肺动脉平滑肌细胞放置于1%低氧培养箱中24 h,MDC荧光染色信号显著增强,大量自噬空泡积聚,与对照组相比显著增加,荧光定量分析平均荧光强度为(195.1±10.9)%(P<0.01),表明低氧引起了细胞自噬的发生;而自噬抑制剂氯喹与低氧联合作用时,与低氧组相比自噬空泡增加更加明显,平均荧光强度为 (310.3±5.8)%(P<0.05,图 3),说明作用于溶酶体的自噬抑制剂氯喹,抑制了低氧条件下的自噬体降解过程,导致了自噬空泡结构的积聚增加,抑制了自噬晚期的溶酶体融合与降解过程。
2.4 氯喹对低氧PASMCs自噬蛋白LC3表达的影响
与正常对照组相比,肺动脉平滑肌细胞低氧24 h,细胞 LC3-II蛋白表达增强,LC3-II/LC3-I比值为(0.31±0.06)(P<0.05)。与低氧组相比,当自噬抑制剂氯喹与低氧联合应用后,细胞LC3-II蛋白表达增加明显,LC3-II/LC3-I比值为 (0.63±0.02)(P<0.05,图4)。说明应用自噬抑制剂氯喹明显增加了低氧诱导的自噬标志性蛋白LC3II的表达,表明由细胞自噬体形成过程被显著抑制。
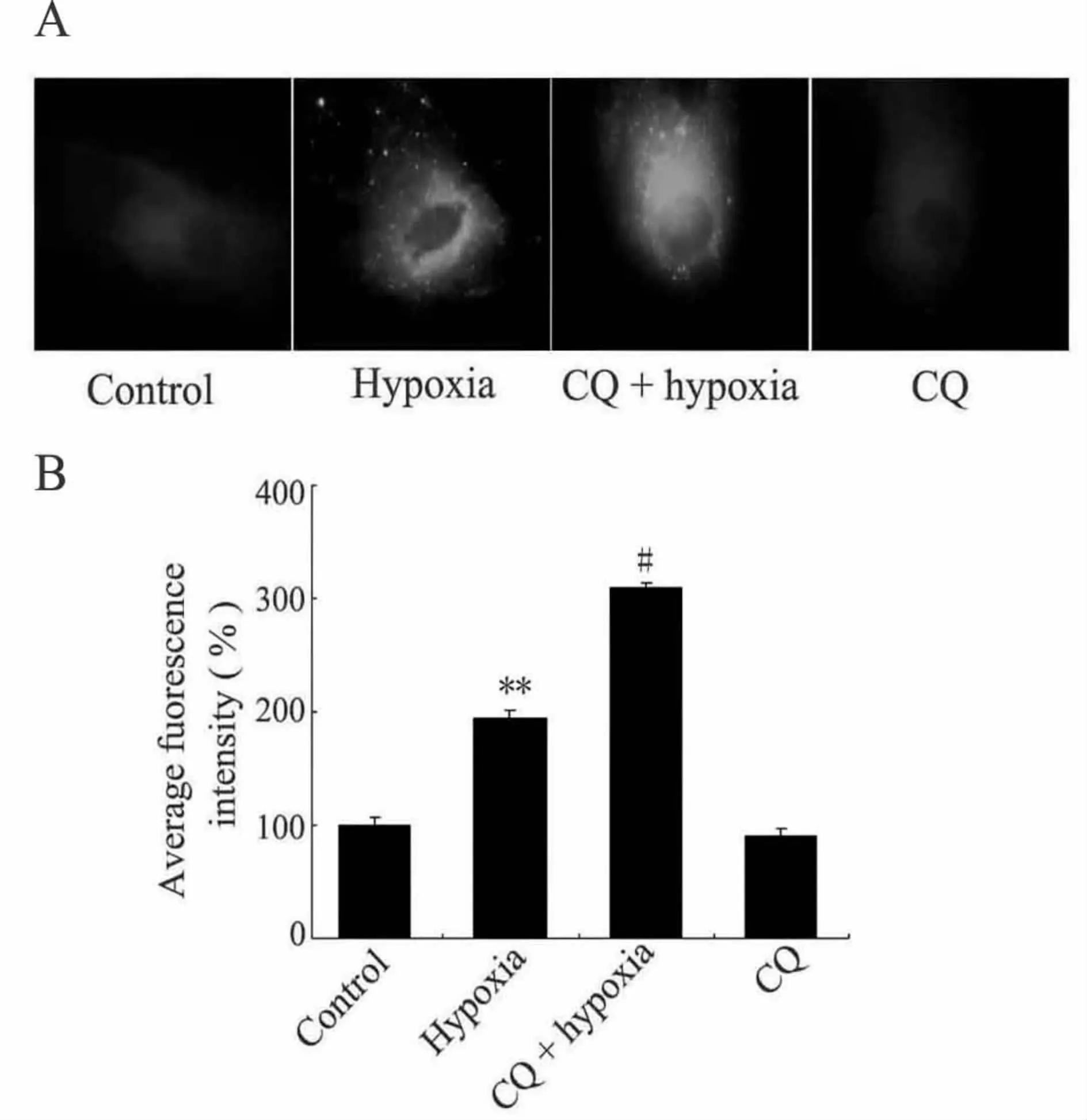
Fig.3 Autophagic vacuoles detected by fluorescence microscope in PASMCsA:MDCfluorescent staining images(×1 000);B:Statistical analysis graph;PASMCs:Pulmonary arterial smooth muscle cells;CQ:Chloroquine**P<0.01 vs control group;#P<0.05 vs hypoxia group
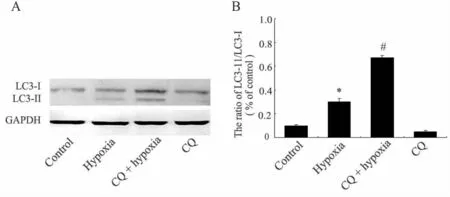
Fig.4 Detection of LC3 protein expression by Western blot and the ratio of LC3-II to LC3-I in PASMCs A:Western blot analysis results;B:Relative ratio of LC3-II/LC3-I;PASMCs:Pulmonary arterial smooth muscle cells;LC3:Microtubule-associated protein-1 light chain 3*P<0.05 vs control group;#P<0.05 vs hypoxia group
3 讨论
低氧性肺动脉高压的发病机理十分复杂,涉及多因素、多因子调节的一系列病理过程[6]。主要以肺动脉平滑肌细胞增生、肥大、迁移、中膜增厚、外周小血管肌化、细胞外基质异常堆积为主,肺动脉平滑肌增殖是肺血管重塑的直接因素。有研究表明,1%低氧作用于肺动脉平滑肌细胞,促进细胞增殖[7]。与本实验MTT结果一致:低氧下,肺动脉平滑肌细胞增殖率明显上升。同时我们应用细胞划痕实验对细胞迁移进行检测,结果表明低氧处理肺动脉平滑肌细胞24 h,细胞迁移速度明显增加。说明在低氧模型下,平滑肌细胞增殖和迁移与肺动脉高压疾病发生发展密切相关。
自噬既可以作为适应性机制,清除老化的、错误折叠的蛋白和受损的细胞器(如线粒体),并且能够在一定程度上促进细胞增殖和迁移[8]。而过度激活的自噬导致的细胞死亡即自噬性细胞死亡,加速疾病的发展和恶化[9,10]。研究表明,低氧能够诱导多种肿瘤细胞发生自噬[11]。在COPD病人的肺组织样本中,自噬蛋白Beclin1和LC3表达明显增加[12]。此外,CSE诱导的脐带静脉内皮细胞损伤模型中,自噬特异性抑制剂3-甲基腺嘌呤(3-methyladenin,3-MA)和自噬调节基因ATG5沉默都能够显著延缓内皮细胞死亡过程[13]。不过,细胞自噬在低氧性肺血管平滑肌细胞增殖中的作用还需进一步探讨。研究表明,氯喹能够通过改变溶酶体功能,阻断自噬相关的溶酶体融合和代谢过程[14]。利用 Sonic hedgehog(Shh)诱导的心血管平滑肌细胞增殖中,利用自噬抑制剂3-MA或ATG7的siRNA,都能够明显降低细胞的增殖和迁移过程[15]。通过ATG5的siRNA技术,能够显著抑制野百合碱模型里小鼠肺动脉平滑肌的增殖过程,而且体内和体外实验中也表明这一过程与自噬进程和溶酶体相关的代谢调控密切相关[16]。本实验MDC染色结果表明,肺动脉平滑肌细胞在1%低氧作用24 h后有大量自噬空泡积聚,而应用自噬抑制剂氯喹加剧了低氧诱导的自噬空泡积聚。同时LC3-II蛋白表达增强,而氯喹明显加强了低氧引起的LC3-II的表达,与MDC染色结果一致,推测自噬抑制剂氯喹可能通过抑制自噬体与溶酶体的融合过程,即抑制了自噬溶酶体功能从而抑制降解过程,最终导致自噬空泡的过度积聚从而抑制自噬的进程。而MTT结果和划痕实验结果表明,自噬抑制剂氯喹抑制了低氧引起的促细胞增殖和迁移效应。以上结果说明氯喹能够抑制低氧引起的肺动脉平滑肌细胞自噬,进而抑制低氧引起肺动脉平滑肌细胞增殖和迁移的水平,我们推测这很可能是通过影响自噬溶酶体的功能和进一步的蛋白代谢过程来发挥调控作用的。
综上所述,我们推测在低氧作用的肺动脉平滑肌细胞增殖过程中,自噬可能作为一种适应性机制,通过降解以及再循环细胞内代谢产物等来提供能量发挥促进细胞增殖与迁移作用,这成为肺动脉高压病理生理过程和血管重构的一个重要环节。而自噬抑制剂氯喹则通过影响溶酶体功能,影响自噬相关的代谢功能,从而达到抑制低氧对肺动脉平滑肌细胞增殖的促进作用,相关理论仍有待于深入的探讨。本实验的研究结果为扩展低氧性肺动脉高压疾病的研究和药物治疗理论基础,也为氯喹的新适应症的开发提供了全新的思路。
[1] Huertas A,Palange P.COPD:a multifactorial systemic disease[J].Ther Adv Respir Dis,2011,5(3):217-224.
[2] Dunn WA Jr.Autophagy and related mechanisms of lysosome-mediated protein degradation[J].Trends Cell Biol,1994,4(4):139-143.
[3] Bodas M,Min T,Vij N.Critical role of CFTR-dependent lipid rafts in cigarette smoke-induced lung epithelial injury[J].Am J Physiol Lung Cell Mol Physiol,2011,300(6):L811-820.
[4] Glick D,Barth S,Macleod KF.Autophagy:cellular and molecular mechanisms[J].J Pathol,2010,221(1):3-12.
[5] 孙胡蓉,韦 琳,刘肖珩,等.CXCR1/2在剪应力诱导血管内皮细胞迁移中的作用[J].生物医学工程学杂志,2009,26(3):512-517.
[6] Sommer N,Dietrich A,Schermuly RT,et al.Regulation of hypoxic pulmonary vasoconstriction:basic mechanisms[J].Eur Respir J,2008,32(6):1639-1651.
[7] Green DE,Kang BY,Murphy TC,et al.Peroxisome proliferator-activated receptor gamma(PPARγ)regulates thrombospondin-1 and Nox4 expression in hypoxia-induced human pulmonary artery smooth muscle cell proliferation[J].Pulm Circ,2012,2(4):483-491.
[8] 何云凌,吴丽颖,黄 欣,等.自噬对不同低氧条件下PC12细胞存活的影响[J].中国应用生理学杂志,2013,29(3):193-196.
[9] Hetz C.Apoptosis,necrosis and autophagy:from mechanisms to biomedical applications[J].Curr Mol Med,2008,8(2):76-77.
[10]孔晓霞,张宏宇,陈 然,等.神经胶质瘤U251细胞氧化损伤中自噬和凋亡过程的时间顺序[J].中国应用生理学杂志,2011,27(4):471-474.
[11] Abraham RT.mTOR as a positive regulator of tumor cell responses to hypoxia[J].Curr Top Microbiol Immunol,2004,279:299-319.
[12] Ryter SW,Choi AM.Autophagy in the lung[J].Proc Am Thorac Soc,2010,7(1):13-21.
[13] Csordas A,Kreutmayer S,Ploner C,et al.Cigarette smoke extract induces prolonged endoplasmic reticulum stress and autophagic cell death in human umbilical vein endothelial cells[J].Cardiovasc Res,2011,92(1):141-148.
[14] Solomon VR,Lee H.Chloroquine and its analogs:a new promise of an old drug for effective and safe cancer therapies[J].Eur J Pharmacol,2009,625(1-3):220-233.
[15] Li H,Li J,Li Y,et al.Sonic hedgehog promotes autophagy of vascular smooth muscle cells[J].Am J Physiol Heart Circ Physiol,2012,303(11):1319-1331.
[16] Long L,Yang X,Southwood M,et al.Chloroquine prevents progression of experimental pulmonary hypertension via inhibition of autophagy and lysosomal bone morphogenetic protein type II receptor degradation[J].Circ Res,2013,112(8):1159-1170.

