Nrf2及其相关因子在非酒精性脂肪肝炎形成过程中的作用*
蔡月琴,张利棕,王德军,陈方明,陈芝芸,朱科燕,李剑霜,严茂祥
(浙江中医药大学,杭州310053)
非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)是非酒精性脂肪性肝病由单纯肝脂肪变向肝硬化甚至肝细胞肝癌进展的关键阶段。随着我国生活水平的提高和饮食结构的变化,NASH的发病率有逐渐增加的趋势,已经成为危害人类健康的常见病。但目前NASH的发病机制尚未完全阐明。核因子 E2相关因子 2(NF-E2-related factor 2,Nrf2)是细胞重要的防御转录因子,对肝脏有着多方面的影响,如调节肝脏的代谢、解毒及促进肝细胞再生,在肝损伤、脂肪肝、肝纤维化及肝癌等方面也具有保护作用[1-3]。本文通过观察大鼠NASH形成过程中脂质代谢、氧化应激水平、肝细胞脂肪变、Nrf2及相关关键因子的转录和蛋白水平的变化,以进一步探讨NASH的发病机制。
1 材料与方法
1.1 实验动物
雄性SD大鼠40只,体重160~180 g,由上海斯莱克实验动物有限公司提供,许可证号:SCXK(沪)2007-0005。温度(20±2)℃,相对湿度50%~60%,光照12 h明暗交替,饲养于浙江中医药大学动物实验研究中心[SYXK(浙)2008-0115]。
1.2 主要试剂及仪器
胆固醇购自安徽天启化工科技有限公司,批号:20120327,三号胆盐购自杭州微生物试剂有限公司,批号:20111103-00,丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬酸氨基转移酶(aspartate aminotransferase,AST)、甘油三酯 (triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒购自德赛诊断系统(上海)有限公司。大鼠一抗Nrf2、血红素氧合酶1(heme oxyenase 1,HO-1)、依赖还原型辅酶/II醌氧化还原酶1(NADPH quinone oxidoreductase 1,NQO1)、γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthethase,γ-GCS)、谷胱甘肽巯基转移酶(glutathione S-transferase,GST)抗体均购自Abcam公司,内参β-actin抗体购自Santa Cruze Biotechnology;Odyssey羊抗兔荧光二抗、羊抗鼠荧光二抗均购自LI-COR公司,RNAiso plus、RT-PCR反转录试剂盒、SYBR Green荧光定量试剂均购自TaKaRa。全蛋白提取试剂盒、BCA蛋白含量检测试剂盒购自杭州昊天生物科技有限公司。荧光定量 PCR仪(BIO-RAD,IQ5),生物安全柜(Thermo),微量核酸测定仪(Thermo,Nano-drop),定性 PCR仪(BIO-RAD,PTC200),垂直电源系统(BIO-RAD),近红外激光成像系统(LI-COR),多功能酶标仪(Thermo),全自动生化分析仪(HITACHI)
1.3 NASH大鼠模型建立与分组
40只SD大鼠适应性饲养1周后随机分为正常组、模型组,每组各20只,正常组给予标准饲料(粗脂肪含量4.62%)喂养,模型组给予高脂饲料喂养,高脂饲料在标准饲料的基础上加10%猪油、2%胆固醇、0.5%胆酸钠、5%蛋黄粉。在造模第4周末,两组实验大鼠各随机处理10只,剩余所有大鼠均在造模第12周末处理。大鼠处理前晚禁食不禁水18 h,用10%水合氯醛麻醉,腹主动脉采血,分离血清待用,收集肝脏标本,部分在固定液中固定用于病理观察,其余肝组织存入-80℃待用。
1.4 肝功能、脂质代谢指标的检测
采用全自动生化仪检测大鼠血清和肝组织中ALT、AST、TG、TC、HDL-C、LDL-C水平。
1.5 肝组织病理学检测
以油红O染色光镜检测肝组织脂肪沉积;常规HE染色光镜观察肝组织脂肪变程度、炎症程度和气球样变程度,参照中华医学会肝病学分会脂肪肝和酒精性肝病学组2010年制订的《非酒精性脂肪性肝病诊疗指南》[4],并计算非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)活动度积分(NAFLD activity score,NAS),NAS计分:肝细胞脂肪变 +小叶内炎症+肝细胞气球样变,NAS<3分可排除NASH,NAS>4分则可诊断NASH,介于两者之间为NASH可能。免疫组化法检测肝组织中Nrf2的表达情况。
1.6 Nrf2及其相关因子mRNA表达的测定
按Trizol说明书提取大鼠肝组织总RNA,测定A260/A280的比值及总RNA浓度。用逆转录试剂盒合成cDNA,SYBR Green法进行Realtime PCR扩增。每个样本3个复孔。大鼠 Nrf2上游引物:5’-CTGCCATTAGTCAGTCGCTCTC-3’,下游引物:5’-TCAGTGTGCTTCTGGTTGAAAG-3’;HO-1上 游 引 物:5’-TTTCCCCAGTTCTACCAGTG TAA-3’,下游引物:5’-CCTCAAAAGACAGCCCTACTTG-3’;NQO1上游引物:5’-CTCCACCCACTTGTTGCTATTA-3’,下游引物:5’-GTTAGTCCCTCAGCCATTGTTT-3’;γ-GCS上游引物:5’-TGAGCATAGACACCATCATCAA-3’,下游引物:5’-TGTTTTCAAGGTAGGAGT TCAGA-3’;GST上游引物:5’-CCGTCACCCTCTGATTGATTTA-3’,下游引物:5’-TCCTGATTTCTCTGC TCCTTTC-3’;内参照 GAPDH上游引物:5’-GGCACAGTCAAGGCTGAGAATG-3’,下游引物:5’-ATGGTG GTGAAGACGCCAGTA-3’。以上荧光定量PCR引物序列均由生工生物工程(上海)有限公司设计并合成。目标基因与内参照基因扩增效率接近100%情况下,以内参照作为标准进行相对定量,采用 2-△△CT计算大鼠肝脏组织中 Nrf2、Keap1、HO-1、NQO1、γ-GCS和GSTmRNA相对表达水平。
1.7 Nrf2及其相关因子蛋白水平的测定
将大鼠肝组织冰上匀浆,采用全蛋白提取试剂盒提取总蛋白,BCA法进行蛋白含量测定后,蛋白样品加入5×SDS加样缓冲液进行变性,行SDS-PAGE凝胶分离,采用电泳湿转方法将凝胶上的蛋白条带转移到醋酸纤维素膜(NC膜)上,电压为120 V,转膜2 h。将含蛋白的NC膜在PBS溶解的5%脱脂奶粉中室温封闭 2 h(摇床上放置)后,分别与 Nrf2、Keap1、HO-1、NQO1、γ-GCS和 GST等一抗 4℃孵育过夜。TBST洗5 min×5次,最后用近红外染料标记的二抗(Li-COR)室温孵育 1.5 h,用 TBST洗 5 min×5次,将膜在近红外双色激光成像系统(Odyssey)上扫描。采集图像并进行半定量分析,以目标蛋白/actin的灰度比值表示各个蛋白表达水平。
1.8 统计学处理
2 结果
2.1 NASH大鼠肝功能及脂代谢的变化
由表1和表2可见,4周模型组大鼠血清ALT、AST、TC较正常组均显著增高(P<0.01),肝组织TC、TG、LDL-C也显著高于同期正常组(P<0.01),但血清TG和肝内HDL-C含量无明显变化;12周模型组大鼠血清 ALT、AST、TC持续增高(P<0.01,P<0.05),同时血清TG较同期正常组显著增高(P<0.01),肝组织HDL-C较同期正常组显著降低(P<0.05);且12周模型组大鼠血清 TG和肝组织 TC、LDL-C含量显著高于4周模型组大鼠(P<0.01,P<0.05)。
Tab.1 The levels of ALT,AST,TC,TG in rat serum(,n=10)

Tab.1 The levels of ALT,AST,TC,TG in rat serum(,n=10)
Group ALT(U/L) AST(U/L) TC(mmol/L) TG(mmol/L)Control(4 weeks) 25.40±5.36 89.89±14.98 1.23±0.21 0.35±0.09 Model(4 weeks) 54.10±14.49** 151.00±15.73** 3.47±1.25** 0.31±0.08 Control(12 weeks) 40.10±9.09 130.70±18.13 1.36±0.24 0.40±0.14 Model(12 weeks) 60.14±14.96* 168.38±32.12* 3.17±0.60** 0.62±0.13**##
ALT:Alanine aminotransferase;AST:Aspartate aminotransferase;TC:Total cholesterol;TG:Triglyceride*P<0.05,**P<0.01 vs control group;##P<0.01 vs model(4 weeks)groupTC:Total cholesterol;TG:Triglyceride;HDL-C:High density lipoprotein cholesterol;LDL-C:Low density lipoprotein cholesterol*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model(4 weeks)group
Tab.2 The content of TC,TG,HDL-C,LDL-Cin rat liver(mmol/g,,n=10)

Tab.2 The content of TC,TG,HDL-C,LDL-Cin rat liver(mmol/g,,n=10)
Group TC TG HDL-C LDL-C Control(4 weeks) 0.55±0.09 0.86±0.22 0.06±0.02 0.19±0.07 Model(4 weeks) 1.09±0.23** 1.29±0.27** 0.07±0.02 0.29±0.04**Control(12 weeks) 0.71±0.09 0.97±0.14 0.10±0.04 0.29±0.05 Model(12 weeks) 1.43±0.23**## 1.13±0.20* 0.07±0.01* 0.35±0.06*#
2.2 NASH大鼠肝组织脂肪沉积的变化
油红O染色法检测NASH大鼠肝组织内脂肪沉积变化,由图1可见,4周和12周正常组大鼠肝细胞均形态正常,胞浆未见红染的脂肪滴,细胞核呈蓝色,4周和12周模型组大鼠肝细胞内沉积大量被染成红色的脂肪滴,脂质含量显著高于4周和12周正常组大鼠肝细胞(P<0.01);12周模型组大鼠肝细胞脂质含量显著高于4周模型组大鼠(P<0.01)。
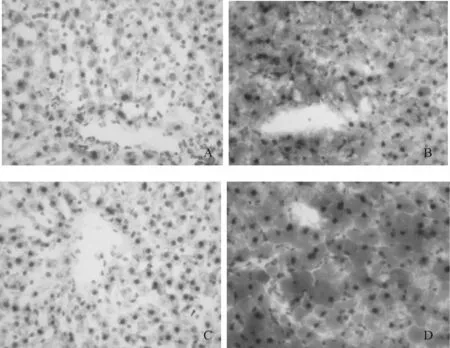
Fig.1 Oil red Ostaining in NASH rats liver tissue(×400)
2.3 NASH大鼠肝组织病理学改变
HE染色观察NASH大鼠肝组织病理学改变,由图2、表3可见,4周和12周正常组大鼠肝细胞结构正常,未见肝细胞脂肪变、炎症和气球样变;4周模型组大鼠,光镜下可见肝细胞脂肪变,以大泡性为主,炎症和气球样变少见(P<0.01),NAS为 3.7,根据中国非酒精性脂肪性肝病诊疗指南,判断为NASH可能;12周模型组大鼠大量肝细胞脂肪变进一步严重,呈弥漫性,伴有炎症,肝细胞气球样变程度显著高于正常组和4周模型组(P<0.01),NAS为 6.5,可诊断为 NASH。
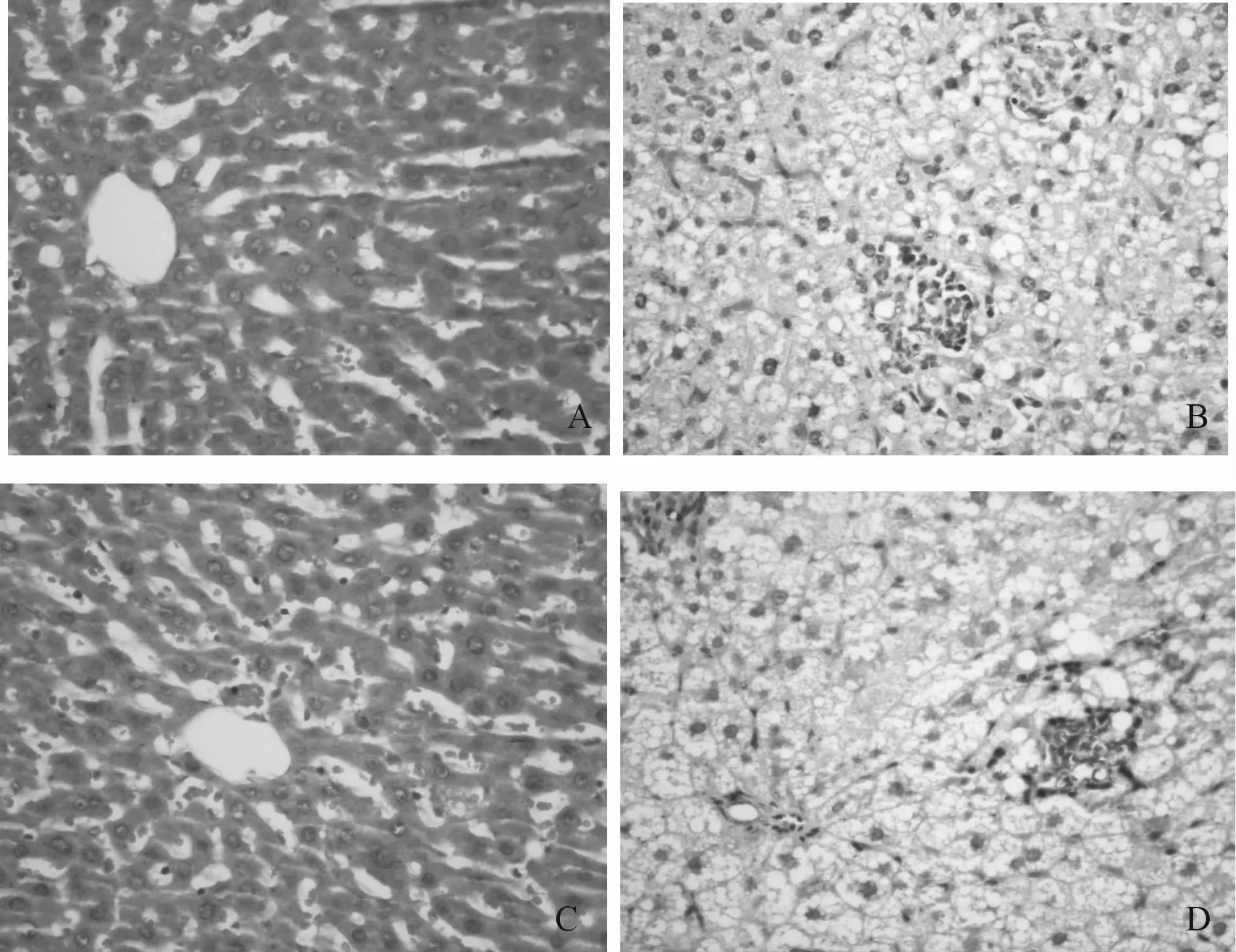
Fig.2 Pathological changes in NASH rats liver(HE×400)
2.4 NASH大鼠肝组织Nrf2表达情况
免疫组化DAB染色,Nrf2阳性细胞出现棕黄色(图3)。4周和12周正常组大鼠肝细胞胞浆和细胞核中较少表达Nrf2;4周模型组大鼠肝细胞细胞核中Nrf2有较多表达,显著高于正常对照组(P<0.01),12周模型组中的Nrf2在肝细胞胞浆和细胞核中强表达,显著高于正常组和4周模型组(P<0.01,表 3)。
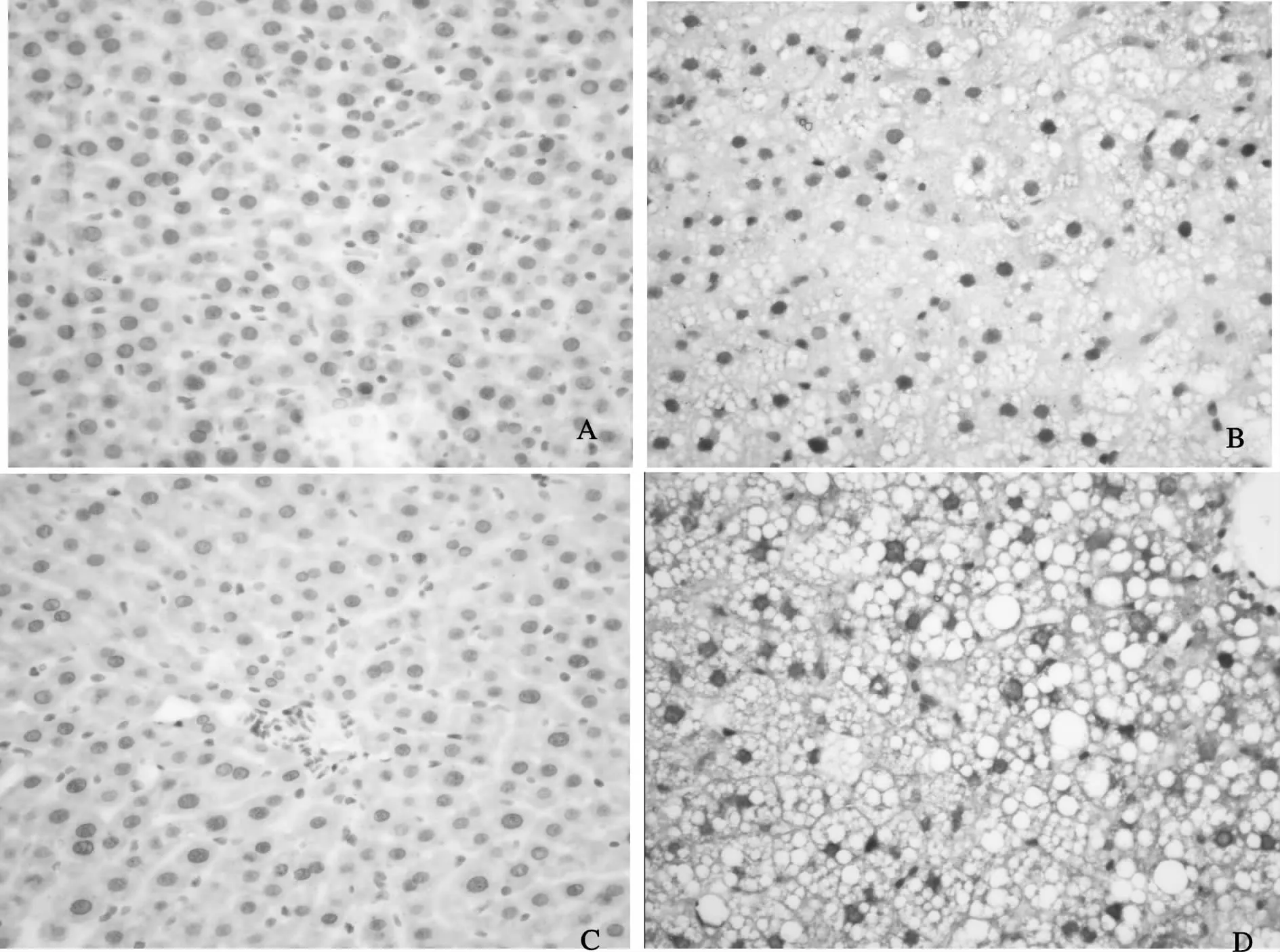
Fig.3 The positive expression of Nrf2 in NASH rats liver(immunocytochemistry,DAB×400)
2.5 NASH大鼠肝组织Nrf2及相关因子mRNA水平的变化
从表4可见,与正常组相比,4周模型组大鼠肝组织中NQO1、γ-GCS、GST的mRNA水平均显著降低(P<0.05,P<0.01),而 Nrf2、HO1的 mRNA水平变化无显著差异(P>0.05);12周模型组大鼠肝组织中Nrf2、HO1、NQO1的mRNA表达显著高于正常组(P<0.01),γ-GCS、GST的mRNA水平均显著低于正常组(P<0.01)。
2.6 NASH大鼠肝组织Nrf2及相关因子蛋白的影响
与正常组相比,4周模型组大鼠肝组织中NQO1、GST蛋白表达量显著降低(P<0.05),而Nrf2、HO1、γ-GCS蛋白表达量变化不明显(P>0.05,图 5、6);12周模型组大鼠肝组织中 HO1、NQO1、γ-GCS、GST蛋白表达量均有不同程度的升高或降低(P<0.05),而Nrf2蛋白表达量变化仍不明显(P>0.05,图 5、6)。
Tab.3 NASof hepatic steatosis,inflammation and hepatocellular ballooning and expression of Nrf2 in NASH rats(,n=10)
*P<0.05,**P<0.01 vs control group;##P<0.01 vs model(4 weeks)group
Group Oil red O staining Positive Nrf2 expression Control(4 weeks) 21299.25±6049.93 0 0 0 137.11±32.51 Model(4 weeks) 158859.22±51149.88** 1.50±0.53** 0.90±0.32**1.30±0.48** 4085.83±727.80**Control(12 weeks) 26232.75±9397.61 0 0 0 372.83±69.40 Model(12 weeks) 537174.17±107513.36**## 2.90±0.32**## 1.00±0.00**2.60±0.52**## 68486.22±9450.01**##Steatosis score Inflammation score Hepatocellular ballooning score
Tab.4 Levels of Nrf2,HO1,NQO1,γ-GCS,GST mRNA in rat liver(,n=10)

Tab.4 Levels of Nrf2,HO1,NQO1,γ-GCS,GST mRNA in rat liver(,n=10)
Nrf2:NF-E2-related factor 2;HO1:Heme oxyenase 1;NQO1:NADPH quinone oxidoreductase l;γ-GCS:γ-glutamylcy steine synthethase;GST:Glutathione S-transferase*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model(4 weeks)group
Group Nrf2 HO1 NQO1 γ-GCS GST Control(4 weeks) 1.007±0.124 1.024±0.236 1.014±0.178 1.008±0.137 1.006±0.129 Model(4 weeks) 0.952±0.079 1.116±0.101 0.838±0.073* 0.668±0.045** 0.747±0.054**Control(12 weeks) 1.002±0.071 1.002±0.072 1.002±0.059 1.002±0.071 1.001±0.052 Model(12 weeks) 1.282±0.071**## 1.687±0.102**## 2.895±0.422**## 0.725±0.119** 0.752±0.075**
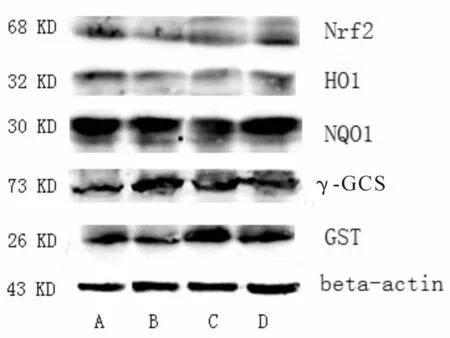
Fig.4 The Western-blot bands of Nrf2 and related factors in NASH rats
3 讨论
NASH的发病机制至今仍未完全阐明,亦缺乏有效的防治手段。“二次打击”是目前最为成熟的解释其发病机制的学说:第一次打击为胰岛素抵抗对肝细胞的损伤,肝脏形成脂肪变性;第二次打击是促进疾病发展的关键,主要为各种原因所致的氧化应激和脂质过氧化损伤及其相关事件,使脂肪变性的肝细胞发生炎症坏死,甚至并发进展性肝纤维化、肝硬化[5,6]。氧化应激是 NASH发生发展过程中的中心环节,抗氧化应激在NASH的防治中具有十分重要意义。Nrf2是抗氧化酶表达过程中的关键调控因子,对于稳定氧化-抗氧化的平衡,减轻氧化应激导致的损害可起到关键性的作用[7,8]。正常情况下Nrf2与其受体结合,在氧化应激等情况下与受体解离被激活并发挥转录活性,从胞浆转入细胞核中与抗氧化反应元件(ARE)结合,启动抗氧化反应元件调控的多种抗氧化酶类基因、Ⅱ相解毒酶基因的表达,包括 HO-1、NQO1、γ-GCS、GST等基因[9,10]。
本实验的生化及病理结果均表明成功建立了NASH大鼠模型,高脂饮食喂养4周时,大鼠血清ALT、AST、TC和肝内 TC、TG、LDL-C含量显著高于同期正常饮食组大鼠,但血清TG含量和肝内HDL-C水平无明显变化,肝细胞内可见红染的脂肪滴,脂肪变程度加重,炎症和气球样变少见;高脂饮食喂养12周时,大鼠血清 ALT、AST、TC和肝组织 TC、TG、LDL-C含量均持续增高,血清TG水平也较同期正常大鼠明显增高,肝内HDL-C显著降低,脂肪沉积和脂肪变进一步严重,呈弥漫性,伴明显肝细胞气球样变和炎症。以上结果表明采用高脂肪、高胆固醇饮食喂养大鼠,外源性脂肪显著增加,经小肠吸收入血液的乳糜颗粒增多,体内脂类合成增加,导致肝脏脂质代谢发生障碍,肝内脂质类物质合成与分泌的动态平衡失调,当肝内TG蓄积到一定程度,即发生肝脏组织学改变,形成脂肪肝;在病因(高脂饮食)持续存在时,单纯性脂肪肝进展为脂肪性肝炎,呈现了NASH病变的渐进性发展过程。
免疫组化检测还发现,高脂饮食喂养4、12周大鼠肝脏组织Nrf2在细胞核中表达强度明显大于同期正常饮食组大鼠,且12周大鼠肝细胞核内Nrf2表达显著强于4周大鼠,NASH大鼠肝组织中Nrf2表达上调现象进一步在mRNA水平检测中得到证实,与同期正常组大鼠相比,12周模型组大鼠肝组织中Nrf2 mRNA水平显著上调。然而Western blot结果显示,总Nrf2蛋白表达较正常虽有增高趋势,但无统计学差异,这提示,随着非酒精性脂肪性肝病的发生和发展,肝细胞内Nrf2总蛋白水平未发生明显变化,Nrf2可能通过增加稳定性从胞浆转入细胞核与ARE结合而激活,从而发挥对氧化应激所致的炎症损伤可能起的保护作用,Nrf2可能是单纯性脂肪肝向NASH转化过程中的一种主要风险因素。
HO1的抗氧化功能一方面与其阻止游离血红素参与氧化反应有关,而另一方面,HO1及其酶解产物胆红素、CO共同发挥抗氧化、抗炎、抑制细胞凋亡和改善组织微循环等作用,参与肝组织细胞的抗氧化应激损伤[11]。NQO1是一种调节细胞内物质处于氧化还原状态的黄素酶,对各种代谢引起的氧化应激反应具有保护作用,有研究表明,肝脏NQO1含量的增加,与Nrf2蛋白表达增加呈正相关。γ-GCS是体内还原性谷胱甘肽(GSH)合成的限速酶,增加γ-GCS的含量和活性,可以促进GSH的合成,增强组织细胞抗氧化应激的能力,GST是体内生物转化最重要的Ⅱ相代谢酶之一,可抑制微粒体过氧化反应及修复自由基引起的膜磷脂损伤,具有过氧化化物酶的活性[12]。本研究发现,高脂饮食喂养4周时,大鼠HO1的mRNA水平和蛋白表达均无明显变化,但是12周NASH大鼠HO1在mRNA水平和蛋白表达水平上均显著升高;NQO1 mRNA和蛋白水平在4周时表达下调,然而在12周NASH大鼠中NQO1 mRNA和蛋白均显著上调;4周和12周模型组大鼠γ-GCS、GSTmRNA水平和蛋白表达均显著低于同期正常组大鼠。提示高脂饲料引起NASH大鼠肝组织氧化应激的损伤,激活了Nrf2-ARE通路,Nrf2被活化,从而启动下游保护性基因HO-1、NQO1等,发挥其在组织氧化损伤的病理条件下对保护细胞的作用。而γ-GCS、GST基因的mRNA和蛋白表达在模型组轻度降低可能与其高峰出现的时间及抗氧化应激过程中的消耗有关,需要通过时效关系的进一步实验来证实。结合前期NASH大鼠血及肝脏MDA含量增加,肝脏SOD活性降低,与氧化应激相关的指标如过氧化酶体增殖物激活受体、核转录因子-κB及IκB均参与了NASH的研究结果[13,14],提示随着炎症的进展,模型组大鼠肝组织细胞的抗氧化应激能力减弱,进一步证实氧化应激确实参与了NASH的发生发展。
Tab.5 Levels of Nrf2,HO1,NQO1,rGCS,GST protein in rat liver(,n=10)

Tab.5 Levels of Nrf2,HO1,NQO1,rGCS,GST protein in rat liver(,n=10)
Nrf2:NF-E2-related factor 2;HO1:Heme oxyenase 1;NQO1:NADPH quinone oxidoreductase l;γ-GCS:γ-glutamylcy steine synthethase;GST:Glutathione S-transferase*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model(4 weeks)group
Group Nrf2 HO1 NQO1 rGCS GST Control(4 weeks) 1.000±0.000 1.024±0.236 1.014±0.178 1.008±0.137 1.006±0.129 Model(4 weeks) 0.791±0.027 0.978±0.170 0.692±0.084* 1.165±0.250 0.655±0.160*Control(12 weeks) 1.002±0.071 1.002±0.072 1.002±0.059 1.002±0.071 1.001±0.052 Model(12 weeks) 1.063±0.166 1.285±0.122*# 1.550±0.218*## 0.761±0.099*# 0.882±0.059*
本研究结果表明,Nrf2及相关因子参与的氧化应激可能是NASH发生发展的重要机制之一。
[1] Bataille AM,Manautou JE.Nrf2:a potential target for new therapeutics in liver disease[J].Clin Pharmacol Ther,2012,92(3):340-348.
[2] Hardwick RN,Fisher CD,Canet MJ,et al.Diversity in antioxidant response enzymes in progressive stages of human nonalcoholic fatty liver disease[J].Drug Metab Dispos,2010,38(12):2293-2301.
[3] Xu W,Shao L,Zhou C,et al.Upregulation of Nrf2 expression in non-alcoholic fatty liver and steatohepatitis[J].Hepatogastroenterology,2011,58(112):2077-2080.
[4] 中华医学会肝病学分会脂肪肝和酒精性肝病学组.中国非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):163-166.
[5] Day CP,James OF.Steatohepatitis:a tale of two“hits”[J].Gastroenterology,1998,114(4):842-845.
[6] Martel C,Esposti DD,Bouchet A,et al.Non-alcoholic steatohepatitis:new insights from OMICSstudies[J].Curr Pharm Biotechnol,2012,13(5):726-735.
[7] 林晓萍,李 雯,沈华浩.抗氧化应激转录因子-Nrf2的研究进展[J].中国病理生理杂志,2011,27(6):1234-1239.
[8] Chowdhry S,Nazmy MH,Meakin PJ,et al.Loss of Nrf2 markedly exacerbates nonalcoholic steatohepatitis[J].Free Radic Biol Med,2010,48(2):357-371.
[9] Rubiolo JA,Mithieux G,Vega FV.Resveratrol protects primary rat hepatocytes against oxidative stress damage:activation of the Nrf2 transcription factor and augmented activities of antioxidant enzymes[J].Eur J Pharmacol,2008,591(1-3):66-72.
[10] Zhang H,Liu H,Davies KJ.Nrf2-regulated phase II enzymes are induced by chronic ambient nanoparticle exposure in young mice with age-related impairments[J].Free Radic Biol Med,2012,52(9):2038-2046.
[11]李慧娜,齐 杰,李清君.甲醛炎性痛对大鼠脊髓H0-1表达的影响[J].中国应用生理学杂志,2012,28(2):165-169.
[12]江 刚,戴爱国.PI3K/Akt-aPKC-Nrf2调控大鼠气道上皮细胞r-谷氨酰半胱氨酸合成酶表达[J].中国应用生理学杂志,2011,27(1):115-119.
[13]严茂祥,陈芝芸,何蓓晖.山楂叶总黄酮对非酒精性脂肪性肝炎大鼠肝组织NF-kB及其抑制物表达的影响[J].中华中医药杂志,2009,24(2):139-143.
[14]陈芝芸,严茂祥,何蓓晖.大鼠非酒精性脂肪性肝炎形成中氧化应激水平变化及山楂叶总黄酮对其影响[J].医学研究杂志,2007,36(12):33-36.

