缺血后处理对缺血/再灌注大鼠心肌间质保护效应机制的探讨*
卢彦珍,王 佳,张翠英,宋 娟,李宝红,宋晓亮
(1.长治医学院病理生理学教研室,2.免疫学教研室,3.生理学教研室,4.药理学教研室,山西 长治046000)
心肌间质构成了心肌细胞生活的微环境,对心肌细胞不仅具有结构上的支持及保护作用,还具有细胞间信息传送、协调舒缩功能等作用。缺血/再灌注(ischemic/reperfusion,I/R)过程中心肌间质的损伤是导致心脏形态改变和功能障碍的重要因素[1]。近十几年来,随着“重编程”非心肌细胞使其成为心肌细胞,以及间质内Telocytes(TCs)网络的发现使人们认识到,研究心脏间质的结构和功能具有重要的理论和实践意义。缺血后处理(ischemic postconditioning,IPTC)是一种在组织缺血后持续再灌注前多次短暂再灌注/缺血处理,可以减轻再灌注损伤的内源性保护现象,具有缩小心肌梗死面积、改善心肌功能等与缺血预处理(ischemic preconditioning,IPC)相似的心脏保护作用[2],且由于可控性好,操作简便,可以方便地应用于临床,成为当前研究热点之一[3]。我们前期的研究显示[4],IPTC通过抑制基质金属蛋白酶抑制剂-2(matris metalloproteinases-2,MMP-2)的活性和表达对心肌间质有保护,但具体机制不详。金属蛋白酶抑制剂(tissue inhibitor of metalloproteinases,TIMPs)是基质金属蛋白酶 MMPs生理性抑制物,活性的 MMPs受特定的 TIMPs调节,那么TIMPs是否参与IPTC对心肌间质的保护作用?本研究通过观察MMP-2及其抑制物TIMP-2表达,探讨IPTC对I/R心肌间质损伤的保护机制,为IPTC抗心肌I/R损伤治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 主要试剂 MMP-2及TIMP-2多克隆抗体购自Santa Cruz公司;β-actin单克隆抗体和碱性磷酸酶标记的IgG二抗购自Sigma公司;RT-PCR检测试剂盒购自Takara公司;CK、LDH试剂盒购自长城公司。1.1.2 动物模型的建立和分组 取健康雄性SD大鼠24只,体重(250±30)g,采用 20%的乌拉坦 1 g/kg腹腔注射麻醉,仰卧位固定于鼠板,连接小动物呼吸机,在左侧第三、四肋间切开皮肤,钝性分离肌层,打开胸腔,充分暴露心脏,在左心耳与肺动脉圆锥之间于左心耳下约2 mm处穿线后随机分为3组(n=8):(1)假手术对照(SC)组,穿线后旷置60 min;(2)I/R组,结扎左冠状动脉前降支20 min,解除结扎灌注 40 min;(3)IPTC组,按 Zhao[5]等的方法在缺血后立即给予再灌注30 s、缺血30 s,连续3个循环,复制缺血后处理动物模型。复制模型的可靠性用连续监视心电图Ⅱ导联变化和结扎区心脏表面颜色的变化来判断,结扎左冠状动脉前降支后心电图ST段抬高,结扎相应部位心脏表面肉眼观变暗变紫说明缺血成功,解除结扎后ST段下降1/2以上标志再灌注成功。
1.2 方法
1.2.1 左室功能测定 从右颈总动脉插入 PE-50软质塑料导管至左心室,应用生理记录仪记录左心室压力曲线,生理记录仪自动计算出左室内压上升及下降最大速率(±maximal rise velocity of left ventricular pressure,±dp/dt max)。记录各组缺血前和再灌注40 min左心室峰压(left ventricular systolic pressure,LVSP)、±dp/dt max及Ⅱ导心电图。
1.2.2 心肌羟脯氨酸含量测定 按文献方法[6],称取冻存左室心肌约100 mg,置于丙酮-乙醚混合液脱水、脱脂两次,取出晾干,105℃烤箱内干燥至恒重,精确称取干燥心脏样品10 mg,加入6 mol/L HCl 3 ml,105℃烘箱烤16 h。冷却后调 pH为6,加去离子水至 10 ml,以 3 000 r/min离心 10 min,取 2 ml上清液与标准管和空白管一起测A值,计算出羟脯氨酸含量后换算成心肌胶原含量。
1.2.3 血清磷酸肌酸激酶和乳酸脱氢酶活性的检测 再灌注结束后,从大鼠颈动脉取血液2 ml,常温静置20 min后放入低温离心机,3 000 r/min离心5 min,分离血清后按照试剂盒说明进行操作,计算出血清磷酸肌酸激酶(creatinekinase,CK)和乳酸脱氢酶(lactate dehydrogerase,LDH)的活性。
1.2.4 Western blot检测心肌组织中 MMP-2和TIMP-2蛋白表达变化 取液氮冻存心肌60 mg粉碎后加入组织蛋白裂解液,置于匀浆器中匀浆,冰上裂解后离心,取上清得心肌组织提取液。蛋白定量后,以每泳道20μg蛋白上样,10%SDS聚丙烯酰胺凝胶电泳,再电转移至硝酸纤维素膜上。室温封闭1 h,加 MMP-2和 TIMP-2(1∶1 000稀释)一抗 4℃孵育过夜,TBST洗涤后,加入1∶5 000碱性磷酸酶标记的IgG二抗,室温孵育1 h,洗涤后,用化学发光法检测目的蛋白的表达水平。为校正上样误差,将每张膜上的目的蛋白洗脱后,按照上述步骤检测β-actin的表达水平。
1.2.5 RT-PCR技术检测心肌组织中 MMP-2和TIMP-2 mRNA的相对表达量 取储存于液氮中的心肌组织按照Trizol一步法提取心肌组织总RNA,经1%的琼脂糖电泳证实RNA的完整性后,用紫外分光光度仪进行总RNA定量和纯度检测,参照逆转录试剂盒(Takara公司)说明书行半定量逆转录-聚合酶链式反应。反应体系为:12.5μl SYBER Green,10 μmol/L上下游引物混合物 0.5μl,模板 1μl,加水补足25μl。反应条件为:95℃预变性5 min后进入PCR循环:95℃变性5 min,58℃退火 30 s,延伸 1 min,共32个循环。MMP-2、TIMP-2引物参照基因库基因序列设计,MMP-2上游引物5′-ACGATGGCAAGGTGTGGTGT-3′,下 游 引 物 5′-CCTTGGTCAGGACAGAAGCC-3′;TIMP-2上游引物 5′-ATTTATCTACACGGCCCC-3′,下游引物 5′-CAAGAACCATCACTTCTCT TG-3′。目的基因扩增过程中采用β-actin作为内参基因,根据2-ΔΔCt计算目的基因的相对表达水平。
1.3 统计学处理
2 结果
2.1 IPTC对心肌I/R损伤时心功能参数的影响
I/R组 LVSP、±dp/dt max均显著降低,与 SC组比较差异有统计学意义(P<0.01)。反应心脏功能的三项重要指标明显降低,表明I/R时心功能严重受损;而IPTC可使三项指标明显改善(P<0.05,P<0.01,表 1)。
Tab.1 Effect of IPTC on cardiac function in rat subjected to ischemia/reperfusion((kPa/s,,n=8)

Tab.1 Effect of IPTC on cardiac function in rat subjected to ischemia/reperfusion((kPa/s,,n=8)
SC:Sham control;I/R:Ischemic/reperfusion;IPTC:Ischemic postconditioning;LVSP:Left ventricular systolic pressure;dp/dt max:Maximal rise velocity of left ventricular pressure;-dp/dt max:Maximal fall velocity of left ventricular pressure**P<0.01 vs SC;#P<0.05,##P<0.01 vs I/R group
Group LVSP(kPa)dp/dt max -dp/dt max SC 13.37±2.16 783.13±54.72 564.41±37.33 I/R 6.83±1.75**424.23±35.26**325.25±48.24**IPTC 12.23±1.83## 647.51±48.95## 42143±45.81#
2.2 大鼠心肌胶原含量和血清CK、LDH活性的变化
I/R组大鼠心肌胶原含量明显减少,血清CK、LDH活性增高,与 SC组比较有统计学差异(P<0.01)。经过IPTC后大鼠心肌胶原含量明显升高,血清 CK、LDH活性明显降低(P<0.01,表 2)。
Tab.2 Changes of myocardial collagen content and the activitis of CK and LDH in serum among three group(,n=8)
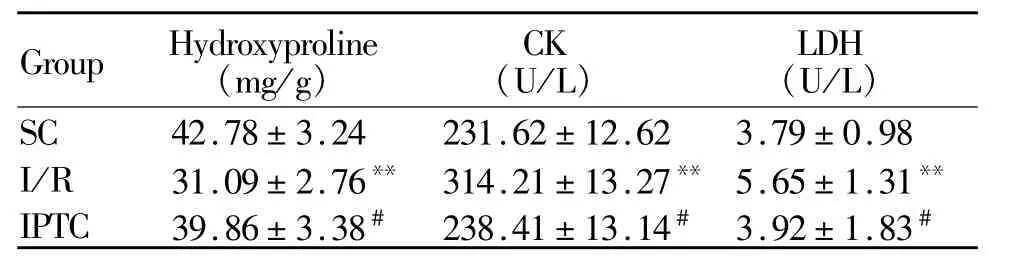
Tab.2 Changes of myocardial collagen content and the activitis of CK and LDH in serum among three group(,n=8)
SC:Sham control;I/R:Ischemic/reperfusion;IPTC:Ischemic postconditioning;CK:Creatine kinase;LDH:Lactate dehydrogenase**P<0.01 vs SCgroup;#P<0.05 vs I/R group
HydroxyprolineCKLDH
2.3 心肌组织MMP-2和TIMP-2蛋白表达结果
SC组心肌组织中MMP-2和TIMP-2蛋白有不同程度的表达,I/R组MMP-2的表达水平明显高于SC组,而 TIMP-2表达水平明显降低(P<0.01),有显著统计学差异。与I/R组相比,IPTC组MMP-2的表达水平显著降低,而TIMP-2表达水平明显升高(P<0.05,P<0.01,图 1)。
2.4 心肌组织MMP-2、TIMP-2 mRNA表达结果
与SC组相比,I/R组心肌MMP-2 mRNA水平明显升高(P<0.01),而 TIMP-2 mRNA水平显著降低(P<0.01);大鼠经 IPTC后,MMP-2 mRNA水平降低(P<0.01),而 TIMP-2 mRNA水平升高(P<0.05,图 2)。
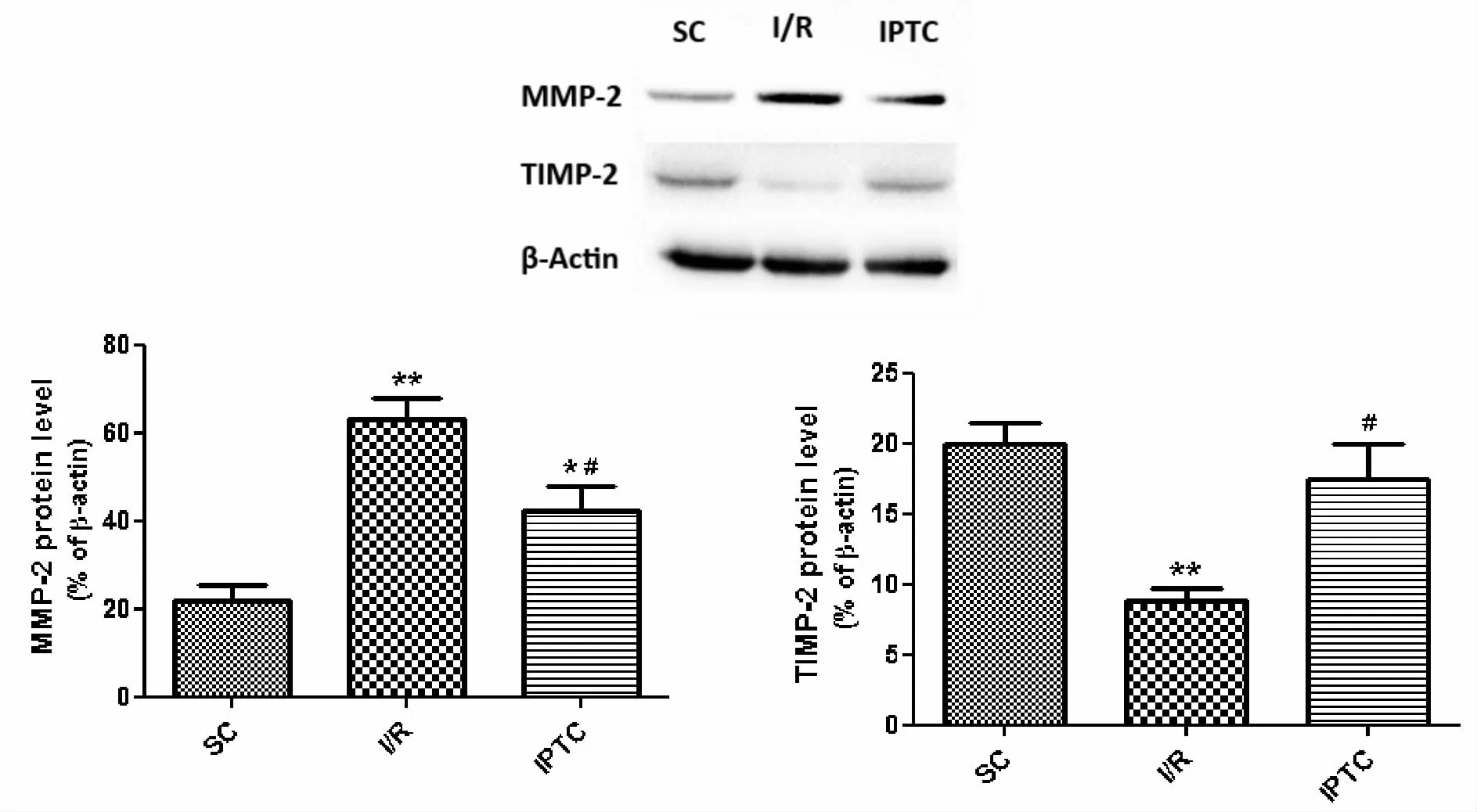
Fig.1 Protein expression levels of MMP-2 and TIMP-2 SC:Sham control;I/R:Ischemic/reperfusion;IPTC:Ischemic postconditioning;MMP-2:Matris metalloproteinases-2; TIMP-2: Tissue inhibitor of metalloproteinase-2
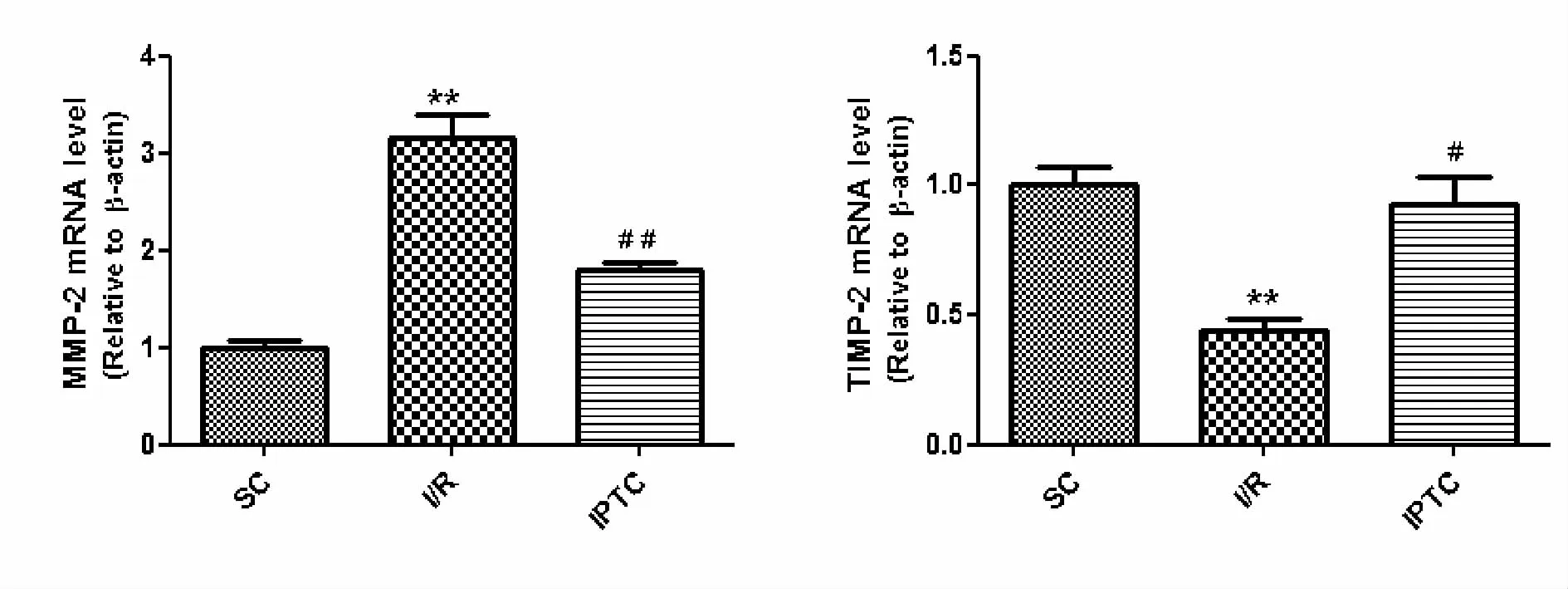
Fig.2 mRNA level of MMP-2 and TIMP-2 in rat hearts with ischemia/reperfusion
3 讨论
心肌I/R损伤一直是阻碍缺血心肌从介入性治疗和溶栓等再灌注疗法中获得最佳疗效的医学难题。理论研究和临床实践都证实,I/R不但损伤心肌本身,还损伤了心肌间质。我们的实验结果与此相一致,I/R组不仅有广泛用于反映心肌损伤程度的“金指标”-血浆CK、LDH活性的增高,而且有反映间质损伤的心肌胶原含量明显减少,与SC组比较差异有显著性(P<0.01),提示 I/R使心肌间质严重受损。MMPs是唯一能降解心肌间质胶原的一类锌离子和钙离子依赖的蛋白水解酶,在23种已知的人类MMPs中,MMP-2在几乎所有细胞中均有广泛表达,并且是心肌组织中表达最丰富的MMPs之一。国内外大量临床、基础研究结果表明MMP-2的激活、表达活性增强与心肌 I/R损伤有着密切的关系[7]。Jacob-Ferreira等[8]发现再灌注后的大鼠心脏MMP-2酶活性增强,其蛋白表达升高,并伴有心功能的恶化。Cheung等[9]在大鼠离体心脏模型上研究发现,再灌注早期冠脉流出液中MMP-2增加,并随着时间的延长而不断增加,且与再灌注后心肌机械运动能力的减弱成正比。在灌流液中加入纯化的MMP-2,可使I/R后心功能恶化,而用含MMP-2抗体的灌流液灌注,可对 I/R心肌起保护作用。李科等[10]通过对冠心病患者I/R治疗后血清MMP-2及-9水平变化的研究,认为血清MMP-2及-9表达水平增高可能是心肌I/R损伤的机制之一,有可能成为经皮冠状动脉介入术后评价心肌I/R损伤严重程度的较好预测因子。
我们的实验结果与上述文献报道以及之前实验研究结果一致[4],I/R组心肌 MMP-2活性和 MMP-2的表达均明显升高,同时,心肌胶原含量明显减少,反应心功能参数的LVSP、±dp/dt max明显低于SC组(P<0.01),表明MMP-2的释放和活性的增加与心肌间质的破坏和心功能损害有明显的相关性。因此抑制心肌中MMPs的表达和活性是治疗心肌再灌注损伤的一个有效靶点。活化的MMPs能被其抑制物TIMPs所抑制[11]。但是外源性 TIMPs受各种因素影响容易发生变性和降解,细胞因子可诱导TIMP合成,但副作用较大,使用受到限制。因此调动内源性保护机制使局部天然TIMP过表达来中和MMPs将是治疗I/R损伤的希望。在生理状态下,TIMPs与MMPs之间保持着一种动态平衡,使有活性的MMPs控制在一定范围内,协调ECM降解与重建,维持间质结构的完整和稳定。目前发现TIMP家族成员有 TIMP-1,TIMP-2,TIMP-3,TIMP-4四种,不同的TIMPs对MMPs家族中的不同成员作用有一定的特异性,如:TIMP-1几乎抑制所有的 MMP,尤其是MMP-9的活性;TIMP-2是一种相对分子量为21×103的非糖基化蛋白质,与明胶酶A前体有最大亲和力,主要抑制MMP-2的活性。TIMPs主要从两个方面抑制MMP的活性,在酶原阶段可以与MMP形成稳定的复合物从而妨碍MMP酶原的自我激活,在活化阶段以1∶1组成复合物,阻断其与底物的结合,从而抑制其功能,是组织局部MMPs活性最重要的调节因素,这表明维持正常的TIMPs浓度和MMPs/TIMPs比例对保护I/R心肌间质的损伤十分重要。
IPTC的概念是相对于缺血预处理而提出的,由于是在缺血后实施,与缺血预处理相比易于实施,可控性好,操作方便,而且心肌保护效果可与缺血预处理相媲美[2]。内源性保护机制IPTC理论的提出,无疑是再灌注治疗研究领域的一个重大突破,但目前的研究基本上集中在对心肌细胞的保护上。我们前期的研究显示,IPTC可通过抑制MMP-2的活性和表达对间质起到保护作用[4]。本实验在此基础上研究TIMPs是否参与IPTC对心肌间质的保护作用,结果表明,缺血/再灌注后,大鼠心肌在MMP-2蛋白表达明显上调的同时TIMP-2蛋白表达明显下调,与SC组相比有显著差异。TIMP-2蛋白表达水平及mRNA表达水平的下调增强了MMP-2的活性,增加其对胶原的降解,使心肌胶原含量减少(P<0.01),间质破坏,与Chulze等[12]研究发现的再灌注过程中MMPs/TIMPs比值的改变能促进心肌I/R的发生的结论一致。缺血毕立刻给予再灌注30 s、缺血30 s,连续3个循环,即进行内源性保护机制缺血后处理干预,大鼠心肌TIMP-2活性和TIMP-2的表达均明显上调,MMP-2蛋白表达及mRNA表达水平下调,心肌胶原含量增加,心功能明显的改善,提示TIMP-2参与了IPTC对心肌间质的保护作用。IPTC是通过何种机制上调 TIMP-2活性和 TIMP-2的表达,进而抑制MMP-2的过度表达,恢复MMPs/TIMPs比值,减轻心肌I/R心肌间质损伤的机制不明。结合文献我们推测:可能机制与IPTC可以通过抗氧化应激作用抑制再灌注过程中氧自由基和某些炎症细胞因子的释放有关。已证实心肌I/R过程中产生的大量氧自由基和细胞因子如白细胞介素-1、肿瘤坏死因子-α等可明显抑制 TIMP-2的表达,诱导大量 MMPs的表达[13]。
总之,本实验不但进一步证实了IPTC对心肌间质的保护作用是通过抑制MMP-2的活性和表达减少起作用的,并且证实ITPC可上调TIMP-2表达,有效拮抗MMP-2的作用,恢复MMPs/TIMPs比值,减轻对心肌间质胶原的降解,从而起到心肌保护的作用。
[1] 韩 珂,杨辰垣,肖诗亮,等.基质金属蛋白酶-2对鼠心肌缺血再灌注间质损伤的影响[J].实用医学杂志,2005,21(5):452-455.
[2] Galagudza M,Kurapeev D,Minasian S,et al.Ischemic postconditioning:brief ischemia during reperfusion converts persistent ventricular fibrillation into regular rhythm[J].Eur J Cardiothorac Surg,2004,25(6):1006-1010.
[3] Mewton N,Bochaton T,Ovize M.Postconditioning the heart of ST-elevation myocardial infarction patients[J].Circulation,2013,77(5):1123-1130.
[4] 卢彦珍,王 佳,宋 娟,等.缺血后处理对缺血/再灌注大鼠心肌基质金属蛋白酶-2表达的影响[J].中国应用生理学杂志,2014,30(1):81-84.
[5] Zhao ZQ,Corvera JS,Halkos ME,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparision with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2003,285(2):H579-588.
[6] Chiariello M,Ambrosio G,Cappelli-Bigazzi M,et al.A biochemical method for the quantitation of myocardial scarring after experimental coronary artery occlusion[J].J Mol Cell Cardiol,1986,18(3):283-290.
[7] Kandasamy AD,Chow AK,Ali MA,et al.Matrix metalloproteinase-2 and myocardial oxidative stress injury:beyond the matrix[J].Cardiovasc Res,2010,85(3):13-23.
[8] Jacob-Ferreira AL,Schulz R.Activation of intracellular matrix metalloproteinase-2 by reactive oxygen-nitrogen species:Consequences and therapeutic strategies in the heart[J].Arch Biochem Biophys,2013,540(1-2):82-93.
[9] Cheung PY,Sawicki G,Wozniak M,et al.Matrix metalloproteinase-2 contributes to ischemia-reperfusion injury in the heart[J].Circulation,2000,101(15):1833-1839.
[10]李 科,刘俊明,黄文军,等.冠心病患者缺血再灌注治疗后血清基质金属蛋白酶-2及-9水平变化及临床意义[J].中华实用诊断与治疗杂志,2012,26(8):736-738.
[11]Kitaoka H,Kubo T,Okawa M,et al.Plasma metalloproteinase levels and left ventricular remodeling in hypertrophic cardiomyopathy in patients with anidentical mutation[J].Cardiol,2011,58(3):261-265.
[12] Schulze CJ,Wang W,Suarez-Pinzon WL,et al.Imbalance between tissue inhibitor of metalloproteinase-4 and matrix metalloproteinases during acute myocardial[correction of myoctardial] ischemia-reperfusion injury[J]. Circulation,2003,107(19):2487-2492.
[13] Viappiani S,Nicolescu AC,Holt A,et al.Activation and modulation of 72kDa matrix metalloproteinase-2 by peroxynitrite and glutathione[J].Biochem Pharmacol,2009,77(5):826-834.

