蜂王浆主蛋白1低聚体的分离纯化及其圆二色谱分析
张 新,张红城,董 捷,张根生*
蜂王浆主蛋白1低聚体的分离纯化及其圆二色谱分析
张 新1,2,张红城2,董 捷2,张根生1,*
(1.哈尔滨商业大学食品学院,黑龙江 哈尔滨 150076;2.中国农业科学院蜜蜂研究所,农业部农产品加工中心蜂产品加工分中心,北京 100093)
蜂王浆主蛋白1(major royal jelly protein 1,MRJP1)是蜂王浆主蛋白家族中最重要的成员之一,MRJP1存在单体和低聚体两种形式。为了研究MRJP1低聚体的二级结构信息,首先利用ToyoScreen GigaCap Q-650M离子交换柱从新鲜蜂王浆中纯化出MRJP1低聚体,经分析超速离心和高效液相色谱-串联质谱技术鉴定其为MRJP1低聚体后,再通过圆二色谱技术检测MRJP1低聚体在不同浓度Ca2+条件下(10、50、200 mmol/L)二级结构的变化情况,并测定其变性温度。结果表明:该分离方法可以一步纯化出MRJP1低聚体,MRJP1低聚体的二级结构中β-折叠占比最高(55%左右),其次是无规卷曲(20%左右)和α-螺旋(15%左右),β-转角(10%左右)含量最低;MRJP1低聚体的变性温度为55 ℃。实验提出了MRJP1低聚体新的纯化方法及其二级结构的基本信息。
蜂王浆;MRJP1;纯化;圆二色谱
蜂王浆(royal jelly,RJ)是5~15 日龄工蜂舌腺和上颚腺所分泌的乳白色或淡黄色乳状液体,主要用于饲喂蜂王及3 日龄内的蜜蜂幼虫,是蜂王幼虫整个发育期和雄蜂幼虫前期的唯一食物[1-2]。蜂王浆具有多种生物功能,如抗氧化[3]、抗肿瘤[4-5]、抗菌[6]、降血压[7]、降血脂[8]以及对糖尿病有一定 的治疗作用[9]等。
新鲜蜂王浆中蛋白质含量丰富,占蜂王浆总量的12%~15%。蜂王浆中的蛋白质包括水溶性蛋白和水不溶性蛋白,其中水溶性蛋白占蜂王浆蛋白的46%~89%,为蜂王浆蛋白的主要组成,故称为蜂王浆主蛋白(major royal jelly proteins,MRJPs)家族[10-12]。MRJPs作为一个蛋白质家族,目前已被鉴定出10个家族成员,它们包括MRJP1~9、MRJPψ[13]。MRJPs被报道具有多种生物学功能和保健功效,如参与了蜜蜂的级型分化[14],在幼虫的发育过程中提供可利用的氮元素,以及在蜜蜂行为调控中起一定作用、促进细胞增殖、高效的抗菌活性、较强的免疫活性和抗氧化活性等[15-16]。MRJP1在蜂王浆蛋白中含量最为丰富,占蜂王浆水溶性蛋白的48%,等电点为4.0~6.3,在蜂王浆中呈现单体和低聚体两种形式。MRJP1在不同的生物系统内显示出不同的生物活性,如MRJP1能刺激人淋巴细胞在无血清的培养基里生长,也能促进小鼠肝细胞的增殖能力,并表现出一定的抗疲劳功效[17-18]。Kamakura等[19]通过研究首次指出蜂王浆中的MRJP1单体是蜜蜂级型分化的主要决定因子。由于MRJPs家族中各个成员之间的生理活性功能不尽相同,所以有必要针对MRJPs中的单一蛋白成分——尤其是MRJP1低聚体,进行分离纯化研究。
MRJPs家族各个蛋白成员之间的等电点和分子质量都较为接近,分离纯化比较困难。迄今为止,国内外对MRJP1的分离纯化方法,主要集中于离子交换和凝胶过滤层析。Schmitzová等[11]利用DEAE-52离子交换柱,经两次上柱,分离出MRJP1、2两种蛋白,由于其反复分离,导致蛋白损失过多,得率低;Simúth[1]用超速离心和凝胶过滤相结合的方法分离鉴定出MRJP1单体和低聚体;Tamura等[20]用Superose 12凝胶柱和Mini Q阴离子交换柱分离得到了MRJP1低聚体,然而因其使用两种柱子相结合的方式,所以同样出现蛋白损失问题;Cruz等[21]只采用Mono Q柱分离纯化出MRJP1和MRJP2,但是并没有鉴定出此MRJP1为单体还是低聚体。因此有必要研究出一种简单的MRJP1低聚体的分离纯化方法,从而可以得到足够的MRJP1低聚体进行结构研究。
圆二色谱(circular dichroism,CD)是研究蛋白质二级结构的常用方法,它是利用偏振光在通过光学活性物质后某些性质发生变化来了解分子本身的结构及其变化的技术。蛋白质的二级结构,如α-螺旋、β-折叠、β-转角和无规卷曲等在其各自特定的波长下都对应有不同的CD谱型,通过CD可以获得蛋白质二级结构的信息和了解构象的变化[22-23]。圆二色谱分为同步辐射真空紫外圆二色谱(synchrotron radiation circular dichroism,SRCD)和普通CD,它们最大的区别在于波长范围不同。SRCD比CD有进一步的优越性,SRCD的波长可向短波方向的近紫外区拓展到160 nm,其优点是伴随新的电子跃迁,对应有新的光谱结构,所包含的结构信息就越丰富,所确定的结构就越精确[24]。Biliková等[25]利用CD技术测定蜂王浆蛋白中Apisimin的二级结构与生物信息学预测结果一致;Cruz等[21]利用CD研究发现,2 mmol/L的Ca2+的存在使得MRJP1单体的二级结构具有极高的稳定性。
本实验拟利用阴离子交换层析筛选优化,得到一种简单的分离MRJP1低聚体的方法,并采用分析超速离心和质谱共同对其进行鉴定。此外,实验中还利用SRCD技术探究不同Ca2+浓 度对MRJP1低聚体二级结构变化的影响,及测定MRJP1低聚体的变性温度(Tm)。为下一步研究MRJP1低聚体的生理活性功能以及其在贮存条件下结构变化提供参考。
1 材料与方法
1.1 材料与试剂
蜂王浆样品采自中国农业科学院蜜蜂研究所育蜂基地,采收后置于-70 ℃保存备用。
氨基丁三醇(Tris) 美国Sigma公司;盐酸、氯化钠 北京化工厂;H2O2天津市华东试剂厂;聚丙烯酰胺、甲叉双丙烯酰胺、考马斯亮蓝R-250 北京索来宝(Solarbio)试剂公司;Marker 北京康为世纪生物科技有限公司。
1.2 仪器与设备
北京同步辐射真空紫外圆二色谱装置 中国科学院高能物理研究所;AKTA Purifier 100全自动层析仪 美国GE Healthcare公司;离子交换柱ToyoScreen GigaCap Q-650M(5 mL) 日本东曹 生物科技有限公司;Sorvall Biofuge Startos型离心机 德国Thermo Scientific公司;HPLC1100 美国Agil ent公司;LCQ Deca XP电喷雾质谱 美国T hermo Fisher公司;Mini-Protean II型电泳仪 美国Bio-Rad公司;Beckman/Coulter/XL-I型分析超速离心机 美国贝克曼库尔特有限公司;PL303型电子分析天平、SevenEasy型pH计 梅特勒-托利多仪器(上海)有限公司;Amicon Ultra超滤管(30 ku) 美国Millip ore公司。
1.3 方法
1.3.1 MRJP1的分离纯化
新鲜蜂王浆1.0 g溶于10 mL缓冲液(30 mmol/L Tris-HCl,pH 9.0),充分搅拌溶解混匀后,于4 ℃、15 000×g离心30 min。取上清液过0.22 μm微孔滤膜,滤液即为蜂王浆粗提液。使用阴离子交换层析对蜂王浆进行分离纯化,将ToyoScreen GigaCap Q-650M柱与AKTA purifier 100全自动层析仪连接,由Unicron 5.2操作系统调控。蜂王浆粗提液通过注射器经2.0 mL上样环手动上样,起始缓冲液A(30 mmol/L Tris-HCl,pH 9.0),洗脱缓冲液B(30 mmol/L Tris-HCl,1 mol/L NaCl,pH 9.0),使用起始缓冲液A对整个系统进行平衡后,再使用0~50%洗脱缓冲液B进行线性洗脱100 mL,流速为2.0 mL/min,检测波长为280 nm,洗脱样品由AKTA purifier以每管1.0 mL自动收集,4 ℃保存备用。收集的样品使用质量分数为10%的分离胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gelelectrophoresis,SDS-PAGE)鉴定,并检测蛋白的纯度和分子质量。
1.3.2 MRJP1低聚体的分析超速离心
分析超速离心主要是利用沉降速度来测定分子质量。采用Beckman/Coulter/XL-I分析超速离心机,温度为20 ℃,用照相方式记录样品粒子在高速离心下的运动状态,计算出粒子的沉降系数,将其代入Svedberg方程式,可求出分子或粒子的分子质量。MRJP1低聚体样品溶于缓冲溶液(30 mmol/L Tris-HCl,150 mmol/L NaCl,pH 9.0),上样浓度为1、2 μmol/L,转速为40 000×g。缓冲液的密度和黏度,蛋白质的微分比容通过SEDNTERP程序获得。沉降速率和沉降平衡的数据通过SEDFIT和EDPHAT程序分析。
1.3.3 MRJP1低聚体的质谱鉴定
将分离得到的纯化蛋白浓缩至2 mg/mL后取100 μL,加入100 μg胰蛋白酶,轻柔混合均匀后,在37 ℃条件下酶切过夜。取30 μL酶解产物直接上样进行质谱分析。使用Zorbax SB C18色谱柱,ESI电喷雾离子源喷雾电压4.5 kV,加热电压25 V,离子导入电压20 V,离子传输毛细管温度300 ℃,扫描范围m/z 50~2 000,碰撞能量为35%,质谱信号为多次累加扫描。采用标准蛋白混合物作外标标定多肽质谱峰峰位,最后通过Swiss-Prot数据库对得到的多肽片段与蜂王浆蛋白进行检索鉴定。
1.3.4 MRJP1低聚体的CD分析
将MRJP1低聚体溶液置于30 ku超滤管中,利用反复浓缩的方法将Tris-HCl缓冲液替换成磷酸盐缓冲液(10 mmol/L Na2HPO4/NaH2PO4,pH 8.0),用0.22 μm滤膜过滤后,根据仪器响应水平将蛋白质质量浓度调整为5 mg/mL。首先,分别添加不同浓度的Ca2+(10、50、200 mmol/L),并设置对照组(0 mmol/L)为不加Ca2+的天然MRJP1低聚体。研究Ca2+浓度对MRJP1二级结构的影响;由于α-螺旋在222 nm波长处有负特征吸收峰,因此本实验选择222 nm波长来检测MRJP1低聚体的Tm值。
贮存环的电子能量为1.5 GeV,束流强度为450 mA。波长扫描范围为175~260 nm,步长1.0 nm,CaF2样品池厚度0.001 mm,停留时间1 min,扫描次数5 次,测量温度为25 ℃。Tm值测定的初始检测温度为10 ℃,随后每2 ℃为一个梯度,温度依次上升至80 ℃,到达每个温度稳定5 min后检测222 nm波长处CD吸收值。利用CD Tool软件对CD谱进行数据处理,扣除对照样品的CD信号后对数据进行浓度、光程长归一化,分别计算α-螺旋、β-折叠、β-转角和无规卷曲的含量及Tm值。
2 结果与分析
2.1 MRJP1的分离纯化结果
蜂王浆粗取液里含有的MRJPs主要为MRJP1、MRJP2、MRJP3、MRJP5[11]。MRJP1、MRJP2的等电点为4.0~6.3、6.2~7.9;利用生物信息学查得MRJP3、MRJP5理论等电点分别为6.87、8.94。由于MRJPs等电点不同,并且大部分都是酸性蛋白,因此选择阴离子交换法来分离蜂王浆蛋白。
本实验室前期对离子交换层析过程使用的Tris-HCl缓冲液的pH 8.0、9.0、10.0和浓度10、20、30 mmol/L及不同的日本东曹公司柱材(ToyoScreen GigaCap Q-650M,ToyoScreen Q-600C AR,ToyoScreen DEAE-650M,ToyoScreen SuperQ-650M和ToyoScreen QAE-550)的选择进行了优化。筛选出最适合的缓冲液为pH 9.0的30 mmol/L Tris-HCl,最优的柱子为ToyoScreen GigaCap Q-650M柱。在此条件下,分离MRJPs的离子交换层析图谱如图1所示。

图1 阴离子交换层析分离纯化MRJP1的色谱图及其电泳检测图Fig.1 Anion-exchange chromatography and SDS-PAGE analysis of MRJP1
由图1可知,使用阴离子交换层析可以分离纯化出MRJP1。将收集到的每个峰的组分进行SDS-PAGE电泳鉴定,发现P4、P5的蛋白组分为纯化单一组分,与蜂王浆粗提液和Marker分子质量对比,初步判断P4、P5峰均含有MRJP1。由于MRJP1为弱酸性蛋白,因此与其他弱碱性蜂王浆蛋白相比,在pH 9.0碱性分离条件下,MRJP1带有负电荷最多,与阴离子交换柱结合最紧密,所以最后被洗脱下来,从而与其他蛋白分离开来。研究表明MRJP1是分子质量约为49~60 kD的弱酸性糖蛋白[11],可以形成290~420 kD的低聚体[1,25-26];由于低聚体在此缓冲液下带有的负电荷比单体多,因此推测P4组分可能为单体,P5组分可能为低聚体。P0~P3中并无MRJP1出现,说明MRJP1完全被分离开。
2.2 MRJP1低聚体质谱鉴定
为进一步确认分离纯化得到的蛋白是MRJP1,采用高效液相色谱-串联质谱的方法对此蛋白进行验证。MRJP1低聚体样品经胰蛋白酶消化,酶切位点为精氨酸和赖氨酸,形成的多肽片段进入质谱,一级质谱检测多肽分子的大小,然后再将肽段打碎,形成一系列离子,质谱再检测碎片离子的大小,即二级质谱。被打碎的40 个多肽片段中,25 个多肽片段通过SwissProt数据库检索与蜂王浆蛋白家族的成员序列进行匹配。其中,分子质量较大的6 个多肽片段为NNYPSDIDQWHDK,YNGVPSSLNVISK,LLTFDLTTSQLLK,TSDYQQNDIHYEGVQNILDTQSSAK,SGVLFFGLVGDSALGCWNEHR,和IMNANVNELILNTR。其匹配情况如图2所示,与MRJP1的匹配得分最高,且为唯一及格蛋白,序列覆盖率为53.47%,故经生物信息学比对结果进一步确认该蛋白为蜂王浆主蛋白成分MRJP1。

图2 MRJP1低聚体的质谱肽段碎片匹配情况Fig.2 Polypeptide matching of MRJP1 oligomer
2.3 MRJP1低聚体分子质量的测定结果
将ToyoScreen GigaCap Q-650M柱分离得到的P4和P5组分,浓缩并除盐后分别过Superdex 200凝胶过滤层析,发现P4组分含有双峰,含有MRJP1单体和低聚体;P5组分为单峰,其主成分为MRJP1低聚体。为了进一步验证P5组分为低聚体,对样品进行了分析超速离心来测定其分子质量。通过拍照得到的沉降系数等数据通过SEDFIT和EDPHAT程序分析,即可得到样品中粒子的分子质量。

图3 P5组分中MRJP1低聚体分析超速离心实验谱图Fig.3 Identification of MRJP1 oligomer from P5 fraction by sedimentation equilibrium
如图3所示,分析超速离心实验主峰对应的分子质量约为238 kD,由于MRJP1的分子质量约为49~60 kD[6],Tamura等[14]通过双向电泳将MRJP1低聚体分成55、5 kD两部分,因此推测此238 kD的MRJP1低聚体很可能为四聚体,即由4 个MRJP1单体和4 个5 kD单体组成了MRJP1低聚体。
2.4 MRJP1低聚体的CD分析
2.4.1 不同Ca2+浓度对MRJP1低聚体二级结构的影响
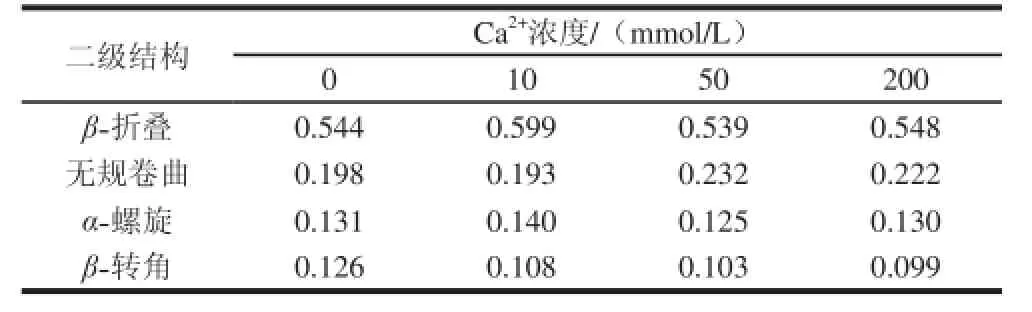
表1 MRJP1低聚体二级结构随Ca2+浓度变化情况Table 1 Changes in secondary structures of MRJP1 oligomer in the presence of Ca2+ at various concentrations
MRJP1低聚体通过SRCD分析,用CD Tool和CD SSTR算法处理其图谱。如表1所示,得到天然MRJP1低聚体的二级结构比例,其中,β-折叠所占比例最高(54.4%左右),其次是无规卷曲(19.8%左右)和α-螺旋(13.1%左右),β-转角(12.6%左右)含量最低。刘娟[27]研究新鲜蜂王浆蛋白中,β-折叠结构占26.7%,α-螺旋结构占22.8%,β-转角结构占23.7%,不规则结构占16.7%,其结构比例接近1∶1∶1∶1。MRJP1在蜂王浆蛋白中含量接近1/2,而本实验发现MRJP1低聚体中,β-折叠结构高达50%以上,故推测蜂王浆中β-折叠结构,主要来自MRJP1低聚体,其他蛋白含有的α-螺旋、β-转角所占比例会较高。
在3 种Ca2+浓度(10、50、200 mmol/L)条件下,MRJP1低聚体的二级结构比例与对照组相差不大,即Ca2+的浓度对其二级结构比例影响不大,随Ca2+浓度的升高,α-螺旋、β-折叠和β-转角所占比例稍有降低,无规卷曲所占比例略有增加。Cruz等[21]研究2 mmol/L Ca2+对MRJP1结构的影响不大,而本实验在高Ca2+浓度的情况下,MRJP1低聚体总体结构变化依然很小,说明Ca2+浓度对MRJP1低聚体二级结构确实影响不大。
2.4.2 MRJP1低聚体的Tm值
当蛋白质溶液被逐渐加热并超过临界温度时,溶液中的蛋白质将发生从天然状态向变性状态的剧烈转变,此转变温度被称作变性温度(Tm),此时蛋白质的天然状态和变性状态的浓度之比为1∶1。由图4可知,MRJP1低聚体的Tm值约为55 ℃,表明MRJP1低聚体在55 ℃前热稳定性很好,其二级结构基本上没有变化;55 ℃以后,二级结构逐渐变化,热稳定性变差。因此,蜂王浆在低温和常温贮藏过程中,MRJP1低聚体的结构一般不会发生变化。Simúth[1]发现MRIP1低聚体在37 ℃条件下贮藏12 h后仍无降解迹象;Kamakura等[18]发现MRJP1低聚体在40 ℃条件下保存30 d后只降解10%;Tamura等[20]指出,MRJP1低聚体高级结构在56 ℃环境下保持30 min也不会有大的改变。这些结果与本实验测得MRJP1低聚体的变性温度为55 ℃相符,低于变性温度情况下MRJP1低聚体结构稳定。

图4 MRJP1低聚体热变性图Fig.4 Thermal denaturation curve of MRJP1 oligomer
3 结 论
本实验根据蜂王浆蛋白的性质,使用ToyoScreen GigaCap Q-650M阴离子交换柱优化出一种新的分离MRJP1低聚体的方法,相对于其他需要至少两种柱层析方法更方便高效。在对蜂王浆进行前处理过程中,前人大多采用透析的方式,需要消耗2~3 d;而本实验对蜂王浆的前处理只需要30 min,纯化过程也在1 h内完成,既节省了步骤,也节约了时间,适合大规模纯化MRJP1低聚体,从而进行功能性质的研究。为了鉴定此MRJP1为低聚体,本实验首次采用分析超速离心来 精确测定其分子质量为238 kD,并推测其为MRJP1四聚体。随后,本实验利用SRCD技术研究MRJP1低聚体二级结构,β-螺旋所占比例最高,均占55%左右;其次是无规卷曲和α-螺旋,分别约占20%和15%;β-转角含量最低,占10%左右。并测定MRJP1低聚体的变性温度为55 ℃。
总之,本实验提出了MRJP1低聚体新的纯化方法及其二级结构的基本信息,为下一步研究MRJP1低聚体的生理活性功能以及其在贮藏存条件下结构变化打下了基础。
[1] SIMÐTH J. Some properties of the main protein of honeybee (Apis mellifera) royal jelly[J]. Apidologie, 2001, 32(1): 69-80.
[2] SRISUPARBH D, KLINBUNGA S, WONGSIRI S, et al. Isolation and characterization of major royal jelly cDNAs and proteins of the honey bee (Apis cerana)[J]. Journal of Biochemistry and Molecular Biology, 2003, 36(6): 572-579.
[3] NAGAI T, SAKAI M, INOUE R, et al. Antioxidative activities of some commercially honeys, royal jelly, and propolis[J]. Food Chemistry, 2001, 75(2): 237-240.
[4] 张敬, 戴秋萍. 蜂王浆冻干粉对小鼠肿瘤的抑制作用[J]. 同济大学学报: 医学版, 2001, 22(5): 13-14.
[5] 许雅香, 刘艳荷. 蜂王浆生理药理作用研究现状[J]. 生物学教学, 2000, 25(7): 8-10.
[6] 刘克武, 杨守忠, 葛绍荣, 等. 蜂王浆的抗菌活性研究[J]. 蜜蜂杂志, 2001(2): 5-6.
[7] 赵家明, 巨伟. 蜂王浆、蜂蜜与高血压[J]. 中国蜂业, 2006, 57(1): 25; 31.
[8] 耿纯. 蜂王浆的降血脂作用[J]. 中国养蜂, 2001, 52(1): 36.
[9] 郭芳彬. 蜂王浆对糖尿病的疗效和机理探讨[J]. 蜜蜂杂志, 1997(12): 6-7.
[10] ALBERT Š, KLA UDINY J, ŠIMÐTH J. Molecular characterization of MRJP3, highly polymorphic protein of honeybee (Apis mellifera) royal jelly[J]. Insect Biochemistry and Molecular Biology, 1999, 29(5): 427-434.
[11] SCHMITZOVÁ J, KLAUDINY J, ALBERT Š, et al. A family of major royal jelly proteins of the honeybee Apis mellifera L.[J]. Cellular and Molecular Life Sciences CMLS, 1998, 54(9): 1020-1030.
[12] QU Ning, JIANG Jie, SUN Liangxian, et al. Proteomic characterization of royal jelly proteins in Chinese (Apis cerana cerana) and European (Apis mellifera) honeybees[J]. Biochemistry (Moscow), 2008, 73(6): 676-680.
[13] XIA Aihua, ZHOU Qingxiang, YU Linlin, et al. Identification and analysis of YELLOW protein family genes in the silkworm, Bombyx mori[J]. BMC Genomics, 2006, 7(1): 195-204.
[14] TAMURA S, KONO T, HARADA C, et al. Estimation and characterisation of major royal jelly proteins obtained from the honeybee Apis merifera[J]. Food Chemistry, 2009, 114(4): 1491-1497.
[15] ALBERTOVÁ V, SU Songkun, BROCKMANN A, et al. Organization and potential function of the mrjp3 locus in four honeybee species[J]. Journal of Agricultural and Food Chemistry, 2005, 53(20): 8075-8081.
[16] ROBINSON G E, GROZINGER C M, WHITFIELD C W. Sociogenomics: social life in molecular terms[J]. Nature Reviews Genetics, 2005, 6(4): 257-270.
[17] KAMAKURA M, MITANI N, FUKUDA T, et al. Antifatigue effect of fresh royal jelly in mice[J]. Journal of Nutritional Science and Vitaminology, 2001, 47(6): 394-401.
[18] KAMAKURA M, SUENOBU N, FUKUSHIMA M. Fifty-sevenkDa protein in royal jelly enhances proliferation of primary cultured rat hepatocytes and increases albumin production in the absence of serum[J]. Biochemical and Biophysical Research Communications, 2001, 282(4): 865-874.
[19] KAMAKURA M. Royalactin induces queen differentiation in honeybees[J]. Nature, 2011, 473: 478-483.
[20] TAMURA S, AMANO S, KONO T, et al. Molecular characteristics and physiological functions of major royal jelly protein 1 oligomer[J]. Proteomics, 2009, 9(24): 5534-5543.
[21] CRUZ G C N, GARCIA L, SILVA A J, et al. Calcium effect and pH-dependence on self-association and structural stability of the Apis mellifera m ajor royal jelly protein 1[J]. Apidologie, 2011, 42(3): 252-269.
[22] KELLY S M, PRICE N C. The use of circular dichroism in the investigation of protein structure and function[J]. Current Protein and Peptide Science, 2000, 1(4): 349-384.
[23] WHITMORE L, WALLACE B A. Protein secondary structure analyses from circular dichroism spectroscopy: methods and reference databases[J]. Biopolymers, 2008, 89(5): 392-400.
[24] OAKLEY M T, HIRST J D. Charge-transfer transitions in protein circular dichroism calculations[J]. Journal of the America n Chemical Society, 2006, 128(38): 12414-12415.
[25] BILIKOVÁ K, HANES J, NORDHOFF E, et al. Apisimin, a new serine-valine-rich peptide from honeybee (Apis mellifera L.) royal jelly: purification and molecular characterization[J]. FEBS Letters, 2002, 528(1): 125-129.
[26] KIMURA M, KIMURA Y, TSUMURA K, et al. 350-kDa royal jelly glycoprotein (apisin), which stimulates proliferation of human monocytes, bears the β1-3galactosylated N-glycan: analysis of the N-glycosylation site[J]. Bioscience, Biotechnology, and Biochemistry, 2003, 67(9): 2055-2058.
[27] 刘娟. 蜂王浆蛋白的分离纯化及常温储存过程中的变化[D]. 北京:中国农业科学院, 2012.
Purification and Circular Dichroism Analysis of MRJP1 Oligomer from Royal Jelly
ZHANG Xin1,2, ZHANG Hong-cheng2, DONG Jie2, ZHANG Gen-sheng1,*
(1. College of Food Science, Harbin University of Commerce, Harbin 150076, China; 2. National R&D Centre for Bee Product Processing, Ministry of Agriculture, Bee Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100093, China)
MRJP1 is one of the most important members in the Major Royal Jelly Proteins (MRJPs) family with monomeric and oligomeric forms in royal jelly. In order to investigate the secondary structure of RJP1 oligomer, MRJP1 oligomer was extracted from fresh royal jelly and purified by ToyoScreen GigaCap Q-650M anion exchange column, then identified by sedimentation equilibrium and liquid chromatography coupled with tandem mass spectrometry (LC-MS/MS). Afterwards, we detected MRJP1 oligomer by synchrotron radiation circular dichroism (SRCD) to clarify the correlation between its secondary structure and different con centration of Ca2+(10, 50 and 200 mmol/L). In addition, its Tmvalue was also determined. The results showed that the proportion of β-strand (about 55%) was the highest, followed in decreasing order by random coil (20%) and α-helix (15%) and β-turns (10%). Ca2+had little effect on the secondary structure of MRJP1 oligomer. The Tmvalue of MRJP1 oligomer was 55 ℃. To conclude, a new method for the purification of MRJP1 oligomer and information on its secondary structure have been presented in this study.
royal Jelly; MRJP1; purification; circular dichroism (CD)
TS201.2
A
1002-6630(2014)17-0063-05
10.7506/spkx1002-6630-201417013
2013-11-10
国家现代农业(蜂)产业技术体系建设专项(CARS-45-KXJ18);中国农业科学院基本科研业务费专项(2012ZL074)
张新(1988—),女,硕士研究生,研究方向为传统食品工业化。E-mail:249193138@qq.com
*通信作者:张根生(1964—),男,教授,博士,研究方向为食品科学与工程。E-mail:zhanggsh@163.com

