小麦秸秆酶法制备低聚木糖及其抗氧化活性
田 龙,王 云,马晓建
(1.南阳师范学院生命科学与技术学院,河南 南阳 473061;2.郑州大学化工与能源学院,河南 郑州 450001)
小麦秸秆酶法制备低聚木糖及其抗氧化活性
田 龙1,2,王 云1,马晓建2
(1.南阳师范学院生命科学与技术学院,河南 南阳 473061;2.郑州大学化工与能源学院,河南 郑州 450001)
研究小麦秸秆酶法制备低聚木糖的最佳工艺及其抗氧化作用。确定低聚木糖的最佳制备条件为:酶解pH 6.0、木聚糖酶用量3 g/L、底物质量浓度70 g/L、酶解温度50 ℃、酶解时间4 h。在此条件下,酶解产生的还原糖含量为9.5 g/L,可溶性总糖含量为26.3 g/L,平均聚合度为2.77。考察低聚木糖的抗氧化活性,发现其对·OH、O2-·和DPPH自由基的清除能力呈量效关系。
小麦秸秆;低聚木糖;抗氧化活性
低聚木糖是一种具有独特生理活性的功能性低聚糖,由2~7 个木糖分子以β-1,4-糖苷键相连构成,其中木二糖、木三糖为主要有效成分。低聚木糖除了具有低热、稳定、安全、无毒等良好的理化特性外,还有促进肠内双歧杆菌等有益菌增殖,抑制有害菌生长的特性,因而亦被称作双歧因子[1-8]。
我国是一个农业大国,每年都产生数量巨大的农作物秸秆等纤维废弃物,现阶段对于这些宝贵的资源没有效利用,造成资源浪费和环境污染,基于此,本实验以小麦秸秆经丙酸法预处理得到的半纤维素降解液为原料,采用木聚糖酶法制备低聚木糖,考虑到近年来天然提取物的抗氧化活性研究成为研究热点,本实验还将对低聚木糖的抗氧化活性进行研究[9-24],以期为木质纤维素资源的综合利用提供参考依据。
1 材料与方法
1.1 材料与试剂
小麦秸秆丙酸降解液,实验室自制,其主要成分是半纤维素降解糖;利用旋转蒸发仪在低温条件下适当浓缩后,置于4 ℃冰箱中保存,备用。木聚糖酶(酶比活力为986 IU/g) 河南天冠企业集团有限公司;木聚糖美国Sigma公司。
1.2 低聚木糖的酶解法制备
在250 mL的三角瓶中加入适量的酶解底物和木聚糖酶,在一定的pH值和温度条件下反应一定时间。酶解结束后,将三角瓶置于沸水浴中10 min使木聚糖酶失活,冷却后离心,取上清液测定还原糖和可溶性总糖。
1.3 方法
1.3.1 测定方法
1.3.1.1 还原糖含量测定
采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法。
1.3.1.2 木聚糖酶活力测定
以质量浓度为1.2 g/L的木聚糖为底物,在pH 4.8、50 ℃水浴中酶解反应30 min,用DNS法测定反应所生成的还原糖。在上述条件下,每分钟催化产生1 μmol还原糖(以木糖计)所需要的木聚糖酶定义为1 个国际单位(IU)。以纯木糖作标准曲线。
1.3.1.3 可溶性总糖含量测定
取一定量的样品3 000 r/min离心15 min,取上清液加入浓H2SO4,使H2SO4的质量分数达6.5%,100 ℃条件下反应2 h,用20%的NaOH溶液中和反应液,过滤,滤液采用DNS法测定还原糖。
1.3.1.4 平均聚合度(degree of polymerization,DP)的计算

1.3.2 抗氧化活性的测定
1.3.2.1 清除羟自由基(·OH)实验[25]
采用Fenton试剂生成·OH,具体操作方法:量取7.5 mmol/L的邻二氮菲溶液1 mL,加入pH 7.4的磷酸盐缓冲液1.5 mL,混匀,加入7.5 mmol/L的FeSO4溶液1 mL,立即混匀,加入1 mL试样,再加入质量分数0.01%的H2O2溶液1 mL,最后以蒸馏水补充至10 mL,37 ℃水浴保温1 h,在510 nm波长处测定吸光度A1,蒸馏水代替试样的吸光度为A2,蒸馏水代替试样及H2O2溶液的吸光度为A0,按式(2)计算清除率P(%):

1.3.2.2 清除1,1-二苯基-二苦基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基实验[26]
准确称取10 mg DPPH自由基溶于100 mL无水乙醇得储备液,避光保存。用时稀释4 倍得6.5×10-5mol/L DPPH自由基溶液,另将待测样品配制成系列溶液,按表1加样,反应10 min后于517 nm波长处测定吸光度。重复测定3 次,结果取平均值。
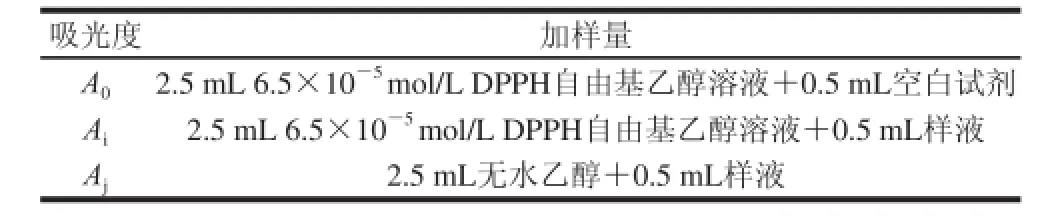
表1 DPPH实验加样量Table1 Experimental protocol for DPPH free radical scavenging assay
按式(3)计算清除率Y(%):

1.3.2.3 清除超氧阴离子自由基(O2-·)实验
取0.05 mol/L pH 8.2的Tris-HCl缓冲液4.5 mL于试管中,置于25 ℃水浴中预热20 min,加入提取液0.1 mL,2.5 mmol/L邻苯三酚0.4 mL,混匀后在25 ℃水浴中反应4 min,立即用2 滴8 mmol/L的HCl溶液终止反应,并在299 nm波长处测定吸光度A(用蒸馏水调零)。空白组以0.1 mL蒸馏水代替样品,重复3 次。按式(4)计算清除率I(%):

2 结果与分析

图1 木聚糖酶用量对水解效果的影响Fig.1 Effect of pentopan dosage on the hydrolysis efficiency of wheat straw
2.1 木聚糖酶用量对酶解的影响
酶解条件为:酶解温度50.0 ℃、底物质量浓度60 g/L、酶解pH 5.5、酶解时间4.0 h。从图1可知,水解液中的还原糖质量浓度和可溶性总糖质量浓度均随着酶用量的增加而增大,这是因为随着酶用量的增加,单位体积水解液中的酶分子数量相应提高,使得酶分子与反应底物结合的几率相应增大,所以可有效提高反应速度。当酶用量达到某一数值时,所有的底物与酶分子相结合,此时酶解效果达到最大。从图1可知,当酶用量增加到3.0 g/L时,可溶性总糖的增加趋于平缓。随着加木聚糖酶用量的增加,低聚木糖的聚合度在逐渐降低,当酶用量为3.0 g/L时,产物的聚合度基本保持不变。因此确定木聚糖酶用量应以3.0 g/L为宜。
2.2 底物质量浓度对酶解的影响

图2 底物质量浓度对水解效果的影响Fig.2 Effect of substrate concentration on the hydrolysis efficiency of wheat straw
酶解条件为:木聚糖酶用量4.0 g/L、酶解温度50.0 ℃、酶解pH 5.5、酶解时间4.0 h。由图2可知,酶促反应中,底物质量浓度对酶解反应的进行具有重要影响:当底物质量浓度较低时,提高底物的质量浓度可以提高反应速度,这是因为低底物质量浓度时,木聚糖酶可以和底物充分接触,因此反应产物中的可溶性总糖和还原糖含量均在显著增加。但在高底物质量浓度情况下,底物质量浓度的提高会导致产品得率的下降,这是因为底物黏稠会影响酶、底物和产物的扩散以及酶与底物的接触,同时也可能产生底物对酶促反应的抑制,使酶解效率下降。综合考虑还原糖和总糖的得率及产物的平均聚合度,选择底物质量浓度在60 g/L的时候水解效果较好。由图2可知,底物质量浓度对酶解产物的平均聚合度也有一定影响。底物质量浓度过低,则酶解产物的聚合度较大,说明酶解效率较低;但当底物质量浓度过大时,反应底物中只有部分被转化为低聚木糖,产率较低,这对反应底物来说是一种浪费。
2.3 酶解温度对酶解的影响

图3 酶解温度对水解效果的影响Fig.3 Effect of hydrolysis temperature on the hydrolysis efficiency of wheat straw
酶解条件为:木聚糖酶用量4.0 g/L、底物质量浓度60 g/L、酶解pH 5.5、酶解时间4.0 h。温度是影响酶促反应的重要因素:温度过低时,酶反应速率很慢,适当升高温度可以加快酶-底物络合物转变为产物的速度,但酶的本质是一种具有特殊催化活性的蛋白质,温度过高会使酶分子变性,导致酶的活性降低甚至失活,从而影响酶的作用效果。从图3可以看出,从40~50 ℃,随着酶解温度的升高,酶解产物的可溶性总糖的质量浓度和还原糖质量浓度呈增加趋势,这是因为温度升高加速了反应体系中酶分子与木聚糖底物的碰撞机会,有利于酶促反应的进行。但当酶解温度超过50 ℃时,酶解产物的可溶性总糖和还原糖质量浓度下降,这是因为酶蛋白的构象和参与酶促反应的功能团离解状态等发生了变化,酶的活力下降,所以选择酶解温度为50 ℃。
2.4 酶解pH值对酶解的影响
酶解条件为:木聚糖酶用量4.0 g/L、酶解温度50.0 ℃、底物质量浓度60 g/L、酶解时间4.0 h。反应体系的pH值影响木聚糖酶的构象,进而影响酶的活性部位与底物的接近和结合。酶在不同的pH值条件下以不同的解离状态存在,通常只有一种解离状态最适合酶促反应进行。从图4可看出,在反应体系的pH 5.5时,可溶性总糖及还原糖的质量浓度最高,分别为9.7 g/L和25.2 g/L,而此时酶解产物的聚合度为2.6;当pH值大于5.5或小于4.5时,可溶性总糖及还原糖的质量浓度均下降,说明pH值在5.5时,木聚糖酶稳定性和活力均较好,此时能够发挥良好的作用。从图4可知,酶解产物的平均聚合度随着pH值的升高呈下降趋势,而当pH值大于5时,平均聚合度基本保持恒定,综合考虑,可以确定最佳pH值为5.5。

图4 pH值对水解效果的影晌Fig.4 Effect of pH on the hydrolysis efficiency of wheat straw
2.5 酶解时间对酶解的影响

图5 酶解时间对水解液糖质量浓度的影晌Fig.5 Effect of hydrolysis time on the hydrolysis efficiency of wheat straw
酶解条件为:木聚糖酶用量4.0 g/L、酶解温度50.0 ℃、底物质量浓度60 g/L、酶解pH 5.0。从图5可以看出,在1.0~4.0 h的反应时间内,随着反应时间的延长,酶解液中的还原糖质量浓度从6.3 g/L升高到9.7 g/L,而可溶性总糖质量浓度由20.8 g/L升高到25.2 g/L。但当反应时间继续延长,可溶性总糖质量浓度和还原糖质量浓度增加缓慢。
对酶解产物的平均聚合度来说,其变化趋势呈现类似的规律,在1.0~4.0 h的反应时间内,平均聚合度从起始的3.3降至2.6,这说明所采用的木聚糖酶具有很高的内切型木聚糖酶活力,可快速切断主链β-l,4木糖苷键,生成短链低聚物。而酶解4.0 h后,产物的平均聚合度变化趋缓,这是由于产物低聚木糖对酶的反馈抑制作用增强所致,同时也显示出所用的木聚糖酶制剂中缺乏木二糖酶,而这一特性对于低聚木糖的制备是有利的。由此可知,适宜的酶解时间为4.0 h。
2.6 正交试验

表2 正交试验设计及结果Table2 Orthogonal array design and results
从表2的极差分析可知,对于还原糖含量这个指标来说,5 个因素的影响程度依次是:酶解pH值>木聚糖酶用量>底物质量浓度>酶解温度>酶解时间。最佳组合为:酶解pH 6.0、木聚糖酶用量3 g/L、底物质量浓度70 g/L、酶解温度50 ℃、酶解时间4 h。
对于可溶性总糖含量这个指标来说,5 个因素的影响程度依次是:底物质量浓度>木聚糖酶用量>酶解pH值>酶解温度>酶解时间。最佳组合为底物质量浓度70 g/L、木聚糖酶用量4 g/L、酶解pH 6.0、酶解温度50 ℃、酶解时间5 h。
对于平均聚合度这个指标来说,5 个因素的影响程度依次是:酶解pH值>酶解温度>酶解时间>底物质量浓度>木聚糖酶用量。最佳组合为酶解pH 4.5、酶解温度40 ℃、酶解时间2 h、底物质量浓度50 g/L、木聚糖酶用量4 g/L。
综合考虑,小麦秸秆酶法制备低聚木糖的最佳工艺条件为:酶解pH 6.0、木聚糖酶用量3 g/L、底物质量浓度70 g/L、酶解温度50 ℃、酶解时间4 h。此组合条件在表2中并未出现,因此需要做验证性实验。而验证性实验表明,在此最佳工艺条件下,酶解产生的还原糖含量为9.5 g/L,可溶性总糖含量为26.3 g/L,平均聚合度为2.77。
2.7 低聚木糖对·OH的清除作用

图6 低聚木糖对·OH的清除作用Fig.6 Scavenging capacity of xylooligosaccharides on hydroxyl free radicals
从图6可以看出,低聚木糖对·OH具有一定的清除作用,随着低聚木糖质量浓度的增加,其对·OH的清除率也随之增加,量效关系明显。当低聚木糖的质量浓度达到1.4 g/L时,对·OH的清除率达到97.2%。而以L-抗坏血酸作对照,在相同质量浓度下低聚木糖对·OH的清除率低于L-抗坏血酸,原因可能是因为本实验得到的低聚木糖是粗提物,纯度较低,影响了其抗氧化活性。
2.8 低聚木糖对DPPH自由基的清除作用
DPPH自由基是一种很稳定的氮中心的自由基,它的稳定性主要来自3 个苯环的共振稳定作用及空间障碍,使夹在中间的氮原子上不成对的电子不能发挥其应有的电子成对作用。作为一种稳定的自由基,DPPH可以清除其他的自由基。DPPH法于1958年提出,现在已广泛用于定量测定生物试样和食品的抗氧化能力。其原理是:DPPH自由基有单电子,在517 nm波长处有一强吸收,其醇溶液呈紫色,然而当有自由基清除剂存在时,由于与其单电子配对而使其吸收逐渐消失,其褪色程度与其接受的电子数量呈定量关系,因而可用分光光度计进行快速的定量分析[27-29]。由图7可知,L-抗坏血酸对DPPH自由基的清除率基本不变,但低聚木糖对DPPH自由基的抑制率与其质量浓度呈明显的量效关系,进一步增加低聚木糖的质量浓度,清除率趋于平缓。与同质量浓度L-抗坏血酸的清除率相当,当质量浓度大于100 mg/L时,低聚木糖对DPPH自由基的清除率大于同质量浓度的L-抗坏血酸。由此可知,低聚木糖对DPPH自由基有显著的清除作用,低聚木糖的抗氧化活性是由于其具有供给质子的能力。
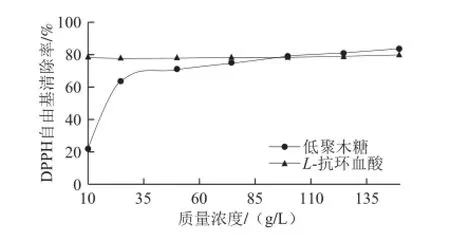
图7 低聚木糖对DPPH自由基的清除作用Fig.7 Scavenging capacity of xylooligosaccharides on DPPH free radicals
2.9 低聚木糖对O2-·的清除作用
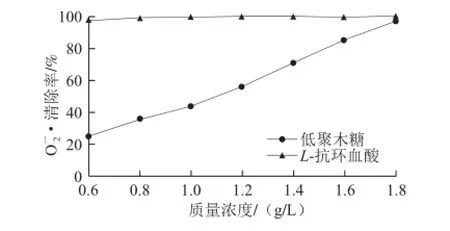
图8 低聚木糖对·的清除作用Fig.8 Scavenging capacity of xylooligosaccharides on superoxide anion free radicals
3 结 论
通过单因素试验和正交试验确定木聚糖酶催化水解木聚糖最佳条件为:酶解pH 6.0、木聚糖酶用量3 g/L、底物质量浓度70 g/L、酶解温度50 ℃、酶解时间4 h。在此条件下,酶解产生的还原糖含量为9.5 g/L,可溶性总糖含量为26.3 g/L,平均聚合度为2.77。抗氧化活性实验表明,低聚木糖能有效地清除·OH、O2-·和DPPH自由基,且呈显著的量效关系。
[1] 许正宏, 熊筱晶, 陶文沂. 低聚木糖的生产及应用研究进展[J]. 食品与发酵工业, 2002, 28(1): 56-59.
[2] 杨瑞金, 许时婴, 王璋. 低聚木糖的功能性质与酶法生产[J]. 中国食品添加剂, 2002(2): 89-93.
[3] 王平, 陈磊. 不同加工条件对小麦麸皮半纤维素得率的影响[J]. 食品与发酵工业, 2006, 32(8): 86-87.
[4] 徐东, 韩玉洁, 徐忠. 低聚木糖的综合开发利用[J]. 食品研究与开发, 2005, 26(4): 32-33.
[5] 王海, 李里特, 石波. 用玉米芯酶法制备低聚木糖[J]. 食品科学, 2002, 23(5): 81-83.
[6] 江华, 余世袁. 低聚木糖溶液冷冻浓缩时溶质的分配行为研究[J].食品科学, 2007, 28(11): 146-149.
[7] 赵国志, 王锡忠, 温继发, 等. 低聚木糖的制取及应用[J]. 粮油食品科技, 1998(5): 18-20.
[8] 郑建仙. 功能性食品甜味剂[M]. 北京: 中国轻工业出版社, 1997.
[9] 侯留鑫, 王华清, 郑铁松, 等. 一种新型茶叶籽黄酮单体的分离鉴定及其抗氧化活性[J]. 食品科学, 2013, 34(21): 115-120.
[10] 侯金鑫, 江一帆, 赵晓静, 等. 杏鲍菇发酵产物冻干粉功能成分分析及抗氧化活性[J]. 食品科学, 2013, 34(21): 329-332.
[11] 王玉婷, 陈奕, 李雨波. 干燥方式对香蕉片总多酚含量及其抗氧化性的影响[J]. 食品科学, 2013, 34(23): 113-117.
[12] 邹宇, 尹冬梅, 冮洁, 等. 黑木耳黑色素组分分析及其抗氧化活性研究[J]. 食品科学, 2013, 34(23): 138-141.
[13] 李菁, 刘骞, 孔保华, 等. L-赖氨酸与三种还原糖美拉德反应产物的理化特性及抗氧化活性的研究[J]. 食品科学, 2013, 34(23): 80-85.
[14] 彭惠惠, 李吕木, 钱坤, 等. 发酵芝麻粕中芝麻小肽的分离纯化及其体外抗氧化活性[J]. 食品科学, 2013, 34(9): 66-69.
[15] 黄尚荣, 杨雪娜, 张露, 等. 龙眼皮原花青素提取工艺优化及其抗氧化活性测定[J]. 食品科学, 2014, 35(10): 68-75.
[16] 李加兴, 陈选, 邓佳琴, 等. 黄秋葵黄酮的提取工艺和体外抗氧化活性研究[J]. 食品科学, 2014, 35(10): 121-125.
[17] 刘程惠, 刘易伟, 胡文忠, 等. 柠檬酸处理鲜切猕猴桃在贮藏过程中抗氧化活性的变化[J]. 食品科学, 2014, 35(2): 292-296.
[18] 李楠, 师俊玲, 王昆. 14 种海棠果实多酚种类及体外抗氧化活性分析[J]. 食品科学, 2014, 35(5): 53-58.
[19] 叶琼仙, 苗爱清, 程悦, 等. 白叶单枞黑茶多酚聚合物的分离分析及其生物活性研究[J]. 食品科学, 2014, 35(5): 69-74.
[20] 许瑞波, 万蓓蓓, 高颖颖, 等. 北五味子叶总黄酮的提取及生物活性[J].食品科学, 2013, 34(20): 72-76.
[21] 阎林茂, 郭宇龙, 张延龙, 等. 百合花瓣酚类物质及其抗氧化活性的分析[J]. 食品科学, 2013, 34(7): 51-55.
[22] 李佳银, 于欢, 石伯阳, 等. 甘薯茎叶中异槲皮苷及咖啡酰基奎宁酸类衍生物的抗氧化活性[J]. 食品科学, 2013, 34(7): 111-114.
[23] 汪开拓, 郑永华, 唐文才, 等. 茉莉酸甲酯处理对采后葡萄果实酚酸合成和抗氧化活性的影响及其机理研究[J]. 食品科学, 2013, 34(6): 260-265.
[24] 蔡文国, 吴卫, 代沙, 等. 不同种质鱼腥草总酚、黄酮含量及其抗氧化活性[J]. 食品科学, 2013, 34(7): 42-46.
[25] 金鸣, 蔡亚欣, 李金荣, 等. 邻二氮菲Fe2+氧化法检测H2O2/Fe2+产生的自由基[J]. 生物化学与生物物理进展, 1996, 23(6): 553-555.
[26] 彭长连, 陈少薇, 林植芳, 等. 用清除有机自由基DPPH法评价植物抗氧化能力[J]. 生物化学与生物物理学进展, 2000, 27(6): 658-661.
[27] 李志成, 蒋爱民, 熊清权, 等. 山羊乳酪蛋白酶解物制备及体外抗氧化活性研究[J]. 食品科学, 2011, 32(23): 82-86.
[28] 韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J]. 食品科学, 2014, 35(9): 317-322.
[29] 赵金梅, 高贵田, 薛敏, 等. 不同品种猕猴桃果实的品质及抗氧化活性[J]. 食品科学, 2014, 35(9): 118-122.
[30] 周江菊, 任永权, 雷启义. 樗叶花椒叶精油化学成分分析及其抗氧化活性测定[J]. 食品科学, 2014, 35(9): 137-141.
[31] 殷丽琴, 韦献雅, 钟成. 不同品种彩色马铃薯总花色苷含量与总抗氧化活性[J]. 食品科学, 2014, 35(9): 96-100.
Preparation and Antioxidant Activity of Xylooligosaccharides from Wheat Straw by Enzymatic Hydrolysis with Xylanase
TIAN Long1,2, WANG Yun1, MA Xiao-jian2
(1. School of Life Science and Technology, Nanyang Normal University, Nanyang 473061, China; 2. College of Chemical Engineering and Energy, Zhengzhou University, Zhengzhou 450001, China)
The enzymatic hydrolysis of wheat straw for preparing xylooligosaccharides using xylanase was optimized using an orthogonal array design, and the xylooligosaccharides obtained were assessed for antioxidant activity. A hydrolysis temperature and 4 h hydrolysis at an enzyme concentration of 3 g/L and a substrate concentration of 70 g/L with an initial pH of 6.0 proved optimal for the preparation of xylooligosaccharides. The optimized conditions yielded 9.5 g/L of reducing sugar and 26.3 g/L of soluble sugar in the product with an average degree of polymerization of 2.77. The xylooligosaccharides showed dose-dependent radical scavenging activity against 1,1-diphenyl-2-picrylhydrazyl (DPPH), hydroxyl and superoxide anion radicals.
wheat straw; xylooligosaccharides; antioxidant activity
TS249.2
A
1002-6630(2014)20-0088-05
10.7506/spkx1002-6630-201420018
2011-09-03
田龙(1977—),男,讲师,博士,研究方向为生物化工。E-mail:858687144@163.com

