响应面试验优化绿豆凝集素提取工艺
黄泽华,王倩雯,张 贺,李育楠,李庆波,曹龙奎,2,*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.黑龙江省农产品加工工程技术研究中心,黑龙江 大庆 163319)
响应面试验优化绿豆凝集素提取工艺
黄泽华1,王倩雯1,张 贺1,李育楠1,李庆波1,曹龙奎1,2,*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.黑龙江省农产品加工工程技术研究中心,黑龙江 大庆 163319)
凝血法检测绿豆凝集素活性,并改进凝集活性检测兔血红细胞处理条件,在单因素试验的基础上设 计响应面Box-Behnken试验,优化绿豆凝集素提取工艺条件。结果表明,凝集活性检测兔血红细胞的处理最佳条件为戊二醛体积分数0.15%、25 ℃处理血细胞20 min;胰蛋白酶添加量25 U/mL、25 ℃处理1 5 min,优化条件下提高了兔血红细胞凝集灵敏度且延长了兔血红细胞保存时间。磷酸盐缓冲溶液为绿豆凝集素最佳浸提溶液,绿豆凝集素优化工艺条件为料液比1∶9.09(g/mL)、NaCl浓度0.3 mol/ L、浸提时间4.16 h,在此条件下最大绿豆凝集素比活力预测和验证值分别为134.91 U/mg和139.02 U/mg。
绿豆凝集素;响应面法;优化;提取
绿豆凝集素具有细胞凝集作用[1],新鲜兔血红细胞凝血法检测的可重复性差,对红 细胞进行戊二醛固定、胰蛋白酶处理,可以提高红细胞的感受性和稳定性,从而增加检测的灵敏度和可重复性[2]。绿豆凝集素是由4 个亚基构成四聚体的糖蛋白,分子质量约为160 kD,是绿豆中主要的抗营养因子之一,由Charles等[3]分离得到。饱和硫酸铵沉淀[4]、羧甲基纤维素离子交换层析[5]和凝胶过滤[6]是绿豆凝集素的纯品制备的主要方法,但是这种方法采用了两次层析步骤,分离效率低,造成大量凝集素活性损失,成本高并且耗时。纯化手段的不足限制了凝集素在生物学[7]、医学[8]和动物营养学[9]等领域的应用,因此需要寻找新的简便且可整合的分离纯化凝集素的方法。本研究采用响应面法优化了绿豆凝集素的提取工艺,并用硫酸铵双重盐析的方法取代一步层析操作,减小了凝集素活性的损失,起到了很好的纯化效果并降低了成本。
1 材料与方法
1.1 材料与试剂
绿豆 大连白桦粮谷加工有限公司;兔血为健康成年大白兔耳缘静脉血;磷酸二氢钠、磷酸氢二钠 辽宁泉瑞试剂有限公司;戊二醛50%溶液 上海生化试剂公司;胰蛋白酶 上海原叶生物科技有限公司;硫酸铵天津市大茂化学试剂厂。
1.2 仪器与设备
T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;TD5A型离心机 长沙英太仪器有限公司;AR2100型电子天平 奥斯豪国际贸易有限公司;HD-9707电脑紫外检测仪 上海精科实业有限公司。
1.3 方法
1.3.1 绿豆凝集素的凝集素活力检测
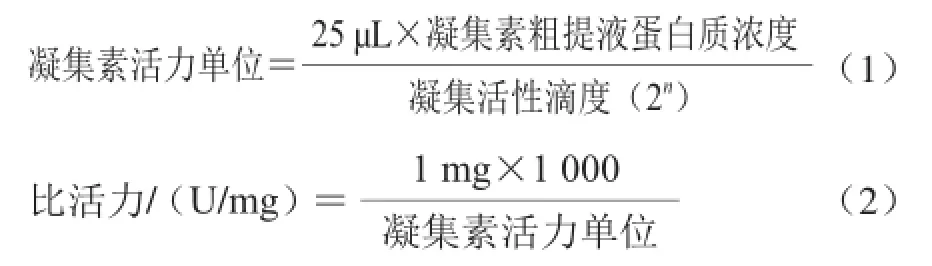
凝血法测定绿豆凝集素活性[10]。兔血红细胞的处理参考Turner[11]、彭建宗[12]等的报道,并改进25 ℃时戊二醛及胰蛋白酶对兔血红细胞处理的浓度和时间,以适用于绿豆凝集素的检测。在96 孔凝血板上系列倍比稀释(从前一孔吸取25 μL液体,放入下一孔内,充分混合后取25 μL液体放入下一孔内,如此操作至倒数第2个孔),每一排第一孔稀释两倍(21),留下每一排的最后一空,作为对照。凝集活性滴度,指在96孔凝血板上使兔血红细胞凝集的最小稀释倍数,2n。凝集素活力单位和比活力计算见公式(1)、(2)。
1.3.2 蛋白质含量测定
采用Lowry法,以牛血清蛋白作为标准[13]。
1.3.3 最佳浸提缓冲溶液的确定
采用0.2 mol/L、pH 7.2 磷酸盐缓冲液浸提,0.9%生理盐水浸提,0.1 mol/L、pH 6.0柠檬酸缓冲溶液,0.1 mol/L、pH 9.51碳酸缓冲溶液浸提以及蒸馏水在相同条件下浸提,分别测定提取液凝集活性,确定最佳提取缓冲溶液[14]。
1.3.4 绿豆凝集素浸提条件单因素试验
依据参考文献[15-16],对凝集素提取过程影响较大的因素有料液比(g/mL)、NaCl浓度、浸提时间等[17],通过实验探讨其对绿豆凝集素凝集凝集活性的影响,设计三因素三水平响应面试验;并通过单因素试验确定绿豆粉碎粒度、浸提温度最佳参数。准确称取5 g 绿豆粉(60~80 目),以料液比1∶10,采用最佳浸提缓冲溶液,在20 ℃条件下100 r/min摇床振荡浸提4 h,测定浸提液凝集活性。固定其他条件,分别对绿豆粉碎粒度(40~120目及120 目以上)、浸提温度(5~50 ℃)、料液比(1∶4~1∶12)、NaCl浓度(0~0.6 mol/L)及浸提时间(2~10 h)进行考察。
1.3.5 绿豆凝集素浸提响应面优化
在单因素试验的基础上采用三因素三水平的响应面分析方法[18-19],分别以A、B、C代表料液比、NaCl浓度、浸提时间3个因素,试验设计见表1。采用Design-Expert设计Box-Behnken试验。17 个试验点可分为两类:一类为析因点,自变量取值在A、B、C所构成的三维顶点,共有12 个析因点;另一类为零点,为区域的中心点,零点试验重复5 次,用以估计试验误差。

表1 响应面试验因素与水平Table1 Coded levels for independent variables used in response surface analysis (RSA)
1.3.6 绿豆凝集素的盐析提取
对绿豆凝集素浸提液进行两次30%~70%的梯度硫酸铵盐析[20]。第1次盐析分别收集30%~40%、40%~50%、50%~60%和60%~70%硫酸铵饱和度盐析沉淀,测定凝集活性,将凝集活性最高的硫酸铵盐析沉淀混合后,同样方法进行第2次硫酸铵盐析。收集凝集活性最高的盐析沉淀物用于层析纯化。
1.3.7 葡聚糖凝胶层析对绿豆凝集素浸提液进行纯化
将双重硫酸铵盐析后的蛋白质沉淀配成10 mg/mL溶液1 mL,上已经平衡好的Sephadex G-75层析柱,以流速0.7 mL/min生理盐水进行洗脱,用核酸蛋白检测仪进行检测,自动收集器进行接样,4 min/管[21]。
2 结果与分析
2.1 兔血红细胞处理方法优化

图1 戊二醛处理兔血红细胞对其4 ℃保存稳定性的影响Fig.1 Effect of glutaraldehyde treatment on the stability rabbit red blood cells stored at 4 ℃
从图1可知,未经戊二醛固定处理的新鲜兔血红细胞及以体积分数为0.05%~0.10%的戊二醛处理的兔血红细胞在4 ℃保存时,10 d内均发生溶血,凝集活性失去或降低,说明溶液中的戊二醛的醛基不能与全部兔血红细胞表面的氨基发生交联反应使红细胞得以固定,戊二醛添加量不 足。以0.15%戊二醛处理的在第10天依然没有凝集活性降低,事实上在第30天依然具有良好的凝集活性,说明0.15%戊二醛能够使全部的红细胞得以固定,延长了其保存时间;但当戊二醛达到0.20%时,处理20 min会使兔血红细胞泥的颜色变黑,并且红细胞间黏着性增强,不易分 散成细胞悬浮液。这可能是因为戊二醛的两个醛基与兔血红细胞蛋白质间是以双键的形式结合,而使细胞组织得以固定的,当大量的戊二醛渗透到细胞组织内部时,破坏了蛋白质的空间结构[4,22]。因此,本实验采用0.15%戊二醛25 ℃处理新鲜兔血红细胞20 min。
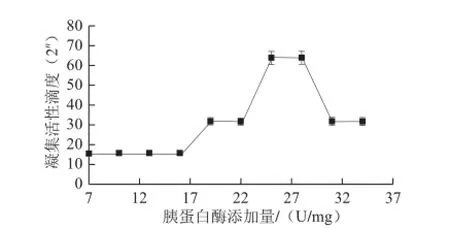
图2 胰蛋白酶添加量对兔血红细胞凝集活性滴度的影响Fig.2 Effect of trypsin treatment on the agglutinating activity of rabbit red blood cells
从图2可知,不同量胰蛋白酶处理兔血红细胞,其凝集活性滴度呈先增加后降低趋势。说明当胰蛋白酶处理时间一定,胰蛋白酶只有达到一定浓度(16 U/mL),才能提高兔血红细胞的凝集活性滴度;并且具有最佳胰蛋白酶添加量范围,超过这个范围(25~28 U/mL),反而使兔血红细胞的凝集活性滴度下降。分析认为,由于凝集素具有糖结合专一性,胰蛋白酶处理兔血红细胞,使细胞表面被包埋在膜的脂质双分子层中的糖蛋白的糖基暴露出来,从而与凝集素特异性结合,而提高了其凝集活性;当胰蛋白酶浓度过大时,红细胞表面的糖蛋白被过度水解,糖基被剥离红细胞表面,而使凝集活性降低。综合分析,采用25 U/mL胰蛋白酶处理戊二醛固定后的兔血红细胞15 min。
2.2 最佳浸提缓冲溶液的确定

图3 不同浸提液提取绿豆凝集素的凝集反应现象Fig.3 Coagulation phenomenon of mung bean lectin extracted with different solvents
从图3可以看出,在相同的浸提条件下,PBS浸提的绿豆凝集素粗提液的凝集活性滴度最大,达到24,能够最大限度的提取绿豆凝集素。因此本实验采用PBS作为浸提绿豆凝集素的缓冲溶液。
2.3 不同条件对绿豆凝集素浸提的影响
2.3.1 粉碎粒度对绿豆凝集素浸提 的影响

图4 粉碎粒度对绿豆凝集素比活力的影响Fig.4 Effect of mung bean granularity on the activity of mung bean lectin
如图4所示,当粉碎粒度从20~40 目增加到80~100 目时,绿豆凝集素凝集活性不断增强,从25.0 U/mg增加到109.8 U/mg;粉碎粒度在80~100 目左右时,提取液凝集活性达到最大,因此浸提绿豆凝集素时,将绿豆粉碎至80~100 目。
2.3.2 浸提温度对绿豆凝集素浸提的影响
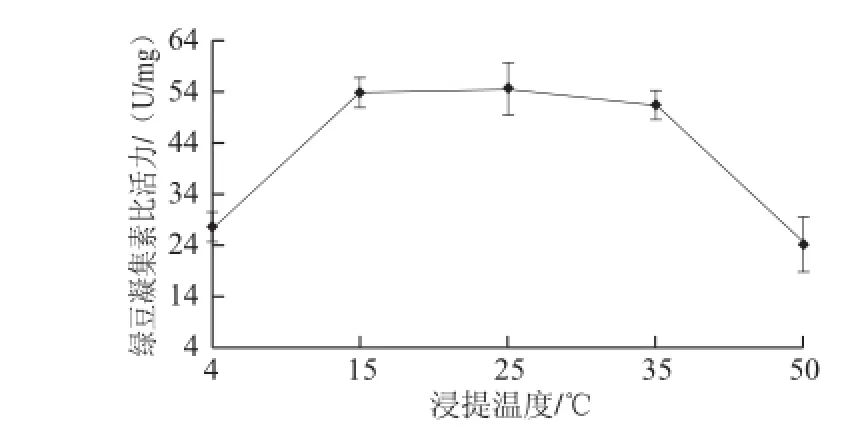
图5 浸提温度对绿豆凝集素比活力的影响Fig.5 Effects of extraction temperature on the activity of mung bean lectin
从图5可知,随着温度的升高,浸提液中绿豆凝集素活性呈现先增加后降低的趋势。从实验的方便性出发,选择25 ℃提取绿豆凝集素。
2.3.3 浸提时间对绿豆凝集素浸提的影响

图6 浸提时间对绿豆凝集素比活力的影响Fig.6 Effect of extraction time on the activity of mung bean lectin
由图6可见,随着浸提时间的延长,凝集素比活力不断增加,浸提6 h达到最高值,然后开始下降。
2.3.4 料液比对绿豆凝集素浸提的影响
由图7可以发现,不同的料液比对浸提液凝集素比活力有显著影响,当料液比1∶4时,由于浸提液浓度较高使浸提溶液具有较大凝集活性;当料液比不断降低,浸提溶液凝集活性先升高后降低,在料液比1∶10左右时达到最大。
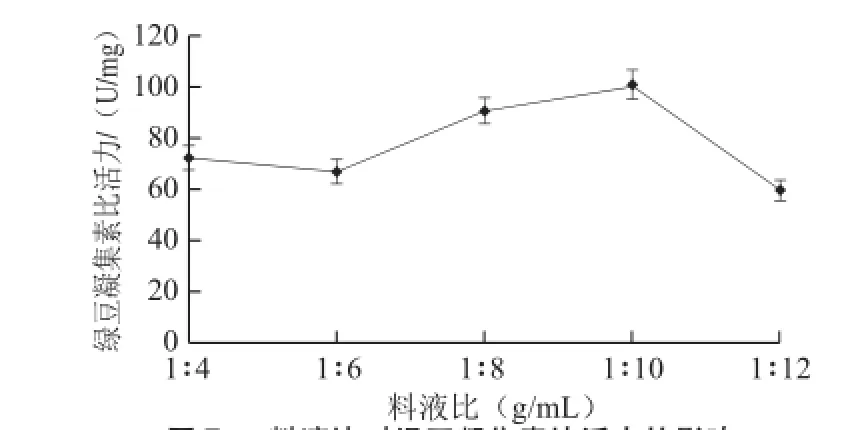
图7 料液比对绿豆凝集素比活力的影响Fig.7 Effect of solid-liquid ratios on the activity of mung bean lectin
2.3.5 NaCl浓度对绿豆凝集素浸提的影响

图8 NaCl浓度对绿豆凝集素比活力的影响Fig.8 Effect of NaCl concentration on the activity of mung bean lectin
由图8可见,当缓冲溶液中不添加NaCl时,绿豆凝集素比活力很低,随着NaCl浓度的升高,绿豆凝集素比活力开始升高,并在NaCl浓度0.3 mol/L时到到最大值,然后逐步降低并保持绿豆凝集素比活力的稳定,如图8所示。
2.4 响应面法优化绿豆凝集素提取工艺条件
2.4.1 模型方程的建立与显著性检验

表2 响应面试验分析方案及结果Table2 Program and experimental results of RSA
利用Design-Expert软件,通过表2中叶绿豆凝集素比活力试验数据进行多元回归拟合,获得绿豆凝集素比活力对编码自变量料液比、NaCl浓度和浸提时间的回归方程为:Y=134.21+6.82A-0.31B+9.73C-0.48AB+1.77AC+0.24BC-38.91A2-47.45B2-60.90C2。回归方差分析显著性检验(表3)表明,整体模型的P值小于0.01,表明该二次方程模型极显著,失拟项不显著,表明模型拟合有效,可以较好地描述各因素与响应值的真实关系。料液比和浸提时间的P值均小于0.01,对绿豆凝集素浸提影响极显著,而NaCl浓度对绿豆凝集素浸提影响不显著。由回归方程的各项方差分析结果表明,一次项和二次项都有显著性因素,表明选取的3因素对绿豆凝集素比活力的影响不是简单的线性关系,平方项对响应值也有很大影响。

表3 回归模型方程的方差分析Table3 Analysis of variance for the regression model
2.4.2 影响绿豆凝集素浸提比活力的主要因素分析
利用Design-Expert软件对表2的数据进行二次多元回归拟合,所得到的二次回归方程的响应面及其等高线见图9。由图9a可知,当固定NaCl浓度不变时,随着料液比的减小,浸提液中绿豆凝集素比活力呈现增加的趋势;等高曲线较密集,说明料液比对绿豆凝集素浸提影响显著,这一点从响应曲面陡峭程度上也可以直观的观察到,并在编码值0.089附近达到最大响应值最高点,而后略有下降;当固定浸提时间,由图9b分析亦可得出相同结论;这与本研究的单因素试验料液比对绿豆凝集素浸提影响的结果一致。浸提液较少时,浸提液不足以完全将绿豆粉中的凝集素浸出,还会增加其他杂质的浸出浓度;浸提液较多时,增加的浸提缓冲溶液将浸出的凝集素稀释,从而造成凝集活性的降低,且后期凝集素纯化制备时将增加浓缩成本。
当固定料液比、NaCl浓度时,由图9b、c分析可知,随着浸提时间的延长,比活力呈现先增加后减小的趋势,等高曲线在料液比增加(图9b)时比NaCl浓度增加(图9c)时更为密集,说明浸提时间、料液比之间的交互作用与浸提时间、NaCl浓度之间的交互作用相比更为明显,但是二者均不显著;绿豆凝集素比活力在A编码值0.089,B编码值-0.004附近取得最大响应值。与本研究的单因素试验浸提时间对绿豆凝集素浸提影响的结果一致。这可能是因为随着浸提时间的延长,绿豆凝集素不断浸提至溶液中,使比活力增加;但是浸提时间达到一定范围时,凝集素已经完全浸出到溶液中或达到一种浸出平衡状态,此时再延长浸提时间,将会使凝集素与空气接触时间延长,溶液中微生物的繁殖以及提取过程中的不断搅拌震动,使绿豆凝集素被氧化或者空间结构被生物、物理因素破坏而降解失活。
固定料液比和浸提时间,分析图9a、b,可以发现随着NaCl浓度的增加,绿豆凝集素的比活力呈现先增加后降低的趋势,从等高曲线分析NaCl浓度、料液比之间的交互作用和浸提时间、料液比之间的交互作用均不显著,绿豆凝集素比活力在A编码值0.5,B编码值0附近达到响应值最高点,这与本研究的单因素试验NaCl浓度对绿豆凝集素浸提影响的结果一致。可能是因为绿豆凝集素时盐溶蛋白,在PBS缓冲溶液中,提高NaCl浓度,会增加绿豆凝集素的溶出,使凝集活性增加;而NaCl浓度继续提高时,导致绿豆凝集素提取液中蛋白质与其他物质形成不溶性的蛋白复合物。


图9 各因素间等高线及响应曲面图Fig.9 Response surface and contour plots showing the effects of extraction conditions on the activity of mung bean lectin
利用Design-Expert软件对表2的数据进行二次多元回归拟合,所得到的二次回归方程的响应面及其等高线见图9。通过软件Design-Expert求解方程,可以得出模型的极值点:A =0.089;B=-0.004;C =0.081。经过转换得出最优提取条件为料液比1∶9.09、NaCl浓度0.3 mol/L、浸提时间4.16 h,最大绿豆凝集素比活力134.91 U/mg。使用优化最佳条件进行验证实验,结果表明,凝集素比活力为139.02 U/mg,与预测值很接近,说明模型可以起到一定的预测作用。
2.4.3 硫酸铵双重盐析结果
第1次盐析当硫酸铵饱和度分别为40%、50%、60%和70%时,所获得的蛋白质沉淀的凝集活性比活力分别为131.66、 340.14、536.37 U/mg和95.37 U/mg,因此收集40%~60%的硫酸铵饱和度范围盐析蛋白质沉淀进行第二次硫酸铵分级盐析。

图11 硫酸铵分级盐析结果Fig.11 Ammonium sulfate salting-out of mung bean lectin
从图11可知,两次盐析在硫酸铵饱和度为60%左右得到最高凝集素比活力,第1次盐析 和第2次盐析与验证实验相比纯化倍数分别达到3.86和5.80。
2.4.4 葡聚糖凝胶层析对绿豆凝集素粗提液进行纯化
对硫酸铵双重盐析后的凝集素粗品采用葡聚糖凝胶G-75进行分子筛层析,用电脑紫外检测器进行检测。在20 min和44 min分别出现峰1和峰2,收集样品进行凝集活性检验发现,峰1具有凝集活性,活 性达到1 611.82 U/mg,纯化倍数达11.59;峰2不具有凝集活性。

图12 葡聚糖凝胶层析谱图Fig.12 Gel filtration chromatography of mung bean lectin on Sephadex G-75 column
3 讨论与结论
实验确定了绿豆凝集素凝集活性检测最佳兔血红细胞处理条件,戊二醛体积分数0.15%,25 ℃固定25 min;胰蛋白酶添加量20 U/mL,25 ℃处理15 min;改进后的兔血红细胞处理方法具有更灵敏的凝集活性反应,并能保持凝集活性30 d以上。
采用响应面法对绿豆凝集素提取方法进行优化,得到拟合方程Y=134.21+6.82A-0.31B+9.73C-0.48AB+1.77AC+0.24BC-38.91A2-47.45B2-60.90C2,以及提取最优条件为料液比1∶9.09、NaCl浓度0.3 mol/L、浸提时间4.16 h,最大绿豆凝集素比活力139.02 U/mg。
在最优条件下浸提的绿豆凝集素粗品经双重硫酸铵分级盐析,在40%~60%饱和度范围内有最大凝集活性,经过葡聚糖凝胶G-75过滤,得到绿豆凝集素比活力达1 611.82 U/mg,凝集活性提高11.59 倍。
本研究优化了绿豆凝集素浸提方法,采用硫酸铵双重盐析之后进行葡聚糖分子筛层析的分离方法,减小了绿豆凝集素纯化过程中的活性损失,具有一定的应用前景。
[1] 高莹, 瞿礼嘉, 陈章良, 等. 植物凝集素的分子生物学研究[J]. 生物技术通报, 2000(5): 18-22.
[2] 单良, 姚惠源. 麦胚凝集素红细胞凝集活性检测方法的改进[J]. 无锡轻工大学学报, 2004, 23(1): 49-53.
[3] CHARLES N H, LELAND M S. The physical and enzymatic properties of a phytohemagglutinin from Mung bean[J]. The Journal of mological Chemistry, 1978, 253(21): 7791-7797.
[4] 吴定, 刘长鹏, 路桂红, 等. 响应面法优化麦胚凝集素分离纯化工艺研究[J]. 中国粮油学报, 2011, 26(11): 28-31.
[5] do NASCIMENTO-NETO L G, CARNEIRO R F, da SILVA S R, et al. Characterization of isoforms of the lectin isolated from the red algae bryothamnion seaforthii and its pro-healing effect[J]. Mar Drugs, 2012, 10: 1936-1954.
[6] TONG C, LI W, KONG L, et al. A novel yeast-binding lectin from hemolymph Cyclina sinensis (Gmelin) and its effects on yeast cells[J]. Process Biochemistry, 2012, 47: 2166-2171.
[7] PAN S, TANG J, GU X. Isolation and characterization of a novel fucose-binding lectin from the gills of bighead carp (Aris tichthys nobilis)[J]. Vet Immunol Immunopathol, 2010, 133: 154-164.
[8] MOMIC T, COHEN G, REICH R, et al. Vixapatin (VP12), a C-type lectin-protein from Vipera xantina palestinae venom: characterization as a novel anti-angiogenic compound[J]. Toxins, 2012, 4(10): 862-877.
[9] 朱建标, 王洪新. 洋刀豆凝集素的灭活研究[J]. 郑州工程学院学报, 2002, 23(1): 89-93.
[10] 孙册, 朱政, 莫汉庆. 凝集素[M]. 北京: 科学出版社, 1986: 1-52.
[11] TURNER R H, LIENER I E. The use of glutaraldehyde-treated erythrocytes for assaying the agglutinating activity of lectins[J]. Analytical Biochemistry, 1975, 68: 65l-653.
[12] 彭建宗, 陈兆平. 胰蛋白酶修饰兔红细胞对几种豆科植物凝集活性的影响[J]. 华南师范大学学报: 自然科学版, 1999(3): 59-62.
[13] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent [J]. Journal of Biological Chemistry, 1951, 193: 265-275.
[14] 唐超, 王清吉. 黑豆凝集素的提取及血凝效果研究[J]. 西南师范大学学报: 自然科学版, 2012, 37(2): 82-87.
[15] 李锋, 王竞, 赵晓军. 小白芸豆凝集素的分离纯化及性质研究[J]. 郑州大学学报: 自然科学版, 2010, 42(1): 120-124.
[16] 车东升, 刘飞飞, 穆成龙, 等. 大豆凝集素的分离纯化及活性鉴定[J].吉林大学学报: 理学版, 2012, 50(5): 1041-1044.
[17] 盘赛昆. 鳙鳃凝集素的分离纯化、理化性质及生物学活性研究[D].无锡: 江南大学, 2009.
[18] 江磊, 梅丽娟, 刘增根, 等. 响应面法优化枸杞叶粗多糖提取纯化工艺及其降血糖活性[J]. 食品科学, 2013, 34(4): 42-46.
[19] 佟万兵, 曹龙奎, 宋亮. 响应面法优化超临界CO2萃取玉米蛋白粉中叶黄素工艺[J]. 食品科学, 2013, 34(4): 37-41.
[20] 张煜, 王建英, 王晶研, 等. 硫酸铵盐析法分级分离大豆酸沉蛋白[J].河南师范大学学报: 自然科学版, 2011, 39(6): 99-100.
[21] MARIA T S, COELHO L C C B. Purification of a glucose/m annose specific lectin, isoform 1, from seeds of Cratylia mo llis Mart[J]. Applied Biochemistry and Biotechnology, 1995, 55(3): 261-273.
[ 22] 张遐, 鞠躬, 董光皎. 醛和戊二醛应用于神经系统免疫组织化学组织固定的特性分析[J]. 神经解剖学杂质, 1990, 6(2): 249-256.
Response Surface Methodology to Optimize the Extraction Process of Mung Bean Lectin
HUANG Ze-hua1, WANG Qian-wen1, ZHANG He1, LI Yu-nan1, LI Qing-bo1, CAO Long-kui1,2,*
(1. College of Food Science, Heilongjiang Bayi Agricultural University, Daqing 163319, China; 2. Agri-Food Processing and Engineer ing Technology Research Center of Heilongjiang Province, Daqing 163319, China)
The experiment was designed to use erythrocytes for assaying the agglutinating activity of mung bean lectin, and to improve the processing conditions for glutaraldehyde- and trypsin-treated rabbit red blood cells. Rabbit red blood cells (RBC) were fixed with 0.15% (V/V) glutaraldehyde at 25 ℃ for 20 min, and the RBC were treated with trypsin (25 U/mL) at 25 ℃ for 15 min to increase the assay activity and extend their preservation time. In the investigation, we found that the most suitable extraction solvent for mung bean lectin was phosphate buffer solution. Based on the results of single-factor experiments, a Box-Behnken design (BBD) of three variables at three levels each was carried out to obtain maximum activity of mung bean lectin by response surf ace analysis. The maximum activity of mung bean lectin was predicted to be 134.91 U/mg and observed to be 139.02 U/mg under the optimum extraction conditions: solid-to-liquid ratio, 1:9.09 (g/mL); NaCl concentration, 0.3 mol/L; and extraction time, 4.16 h.
mung bean lectin; response surfac e analysis; optimization; extraction
R284.2
A
1002-6630(2014)20-0031-06
10.7506/spkx1002-6630-201420007
2013-10-31
“十二五”国家科技支撑计划项目(2012BAD34B0205)
黄泽华(1988—),男,硕士研究生,研究方向为农产品加工。E-mail:huangzehua1988@163.com
*通信作者:曹龙奎(1965—),男,教授,博士,研究方向为农产品加工。E-mail:caolongkui2013@163.com

