核桃凝集素的提取及其性质
冀爱青,韩红艳,杨红雁,吴国良
(1.晋中学院生物科学与技术学院,山西 晋中 030600;2.晋中市气象局,山西 晋中 030600;3.河南农业大学园艺学院,河南 郑州 450002)
核桃凝集素的提取及其性质
冀爱青1,韩红艳1,杨红雁2,吴国良3
(1.晋中学院生物科学与技术学院,山西 晋中 030600;2.晋中市气象局,山西 晋中 030600;3.河南农业大学园艺学院,河南 郑州 450002)
以核桃仁为材料,对核桃凝集素的分离条件及其部分性质进行研究。结果表明:凝集活性值能准确反映凝集素的血凝效果;核仁经PBS缓冲液(pH 7.4)浸提24 h及质量分数70%硫酸铵分级沉淀,得到的核桃凝集素粗品能凝集人A、B、O、AB型血红细胞,且无血型专一性,其凝集活性不能被常见的单糖和寡糖抑制,但可被糖的衍生物所抑制;凝集活性在30~50 ℃基本不变,有较广泛的pH值作用范围(5.0~8.0);供试的5 个核桃品种中,薄壳香粗提液的凝集活性最强,凝集活性值达到0.478。
核桃;凝集素;活性;性质
核桃(Juglans regia)营养价值丰富,由此被国外誉为“大力士食品”、“益智果”,而在国内又享有“万岁子”、“长寿果”的美称。据《本草纲目》、《神农本草经》记载,核桃的药用价值很高,中医应用广泛,而现代营养分析表明核桃坚果内核仁的成分主要是脂肪和蛋白质,目前,国内对其营养的研究偏重于油脂方面,对蛋白资源的研究报道只限于一些核桃蛋白饮料[1-2]。植物凝集素是一类能凝集细胞和沉淀糖蛋白的非免疫源性的非酶蛋白质,在植物界广泛存在,在种子、根、茎、叶、皮、果实等各种组织器官中均有发现[3]。植物凝集素具有凝集血细胞、诱使细胞或机体代谢发生改变、抗病毒、防御等多种生物学活性,因此在细胞生物学、免疫学及基因工程方面呈现出较好的研究价值和应用前景[4]。植物凝集素存在于多种食品中,可与血细胞表面的抗原结合引起细胞破坏,影响免疫系统功能。如研究显示麸质面包含麦胚凝集素,长期食用可致麸质过敏;大豆凝集素如果食用过量,可致生长缓慢,甚至引起中毒[5]。核桃作为四大干果之一,受到人们的青睐,但国内外学者对核桃化学成分的研究只限于与人体医疗保健作用有关的生理活性物质方面[6-9],而核桃凝集素作为其另一类生理活性物质[10]的研究鲜见报道。本实验以5 个核桃品种坚果为材料,提取核桃凝集素粗提液(Juglans regia Lectin,JRL),并对其部分性质进行了研究,为今后核桃凝集素的研究和毒性评价提供理论依据。
1 材料与方法
1.1 材料与试剂
薄壳香、绿波、辽核、晋香一号和清香5 个核桃品种均采自河南农业大学园艺学院核桃园;人的A、B、O、AB型血样采集于晋中市四处医院化验科(采血管为浅蓝色头盖的枸橼酸钠凝血试验管);NaCl、KCl、(NH4)2SO4、NaOH均为分析纯 西安维利化工公司。
1.2 仪器与设备
DS-1型组织捣碎机、DZKW-4数显恒温循环水浴锅上海乔跃电子有限公司;DL-6000B离心机 江苏捷达离心机制造有限公司;FA1004型电子天平 上海精密科学仪器有限公司。
1.3 方法
1.3.1 核桃坚果凝集素粗提液的制备
去除核桃的外壳,取出核仁用体积分数75%酒精漂洗,蒸馏水冲洗3 次,捣碎、研磨并称质量后放入锥形瓶,以1∶30(g/mL)的比例加入石油醚,在30 ℃条件下,用水浴振荡器摇床脱脂5 h。将脱脂后的溶液抽滤,将滤渣放在培养皿中,在通风橱中晾干。晾干后,称取样品1 g加入30 mL浸提溶液,搅拌后放入4 ℃冰箱浸提。浸提后,4 800 r/min转速离心35 min,弃去沉淀。上清液中加入硫酸铵进行梯度分级沉淀,4 ℃过夜,4 800 r/min转速离心35 min,弃上清。沉淀溶于PBS溶液,4 000 r/min转速离心20 min,取上清液在PBS溶液透析过夜,然后换成蒸馏水透析除盐5~6 h,用0.1 mol/L的BaCl2溶液检测直至无白色沉淀为止,离心去除不溶物,得到JRL。
1.3.2 体积分数2%人血红细胞悬浮液的制备
血样带回实验室用质量分数0.9%生理盐水反复洗涤4~6 次,每次1 000 r/min转速离心5 min,弃上清,沉淀红细胞用PBS溶液配成体积分数2%的红细胞悬浮液。
1.3.3 凝集实验
凝胶实验采用96 孔V型血凝板,先在每一孔中加入50 μL的浸提液,后在每排的第1孔加入凝集素粗提液50 μL,混匀后,取出50 μL加入第2孔,以此类推,作自1∶2起至1∶2n为止的倍比稀释。同时设浸提液PBS溶液为对照,每种样品设一个重复。轻轻混匀,加入50 μL体积分数2%的人血红细胞悬浮液,静置30 min,观察记录凝集结果。如无凝集时,红细胞沉于底形成一个光滑的小圆点;如发生凝集时,红细胞呈网络状扩散。凝集效价以2n(n为使血红细胞凝集的最末孔数,也就是血红细胞产生凝集现象的最大稀释倍数)表示。本实验统计数据时为计算方便,对凝集效价进行量化,其加权平均数作为量化的凝集活性(agglutinating activity,Aa)[11]。
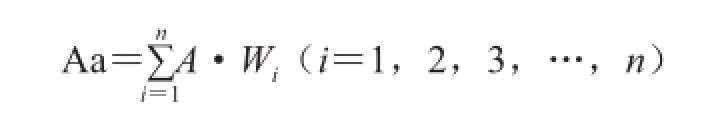
式中:A为待测液凝集反应赋值;Wi为凝集活性权重,Wi= 2-i;n为倍比稀释次数。
凝集效价赋值见表1。
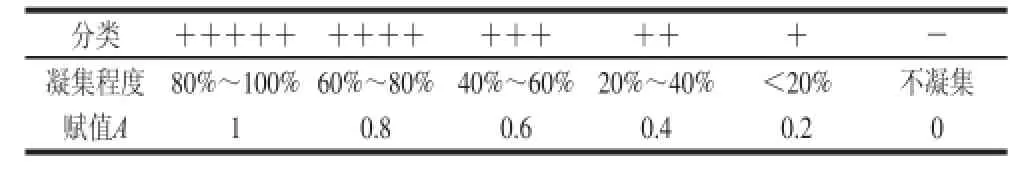
表1 凝集效价赋值Table1 Value assignment for agglutinating titers
1.3.4 JRL提取最佳条件的优化
参照其他植物果实凝集素的提取方案[12-15],确定了影响JRL提取的3 个主要因素:浸提时间、浸提溶液种类和硫酸铵质量分数。以薄壳香品种粗提液对人血红细胞A型的凝集活性为指标,设计三因素三水平的L9(34)正交试验,筛选出JRL提取的最优条件,因素水平见表2。
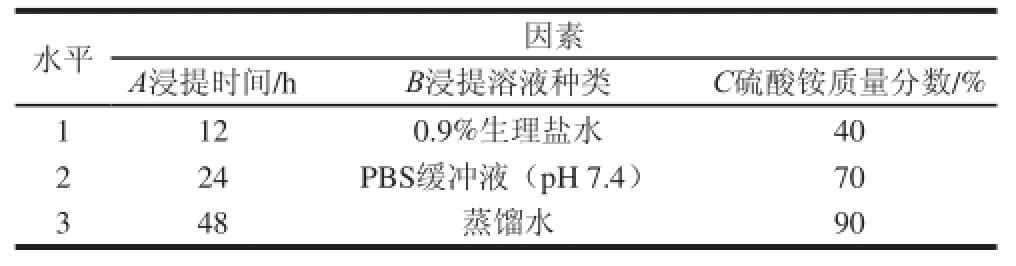
表2 正交试验因素水平表Table2 Coded levels for independent variables used in orthogonal array design factors and levels of orthogonal tests
1.3.5 JRL性质的测定
1.3.5.1 热稳定性
在小型离心管中加50 μL JRL与等量PBS缓冲液(pH 7.4)后,分别在30~90 ℃(梯度为10 ℃)恒温水浴中保温10 min,取出冷却至室温,在V型血凝板上进行倍比稀释,用体积分数2%的B型人血红细胞检测其血凝活性。
1.3.5.2 pH值稳定性
在小型离心管中加50 μL JRL,分别用缓冲液将其pH值调到3.5、5.0、6.5、7.8、8.0、9.2和10.5,放置2 h,加入等量体积分数2%的B型血细胞悬浮液,测定血凝活性。
1.3.5.3 糖专一性
在小型离心管中加50 μL JRL和50 μL PBS(pH 7.4)混匀,倍比稀释后,分别加入0.05 mol/L D-甘露糖、D-(+)岩藻糖、N-乙酰-D-葡萄糖胺、N-乙酰-D-半乳糖胺、唾液酸、麦芽糖6 种糖溶液,放置10 min,再加入等量体积分数2%的B型血细胞悬液,测定核桃凝集素粗提液的糖结合专一性。
1.3.6 不同品种JRL活性测定
将绿波、薄壳香、辽核、晋香一号和清香5个核桃品种坚果按照优化的凝集素提取方法得到JRL,分别对人的A、B、O、AB型抗凝血进行凝血效果检测。
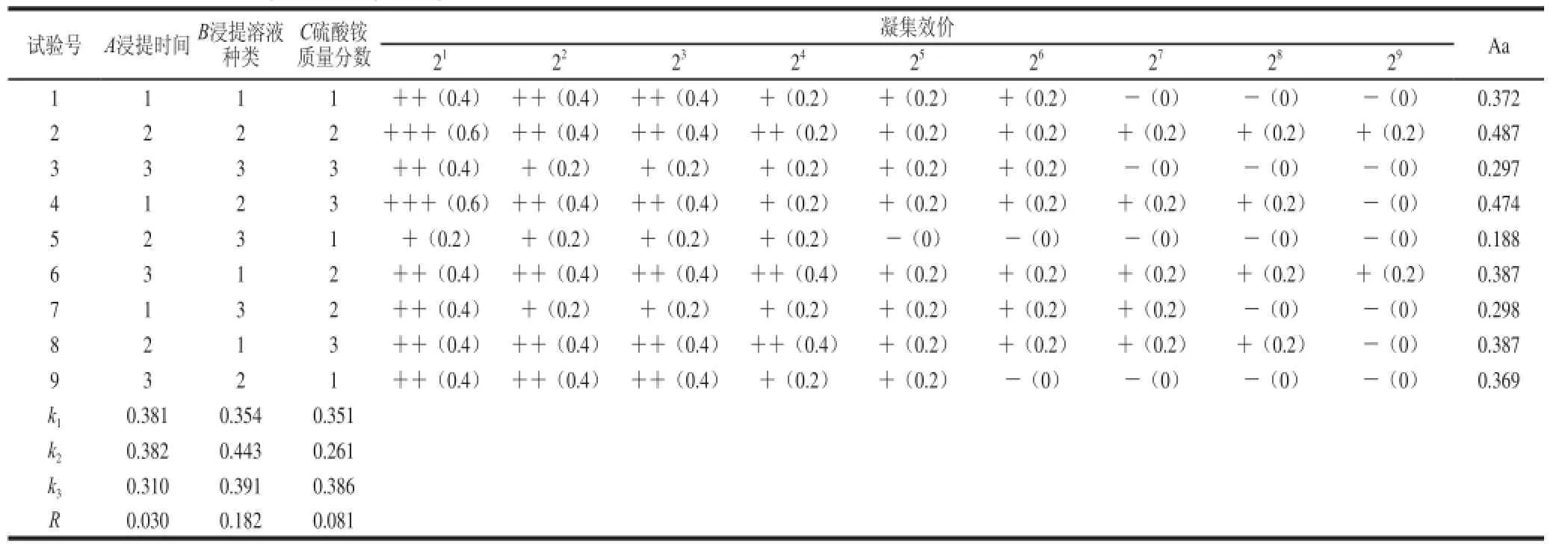
表3 JRL提取的正交试验设计及结果Table3 Orthogonal array design with results for extraction of walnut kernel lectin tests for the optimization of extraction of JRL
2 结果与分析
2.1 JRL提取正交试验优化
薄壳香凝集素粗提液对人A型抗凝血的凝集效果见表3。浸提液对照组呈阴性,而正交试验的9 个处理凝集素粗提液的凝集效价均在24以上,其中处理2、4、5和9凝集效价达到29;处理5、7、8凝集效价分别达到24、27、28,而处理1和3凝集效价达到26。以Aa值为指标,处理2最高(Aa=0.487),处理5最低(Aa=0.188)。比较二指标得出,Aa值能准确反映不同凝集素提取液的血凝效果。
正交试验结果显示JRL提取的最优水平组合为处理2(A2B2C2),即PBS缓冲液(pH 7.4)浸提24 h、质量分数70%硫酸铵分级沉淀提取的核桃凝集素Aa值最高,可达0.48 7;极差分析结果得知,浸提时间(A)、浸提溶液种类(B)和硫酸铵质量分数(C)对提取的凝集素的Aa值均有不同程度的影响,其顺序为B>C>A。表4方差分析可知,因素B、C对核桃凝集素的凝集活性影响达到显著水平,因素A的影响不显著。
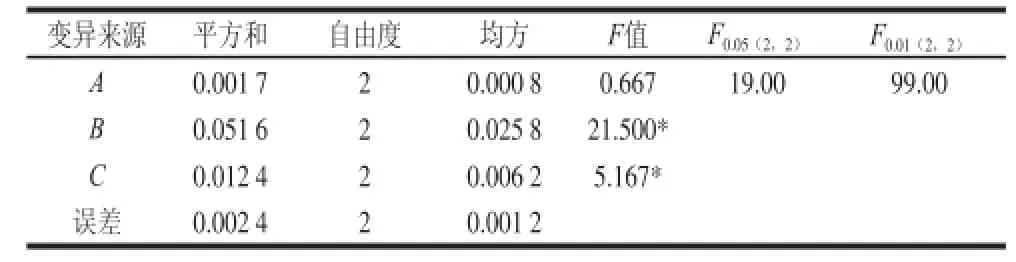
表4 方差分析表Table4 Variance analysiis
2.2 JRL性质
2.2.1 热稳定性
核桃凝集素粗提液在不同温度条件下的凝集反应实验表明,核桃凝集素具有一定的热稳定性(表5), 血凝活性在50 ℃以下基本稳定,50~90 ℃范围内,随着温度的升高,凝 集效价逐渐下降,90 ℃时完全丧失活性。
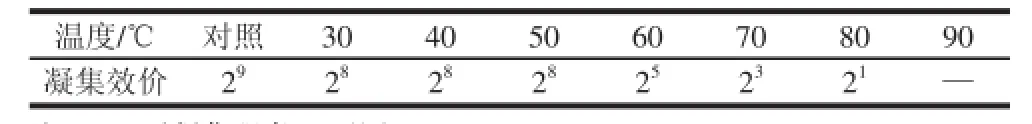
表5 温度对凝集活性的影响Table5 Effect of temperature on hemagglutination activity of walnut kernel lectin
2.2.2 pH值稳定性
核桃凝集素粗提液的pH值稳定性实验结果见表6。核桃凝集素的凝集活性对pH值的变化不敏感,在pH 5.0~8.0的缓冲范围内,pH值的改变基本不影响JRL的凝集效价。因此JRL具有一定的酸碱稳定性,凝集反应对酸碱条件的要求不高。
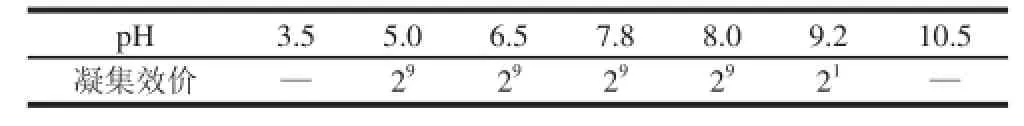
表6 酸碱度对凝集活性的影响Table6 Effect of pH on hemagglutination activity of walnut kernel lectin
2.2.3 糖专一性
核桃凝集素粗提液对所供试的6 种糖中,可与N-乙酰-D-葡萄糖胺和N-乙酰-D-半乳糖胺专一性结合,结果如表7所示,表明JRL可以识别一些乙酰化的糖链,而对其他4种单糖和寡糖不敏感,即JRL对糖的衍生物有明显的抑制作用,而其他单糖和寡糖对JRL的凝集活性影响不大。
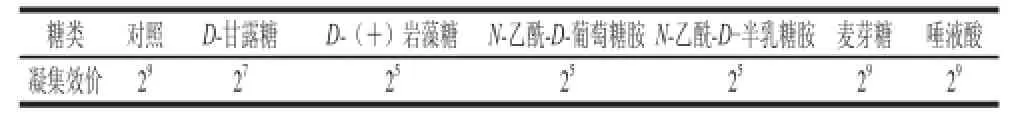
表7 糖对凝集活性的抑制作用Table7 Inhibitory effect of saccharides on hemagglutinatiion activity of walnut kernel lectin
2.3 不同核桃品种凝集素的血凝活性测定
如表8所示,绿波、薄壳香、辽核、晋香一号和清香5 个早实核桃品种均能凝集人血红细胞,但其凝集 活性略显差异。通过 比较可以看出,薄壳香对人血细胞的凝集活性最高(0.478),晋扁1号最低(0.312),其中绿波对AB型血的凝集活性达到0.543,而晋扁1号对A和B型血的凝集活性仅为0.150。此外,不同类型的人血红细胞对核桃凝集素的敏感程度不同,其中AB型血红细胞最敏感,5 个品种的凝集活性平均可达0.497,而A型血红细胞的敏感程度最低,平均值为0.329。
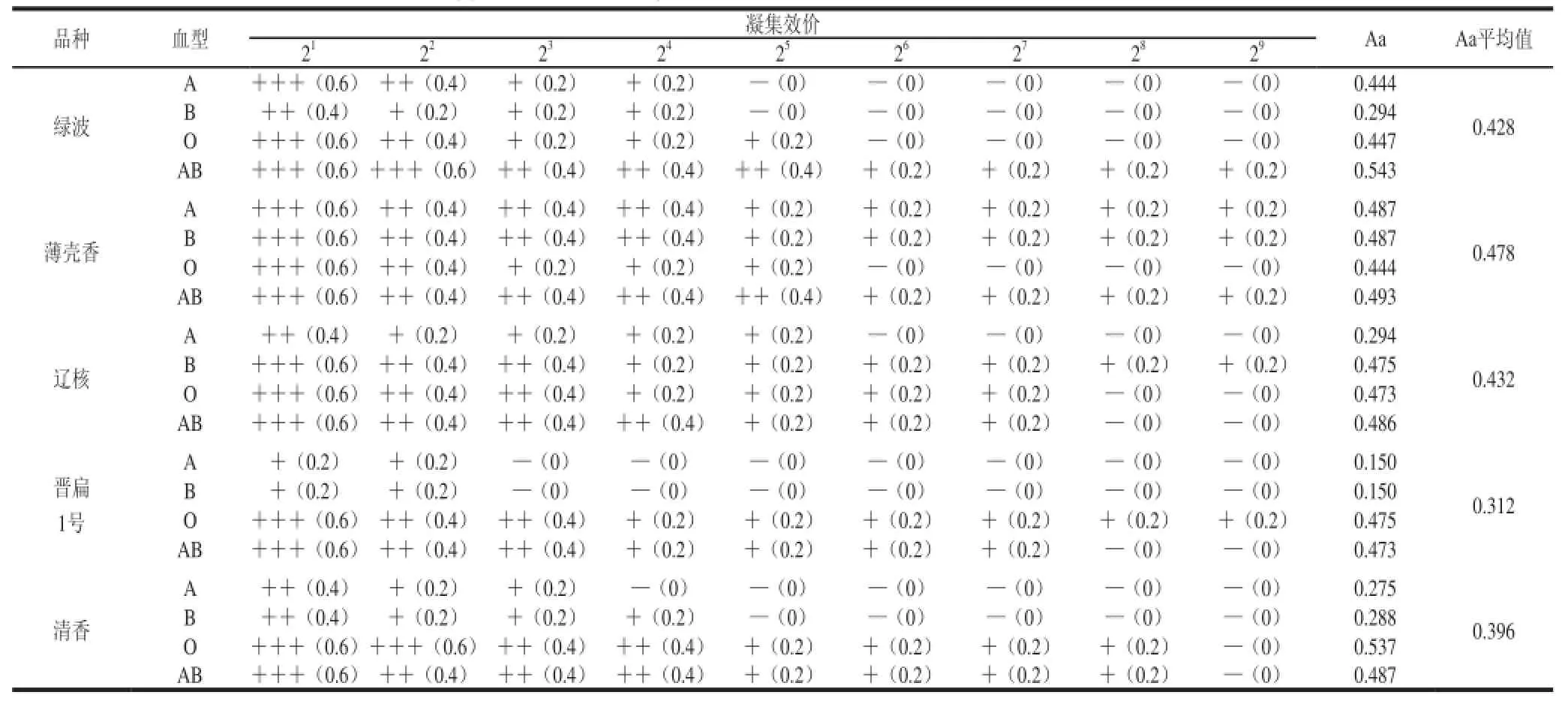
表8 JRL对人血红细胞的凝集活性Table8 Agglutination activity of walnut kernel lectin towards human red blood cells
3 结 论
本实验在探究提取核桃凝集素粗提液工艺基础上对其性质进行了研究,结果表明:核桃凝集素粗提液对人的A、B、O、AB型血细胞均有一定的凝集作用,说明核桃坚果中存在一定含量凝集素,而且品种间凝集活性存在差异,推测核桃凝集素对红细胞的凝集作用具有品种专一性;JRL表现出较强的热稳定性,在30~50 ℃凝集活力基本不变,且具有广泛的pH值作用范围(5.0~8.0);其凝集活性可被糖的衍生物如N-乙酰-D-葡萄糖胺和N-乙酰-D-半乳糖胺抑制,推测在JRL的亚基上有结合这类糖衍生物的受体,以此来抑制依赖糖衍生物增殖的病原菌的生长。
关于核桃坚果中凝集素的分离及相关性质的研究未见报道。JRL为抗营养因子,可根据它的理化性质使其灭活,如温度超过50 ℃的热处理或强酸(pH<5.0)强碱(pH>8.0)处理使其活力丧失,也可用糖的衍生物来抑制JRL的活力,从而保证核桃制品的食用安全性。此外,核桃具有消炎杀菌、防癌抗癌的作用,可能与其凝集素的抗增殖和抗肿瘤功能有关,这对抗肿瘤药物的开发可能有潜在的意义,这与已报道[16-20]的一些植物凝集素有相似之处。目前,关于JRL的纯化与性质的进一步研究正在进行之中。
[1] 孙树杰, 王兆华, 宋康, 等. 核桃营养价值及功能活性研究进展[J].中国食物与营养, 2013, 19(5): 72-74.
[2] GHARIBZAHEDI S M T, MOUSAVI S M, KHODAIYAN F, et al. Optimization and characterization of walnut beverage emulsions in relation to their composition and structure[J]. International Journal of Biological Macromolecules, 2012, 50(2): 376-384.
[3] 邓青, 陈巨莲, 程登发, 等. 植物凝集素及其抗蚜作用的研究进展[J].应用昆虫学报, 2013, 50(1): 268-275.
[4] 刘东亮, 吕慧, 李婷婷, 等. 植物凝集素诱导肿瘤细胞凋亡和自噬的研究进展[J]. 细胞与分子免疫学杂志, 2012, 28(6): 699-671.
[5] 戴大章, 陈妙月, 叶均安, 等. 理化处理对大豆凝集素活性的影响[J].营养学报, 2004, 26(3): 223-225.
[6] 吕海宁, 折改梅, 吕扬. 核桃和核桃楸的化学成分及生物活性的研究进展[J]. 华西药学杂志, 2010, 25(4): 489-493.
[7] GHARIBZAHEDI S M T, MOUSAVI S, HAMEDI M M, et al. Comparative analysis of new Persian walnut cultivars: nut/kernel geometrical, gravimetrical, frictional and mechanical attributes and kernel chemical composition[J]. Scientia Horticulturae, 2012, 135(24): 202-209.
[8] 曹志友, 欧阳瑾, 温娜, 等. 核桃青皮提取物对小鼠Lewis肺癌细胞生长的抑制作用[J]. 中国实验诊断学, 2012, 16(2): 232-233.
[9] VANDEN HEUVEL J P, BELDA B J, HANNON D B, et al. Mechanistic examination of walnuts in prevention of breast cancer[J]. Nutr Cancer, 2012, 64(7): 1078-1086.
[10] DE MEJÍA E G, PRISECARU V I. Lectins as bioactive plant proteins: a pote ntial in cancer treatment[J]. Critical Reviews in Food Science and Nutrition, 2005, 45(6): 425-445.
[11] 赵则海, 肖小琼, 邱卓荣, 等. 四棱豆叶中凝集素的提取及其凝集活性研究[J]. 现代食品科技, 2010, 26(12): 1341-1344.
[12] 邓俊林, 曾仲奎, 鄢波, 等. 苦参凝集素的分离纯化及部分性质研究[J].植物学报, 2000, 42(8): 828-833.
[13] RAJA S B, MURALI M R, KUMAR M K, et al. Isolation and partial characterisation of a novel lectin from Aegle marmelos fruit and its effect on adherence and invasion of shigellae to HT29 cells[J]. PLoS ONE, 2011, 6(1): 526-531.
[14] 林玉满, 苏爱华. 短裙竹荪(Dityophora duplicata)凝集素纯化与生化性质[J]. 中国生物化学与分子生物学报, 2005, 21(1): 101-107.
[15] WEARNE K, WINTER H C, GOLDSTEIN I J. Isolation of banana lectin-a practical scale procedure from ripe banana fruit[J]. Preparative Biochemistry Biotechnology, 2013, 43(3): 285-292.
[16] 刘艳如, 余萍, 郑怡. 狗脊蕨凝集素的分离纯化与部分性质[J]. 植物生理学通讯, 2003, 39(6): 647-650.
[17] LUO Youting, XU Xiaochao, LIU Jiwei, et al. A novel mannosebinding tuber lectin from Typhonium divaricatum (L.) decne (family Araceae) with antiviral activity against HSV-Ⅱ and anti-proliferative effect on human cancer cell lines[J]. Journal of Biochemistry and Molecular Biology, 2007, 40(3): 358-367.
[18] LEI H Y, CHANG C P. Lectin of concanavalin A as an anti-hepatoma therapeutic agent[J]. Journal of Biomed ical Sciecce, 2009, 16: 10.
[19] 韩红艳, 冀爱青, 刘林敬, 等. 5 种枣果实中凝集素的提取及生物活性分析[J]. 食品科学, 2012, 33(7): 270-274.
[20] 刘巍, 丁学知, 夏立秋, 等. 藠头蛋白质分离及抗肿瘤作用的研究[J].食品科学, 2013, 34(1): 300-302.
Extraction and Characterization of Walnut (Juglans regia) Kernel Lectin
JI Ai-qing1, HAN Hong-yan1, YANG Hong-yan2, WU Guo-liang3
(1. Department of Biology Science and Technology, Jinzhong College, Jinzhong 030600, China; 2. Jinzhong City Meteorology Bureau, Jinzhong 030600, China; 3. College of Horticultural Science, Henan Agricultural University, Zhengzhou 450002, China)
The aim of this study was to investigate the extraction conditions and some characteristics of lectin from walnut (Juglans regia) kernel. The results indicated that the agglutinating activity (Aa) could accurately reflect blood agglutination efficiency. Crude lectin with strong hemagglutination activity was obtained from walnut kernel by extraction with phosphate buffer solution (PBS) at pH 7.4 for 24 h followed by fractional precipitation with 70% (NH4)2SO4. The lectin could agglutinate A, B, O and AB types of red blood cells without blood type specificity. The hemagglutination activity could be inhibited by saccharide derivatives, but not by monose or oligose. The lectin from walnut kernel was temperature-insensitive, and showed a broad reaction pH range (5.0-8.0). The hemagglutination activity of walnut kernel lectin from Baokexiang cultivar was the strongest among five tested walnut cultivars, which showed an Aa of 0.478.
walnut (Juglans regia); lectin; activity; characterization
Q942.6
A
1002-6630(2014)20-0022-04
10.7506/spkx1002-6630-201420005
2014-02-17
国家自然科学基金面上项目(31171943);山西省特色专业建设项目(晋教材(2012)151号)
冀爱青(1976—),女,讲师,博士研究生,主要从事果树种质资源及栽培生理研究。E-mail:aiqingji2003@163.com
——以渤海S油田为例

