拟穴青蟹新型过敏原肌质钙结合蛋白的纯化、鉴定及分子克隆
毛海燕,蔡 娜,陈亨莉,曹敏杰,蔡秋凤,刘光明*
(集美大学生物工程学院,福建省高校水产科学技术与食品安全重点实验室,福建 厦门 361021)
拟穴青蟹新型过敏原肌质钙结合蛋白的纯化、鉴定及分子克隆
毛海燕,蔡 娜,陈亨莉,曹敏杰,蔡秋凤,刘光明*
(集美大学生物工程学院,福建省高校水产科学技术与食品安全重点实验室,福建 厦门 361021)
为进一步认识蟹类的过敏原,采用免疫印迹方法,分析发现甲壳类过敏患者血清能与拟穴青蟹肌浆蛋白中分子质量约为21 kD的蛋白质产生特异的IgE结合反应,结果显示该蛋白可能是蟹类新型过敏原。通过硫酸铵盐析、阴离子交换和凝胶过滤柱层析等方法对21 kD-蛋白进行分离纯化,采用Western blotting和基质辅助激光解析电离飞行时间质谱(matrix assisted laser desorption ionization-time of flight-mass spectrometry,MALDI-TOF-MS)确认纯化的21 kD-蛋白为肌质钙结合蛋白(sarcoplasmic calcium binding protein,SCP)。采用SMART-RACE(Switchin g Mechanism At RNA Termini-Rapid Amplification of cDNA Ends)的方法获得SCP的cDNA序列,该序列全长986 bp,开放阅读框为579 bp,编码193个氨基酸,其理论分子质量21.94 kD,等电点4.44。拟穴青蟹SCP与甲壳类动物SCP具有较高的同源性,与昆虫SCP的同源性较差;三级结构模拟分析显示,SCP含有5个螺旋-转角-螺旋结构区,即EF-手型结构区,并在其中两个手型结构区形成2个钙离子结合位点;进一步预测得到SCP的4个线性抗原表位和3个构象性抗原表位。
拟穴青蟹;新型过敏原;肌质钙结合蛋白;纯化;质谱分析;分子克隆;生物信息学分析
食物过敏是一类常见的变态反应疾病,近年来其发病率明显上升。临床症状主要有腹痛、腹泻、呕吐、皮疹、哮喘等,严重时会威胁人们的生命。甲壳类动物是联合国粮食及农业组织公布的八大类过敏食物之一,其含有多种过敏原,如:原肌球蛋白(tropomyosin,TM)、精氨酸激酶(arginine kinase,AK)、肌球蛋白轻链、肌钙蛋白C、磷酸丙糖异构酶和血蓝蛋白[1-3]。
肌质钙结合蛋白(sarcoplasmic calcium-binding protein,SCP)是存在于无脊椎动物肌肉和神经组织中的EF-手型钙离子结合蛋白,其功能与脊椎动物的小清蛋白(parvalbumin,PV)相似,主要参与肌肉的收缩[4]。Shiomi等[5]最先采用对虾过敏患者血清鉴定斑节对虾SCP(Pen m 4)为甲壳类的新型过敏原。Ayuso等[6]通过质谱鉴定了凡纳滨对虾中SCP是一种新型过敏原(Lit v4),并指出重组SCP能够诱导兔嗜碱性粒细胞释放β-氨基己糖苷酶。Bauermeister等[1]证实褐虾中的SCP(Cra c 4)也是一种过敏原。近期,本研究室报道克氏原螯虾SCP能够与甲壳类过敏患者血清产生免疫反应,证实SCP为克氏原螯虾的新型过敏原[7]。
蟹类是甲壳类动物的常见代表,其种类繁多,在我国就有600多种,包括梭子蟹、青蟹、雪蟹等。我国是世界上蟹类的生产与消费大国,2011年蟹类产量已达80万t[8]。但相对于虾而言,国内外对蟹类过敏原的研究较少。目前,已确定的蟹类过敏原是TM和AK[9-10]。赵绮华等[11]鉴定梭子蟹中主要致敏组分是74 kD 和48 kD的蛋白,次要致敏组分的分子质量为89、33 kD 和29 kD的蛋白,但未鉴定出这些组分是哪种蛋白。宋益银等[12]指出锯缘青蟹中14.3 kD的过敏原为血蓝蛋白亚基[12]。然而,国内外几乎没有蟹类SCP及其致敏性的研究报道。
本研究以拟穴青蟹为研究对象,采用甲壳类过敏患者血清,分析其肌浆蛋白中新型过敏原,并对新型过敏原进行分离纯化和鉴定。通过分子克隆得到拟穴青蟹新型过敏原的cDNA全序列,并与其他甲壳类动物的序列进行比较, 为分析拟穴青蟹新型过敏原抗原表位及结构特征等提供参考。
1 材料与方法
1.1 材料与试剂
鲜活的拟穴青蟹(Scylla paramamosain)购自厦门集美市场,去壳取肉,立即用于实验或置于-80 ℃冰箱保存备用。甲壳类过敏患者血清2份,编号依次为3295和3666,患者均自述对甲壳类水产品过敏且在采血前出现过敏症状;健康人血清2份,编号依次为9857和6246。以上血清来源于集美大学医疗中心,按等体积分装后于-30 ℃冰箱保存备用。
Q-Sepharose、Sephacryl S-200 瑞典Amersham公司;电泳用标准蛋白 立陶宛Fermentas公司;预染标准蛋白 英国New England公司;硝酸纤维素膜 美国Bio-Rad公司;辣根过氧化物酶标记的羊抗兔IgG二次抗体 美国Pierce公司;辣根过氧化物酶标记的鼠抗人IgE二次抗体 英国Southern Biotech公司;兔抗克氏原螯虾SCP多克隆抗体 本实验室制备。
总RNA提取试剂盒 美国 Roche公司;TIANScript cDNA第一链合成试剂盒、Taq DNA聚合酶、DNA纯化回收试剂盒 天根生化科技(北京)有限公司;SMART RACE Amplification Kit 美国Clontech公司;pGEM-T载体 美国Promega公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Avanti J-25高速冷冻离心机 美国Beckman公司;PT-2100组织捣碎机 瑞士 Kinematica公司;Lamda 35紫外分光光度计 美国Perkin Elmer公司;Biologic LP蛋白质柱层析系统、电泳槽及电转移装置 美国Bio-Rad公司;G:BOX 凝胶成像仪 英国Syngene公司;4800 Plus串联飞行时间质谱仪(MALDI TOF/TOF Analyzer)美国ABI公司。
1.3 肌浆蛋白的制备及免疫印迹分析
肌浆蛋白的制备方法参照Yu等[13]的方案并略做修改。取蟹肉100 g,切碎后置于4倍体积冰冷的缓冲液A (20 mmol/L Tris-HCl、10 mmol/L β-巯基乙醇、0.5 mmol/L 乙二胺四乙酸钠、20 mmol/L苯甲基磺酰氟,pH 8.0)。用组织捣碎机捣碎。将悬浮液于15 000×g,4 ℃离心20 min,上清液经绢布过滤后所得溶液即为肌浆蛋白。对肌浆蛋白进行SDS-PAGE分析[14],并以甲壳类动物过敏患者血清的免疫印迹分析肌浆蛋白的IgE结合活性[6]。
1.4 21 kD-蛋白的纯化及免疫印迹分析
将制备好的肌浆蛋白进行70%~90%饱和度的(NH4)2SO4盐析,于12000×g、4 ℃离心20 min;所得沉淀用缓冲液B(10 mmol/L Tris-HCl、10 mmol/L β-巯基乙醇、0.1 mmol/L乙二胺四乙酸钠,pH 8.0)溶解,再用不含β-巯基乙醇的缓冲液B充分透析,离心取上清。然后上样于已用缓冲液B平衡好的Q-sepharose柱。洗脱未吸附部分,分别用含0~0.15 mol/L和0.15~0.5 mol/L NaCl的缓冲液B进行线性洗脱,收集吸附部分。将洗脱部分的蛋白进行SDS-PAGE分析,合并含目的蛋白的溶液进行超滤浓缩后上样于已平衡好的Sephacryl S-200,用缓冲液B洗脱,收集洗脱液并进行SDS-PAGE分析。采用兔抗克氏原螯虾SCP多克隆抗体的Western blotting分析验证纯化的21 kD-蛋白是否为SCP,甲壳类动物过敏患者血清池的Dot blotting分析纯化的21 kD-蛋白是否具有IgE结合反应[7],血清池的构建是将甲壳类过敏患者血清等体积混合后用1%脱脂奶(pH 7.5磷酸缓冲液)进行1∶10稀释 。
1.5 21 kD-蛋白的质谱分析
1.5.1 样品制备
将纯化的21 kD-蛋白进行SDS-PAGE分析,考马斯亮蓝G-250染色,并脱色至出现清晰的蛋白条带,然后,将目的蛋白条带切下,冻干,加入5 μL 5 ng/μL的测序级胰蛋白酶溶液(酶与分析样品的质量比为1∶100),37 ℃反应20 min,然后吸出酶液,加入100 μL 60%乙腈和0.1%三氟乙酸的混合液,超声15 min;最后混合液与之前吸出的酶液合并,冻干[15]。
1.5.2 质谱分析
将冻干的样品与5 mg/mL α-氰基-4-羟基肉桂酸基质以1∶1的比例混合,用串联飞行时间质谱仪进行分析,激光源为Nd∶YAG激光器,波长355 nm,加速电压为2 kV,采用正离子模式和自动获取数据模式对数据进行采集。肽指纹图谱(peptide mass fi ngerprinting,PMF) 的质量扫描范围为800~4 000 D,选取一级质谱(mass spectrometry,MS)结果中信噪比大于50的母离子进行二级质谱(mass spectrometry mass spectrometry,MS-MS)分析。
使用Mascot搜索引擎,将质谱所得所有肽段的质量数及其图谱在NCBI数据库中搜索,搜索的参数设置如下:切割酶为Trypsin,允许最大漏切位点数(missed cleavage)为1,固定修饰为carbamidom-ethyl,可变修饰为oxidation,MS的误差10 010-6g/L,MS/MS的误差为0.6。
1.6 拟穴青蟹SCP的基因克隆
1.6.1 总RNA的提取和cDNA第一链的合成
取拟穴青蟹腿部肌肉,在液氮中迅速研磨后,约取50 mg研碎的组织至1.5 mL离心管中,加入1 mL Trizol,充分组织匀浆后室温放置5 min,加入200 μL三氯甲烷,剧烈振荡15 s,静置3 min,4 ℃、12 000×g离心15 min,将上层水相转入新的离心管中,加入等体积的异丙醇,充分混匀,室温放置30 min,4 ℃、12 000×g离心10 min,弃上清,用1 mL 75%乙醇洗涤沉淀,室温干燥5 min。加入20 μL DEPC水溶解, 测定RNA纯度及浓度。利用TIANScript cDNA第一链合成试剂盒合成cDNA,-20 ℃保存备用。
1.6.2 引物设计与合成
根据已报道的甲壳类S C P的基因序列(GenBank登录号:AEG79568、ACR43475、ACM89179、BAL72725)设计扩增引物(3R1:5’-AACCAGAAGATCATGTCCAACCTC-3’, 5F1:5’-GCGTTGGCGGACTCGTCGGGGTTG-3’)并由Invitrogen公司合成。
1.6.3 中间片段扩增
以上述cDNA为模板,进行PCR扩增,反应体系25 μL。扩增条件:94 ℃预变性5 min,94 ℃变性30 s、52 ℃复性45 s、72 ℃延伸1 min、30个循环,72℃延伸7 min,4 ℃保存。目的产物经琼脂糖凝胶电泳后采用DNA回收试剂盒纯化,与T载体连接并转化感受态大肠杆菌DH5α,在含5 μL异丙基-β-D-硫代吡喃半乳糖苷(200 g/L)、40 μL X-gal (20 g/L)及100 mg/L氨苄青霉素的LB平板上挑选白色菌落,37 ℃培养过夜,提取质粒,阳性克隆送上海英骏生物技术有限公司测序。
1.6.4 cDNA末端快速克隆
根据上述过程得到的cDNA中间序列以及接头引物Primer Mix(UPM)和Nested Universal Primer(NUP)序列,设计并合成基因特异性引物(5F2:5’-CTTGTCCTCATCAGTAGCGAGCTTG-3’,3R2:5’-CAAGACTGTCATTGGTCGCCTGTTC-3’)。使用SMART RACE Amplification Kit分别进行拟穴青蟹SCP cDNA 3’和5’端的克隆。
1.7 序列分析
应用DNA STAR软件推导出拟穴青蟹SCP的氨基酸序列。利用ExPAsy-SIB生物信息学资源数据库(http:// www.expasy.org/tools/)所提供的分析工具,分析拟穴青蟹SCP的基本性质,如:分子质量、等电点、钙离子结合位点。分别应用DNA STAR protean[16]和DiscoTope 2.0 Server[17]预测其可能的线性表位和构象性表位。通过BLAST (http://blast.ncbi.nlm.nih.gov)工具进行核酸相似性检索后,使用MEGA 5.0构建基于SCP氨基酸序列的系统进化树。通过Phyre 2.0 Server[18]模拟SCP的三级结构,利用PyMol软件对模型进行相关分析。
2 结果与分析
2.1 拟穴青蟹肌浆蛋白的制备及免疫印迹分析

图1 拟穴青蟹肌浆蛋白的SDS-PAGE分析(A)及其与甲壳类过敏患者血清的IgE免疫印迹分析(BB)Fig.1 SDS-PAGE (A) and IgE immunoblotting analysis (B) of myosinogen from Scylla paramamosain
通过组织匀浆及离心等步骤得到拟穴青蟹的肌浆蛋白,结果见图1A,采用甲壳类过敏患者血清对其进行免疫印迹分析,结果见图1B。在拟穴青蟹肌浆蛋白中分子质量约为21 kD的蛋白质能与甲壳类过敏患者血清发生特异的IgE结合反应,而不与健康人血清反应。
2.2 21 kD-蛋白的纯化及免疫印迹分析
将得到的肌浆蛋白,经过7 0%~9 0%的饱和(NH4)2SO4盐析,阴离子交换柱层析和凝胶柱层析后,目的蛋白得到了纯化,结果见图2A,采用兔抗克氏原螯虾SCP多克隆抗体对纯化的21 kD-蛋白进行Western blotting分析,结果见图2B。该蛋白能够与兔抗克氏原螯虾SCP多克隆抗体产生明显的杂交反应,因此初步判定纯化的21 kD-蛋白可能为拟穴青蟹SCP。将纯化的蛋白与甲壳类动物患者血清池反应,结果见图2C,发现纯化的21 kD-蛋白具有IgE结合活性。
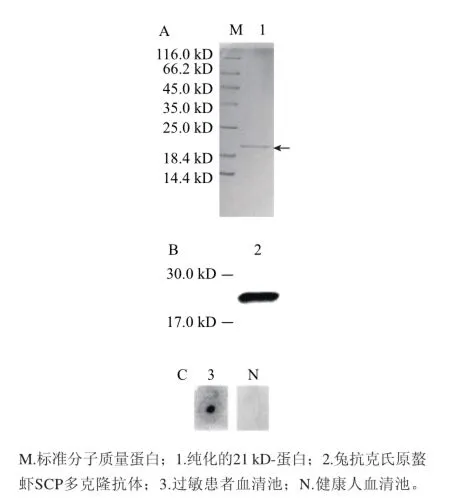
图2 纯化的拟穴青蟹21 kD-蛋白的SDS-PAGE图谱(A)、Westernblotting (B)及Dot blotting分析(C)Fig.2 SDS-PAGE (A), Western blotting (B) and Dot blotting (C) analysis of the isolated 21 kD-protein from Scylla paramamosain
2.3 21 kD-蛋白的质谱分析
将拟穴青蟹21 kD-蛋白经胰蛋白酶酶切后,进行基质辅助激光解析电离飞行时间质谱(matrix assisted laser desorption ionization-time of flight-mass spectrometry,MALDI-TOF-MS)分析,从一级质谱图中选择强度较高的肽段进行串联质谱分析,将分析结果经Mascot搜索引擎在NCBI数据库中进行检索。根据Mascot的评分标准(P<0.05),将得分排在前3位的蛋白信息列于表1,它们分别是变色小长臂对虾(Palaemonetes varians)、褐虾(Crangon crangon)、克氏原螯虾(Procambarus clarkii)的SCP。质谱分析结果再次证实,拟穴青蟹中分子质量位于21 kD过敏原确实为SCP。

表1 Mascot检索结果Table 1 Mascot search results
2.4 拟穴青蟹SCP的基因克隆及序列分析
通过SMART-RACE的方法扩增拟穴青蟹SCP cDNA基因序列,结果见图3。其全长为986 bp,开放阅读框长579 bp,编码193个氨基酸,推导分子质量为21.94 kD,等电点为4.44,具有两个钙离子结合位点。DNA star protean软件分析表明,拟穴青蟹SCP具有4个线性抗原表位,它们分别位于AA 53~57、AA 72~76、AA 90~92、AA 140~159。克隆得到的序列已提交至GeneBank,登录号为JQ860424。

图3 拟穴青蟹SCP cDNA序列及氨基酸序列Fig.3 The cDNA and deduced a mino acids sequence of SCP from Scylla paramamosain
将拟穴青蟹SCP与其他物种SCP的氨基酸序列进行比对,由图4可知,克氏原螯虾(Procambarus clarkii)SCP的同源性为85%(164/193),与褐虾(Crangon crangon)SCP的同源性为82%(157/192),与南美白对虾(Litopenaeus vannamei)的同源性为80% (154/193),与斑节对虾(Penaeus monodon)SCP的同源性为79%(152/193),与日本对虾(Marsupenaeus japonicas)SCP的同源性为78%(150/193),与黑腹果蝇(Drospphila melanogaster)SCP的同源性为23% (44/192)、与蝇蛹金小蜂(Nasonia vitripennis)SCP的同源性为22%(43/192)。
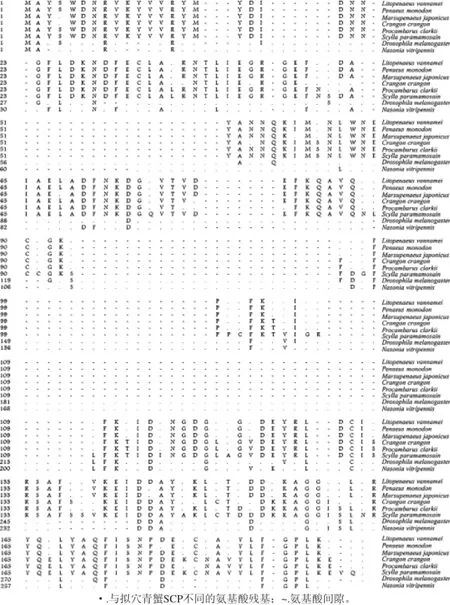
图4 拟穴青蟹与部分无脊椎动物SCP的序列比较Fig.4 Multiple sequence alignment of SCP between Scylla paramamosain and selected invetebrate
2.5 拟穴青蟹SCP的系统进化关系分析
使用MEGA 5.0软件对拟穴青蟹SCP与其他7种甲壳类物种SCP序列构建系统进化树,结果如图5所示。昆虫类SCP聚为一簇,甲壳类SCP聚为一簇,其中拟穴青蟹SCP与克氏原螯虾SCP、褐虾SCP具有更近的亲缘性。

图5 SCP的系统进化树Fig.5 Phylogenetic tree of SCP from different organisms
2.6 拟穴青蟹SCP三级结构预测及其构象性表位分析

图6 拟穴青蟹SCP三级结构模型(A)及其构象性表位区域示意图(B)Fig.6 The simulated three-dimensional structure of SCP from Scylla paramamosain (A) and schematic diagram of its conformational epitope regions (B)
以拟穴青蟹SCP氨基酸序列为模板,通过Phyre 2.0 server对其进行同源建模,利用PyMol软件对模型进行分析,结果如图6A所示:SCP包含9个α螺旋,形成5个螺旋-转角-螺旋结构区,并折叠成紧密的球状。DiscoTope 2.0 Server预测显示SCP具有3个构象性抗原表位,其分布情况如图6B(1~3)所示。
3 结 论
蟹类味道鲜美、营养丰富备受消费者喜爱,但因食用蟹类而导致的食物过敏事件时有发生[19]。本研究通过甲壳类过敏患者血清与拟穴青蟹肌浆蛋白之间的免疫反应,确定其分子质量为21 kD的蛋白为拟穴青蟹新型过敏原。并对其进行分离纯化,纯化的蛋白具有IgE结合活性。值得一提的是在进行阴离子交换柱层析的过程中过敏原AK首先得到了纯化,而含有杂蛋白的目的条带则是在其后被洗脱下来的,然后经凝胶过滤柱层析得到纯化。Western-blotting和质谱分析技术均证实该过敏原为SCP。
分子克隆结果表明,拟穴青蟹SCP的理论分子质量21.94 kD,等电点4.44,该结果与已报道的虾类SCP相近,例如:褐虾SCP的分子质量22.08 kD,等电点4.55[1];斑节对虾SCP分子质量为22.12 kD,等电点为4.64[5];南美白对虾SCP的分子质量22.06 kD,等电点4.58[6];克氏原螯虾SCP的分子质量21.77 kD,等电点4.54[7]。序列比对结果显示其与其他甲壳类动物SCP具有较高的同源性,而与昆虫相比却存在较大的差异。
拟穴青蟹SCP的三级结构是由9个α螺旋形成的5个螺旋-转角-螺旋结构区构成,且具有2个钙离子结合位点。Morii等[20]证实通过添加金属离子螯合剂EGTA能够使斑节对虾SCP的IgE结合活性下降,同时他们通过全序列合成肽的方法对斑节对虾SCP的IgE抗原表位进行研究发现,其不含线性的IgE抗原表位,因此推测斑节对虾SCP的抗原表位为构象性。有研究表明无脊椎动物的SCP与脊椎动物的PV都是EF-手型钙离子结合蛋白,且具有相似功能[21]。阮密密等[22]曾报道鳜鱼PV的三级结构是由6个α螺旋,形成3个螺旋-转角-螺旋结构区构成。也有研究[23]指出PV是存在于鱼类和蛙类中的过敏原,添加金属离子螯合剂EGTA能够使小清蛋白IgE结合活性下降。从以上研究,可以推测SCP与PV相似,其IgE结合活性与Ca2+密切相关。
通过生物信息学的方法得到拟穴青蟹SCP的4个线性抗原表位和3个构象性抗原表位,结果发现:构象性表位2(71~73AA)与线性表位2(72~76AA)具有两个相同的氨基酸,且其本身的氨基酸序列是连续的;构象性表位3(157AA)只含有1个氨基酸,包含在线性表位4(140~159AA)中;构象性表位1与线性表位没有重叠或相邻的氨基酸。该结果说明,拟穴青蟹SCP中可能同时存在线性和构象性的抗原表位。这一结论需要在以后的实验中利用更多的甲壳类过敏患者血清加以证实。本实验证实SCP为拟穴青蟹新型过敏原,对其进行分离纯化、质谱鉴定和分子克隆,并对获得的序列进行同源比对、进化关系分析、三级结构建模和抗原表位预测等研究,系统地分析了拟穴青蟹的分子结构特征,为研究蟹类SCP的过敏原性及构象关系打下了基础。
[1] BAUERMEISTER K, WANGORSCH A, GAROFFO L P, et al. Generation of a comprehensive panel of crustacean allergens from the North Sea Shrimp Crangon crangon[J]. Molecular Immunology, 2011, 48(15):1983-1992.
[2] SHEK LP, LEE BW. Food allergy in Asia[J]. Current Opinion in Allergy and Clinical Immunology, 2006, 6(3):197-201
[3] LOPATA A L, O’HEHIR R E, LEHRER S B. Shellfish allergy[J]. Clinical and Experimental Allergy, 2010, 40(6): 850-858.
[4] HERMANN A, COX J. Sarcoplasmic calcium-binding protein[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1995, 111(3): 337-345.
[5] SHIOMI K, SATO Y, HAMAMOTO S, et al. Sarcoplasmic calciumbinding protein: identification as a new allergen of the Black Tiger Shrimp Penaeus monodon[J]. International Archives of Allergy and Immunology, 2008, 146(2): 91-98.
[6] AYUSO R, GRISHINA G, IB˘ÑEZ M D, et al. Sarcoplasmic calcium-binding protein is an EF-hand-type protein identified as a new shrimp allergen[J]. Journal of Allergy and Clinical Immunology, 2009, 124(1):114-120.
[7] CHEN Hengli, CAO Minjie, QIU Fengcai, et al. Purification and characterization of sarcoplasmic calcium-binding protein, a novel allergen of red swamp crayfish (Procambarus clarkii)[J]. Food Chemistry, 2013, 139(2): 213-223.
[8] 刘增胜, 崔利锋, 徐晖, 等. 中国渔业年鉴[M]. 北京: 中国农业出版社, 2012: 180-190.
[9] LIANG Yinglong, CAO Minjie, SU Wenjin, et al. Identification and characterization of the major allergen of Chinese mitten crab (Eriocheir sinensis)[J]. Food Chemistry, 2008, 111(4): 998-1003.
[10] SHEN Yuan, CAO Minjie, QIU Fengcai, et al. Purification, cloning, expression and immunological analysis of Scylla serrata arginine kinase, the crab allergen[J]. Journal of the Science of Food and Agriculture, 2011, 91(7): 1326-35.
[11] 赵绮华, 王锡忠, 陈丽金. 梭子蟹变应原的分离纯化与鉴定[J]. 中国免疫学杂志, 2007, 23(3): 256-259.
[12] 宋益银, 林蕾, 苏秀榕. 锯缘青蟹(Scylla serrata)特异性过敏原的研究[J]. 海洋与湖沼, 2009, 40(1): 62-67.
[13] YU C J, LIN Y F, CHIANG B L, et al. Proteomics and immunological analysis of a novel shrimp allergen, Pen m 2[J]. The Journal of Immunology, 2003, 170(1): 445-453.
[14] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[15] SHEN Haiwang, CAO Minjie, QIU Fengcai, et al. Purification, cloning, and immunological characterization of arginine kinase, a novel allergen of Octopus fangsiao[J]. Journal of Agricultural and Food Chemistry, 2012, 60(9): 2190-2199.
[16] 沈海旺, 陈亨莉, 曹敏杰. 甲壳类动物四种过敏原的序列分析、抗原表位预测及三维结构建模[J]. 免疫学杂志, 2012, 28(7): 590-595.
[17] KRINGELUM J V, LUNDEGAARD C, LUND O, et al. Reliable B cell epitope predictions: impacts of method development and improved benchmarking[J]. PLoS Computational Biology, 2012, 8(12): 1-10.
[18] KELLEY L A, STERNBERG M J. Protein structure prediction on the web: a case study using the Phyre server[J]. Nature Protocols, 2009, 4(3): 363-371.
[19] 张明琦, 支玉香, 吕淑霞. 铁蟹过敏原的分离、鉴定和快速纯化[J].核农学报, 2009, 23(5): 839-842.
[20] MORII A, MITA H, ISHIZAKI S, et al. Importance of conformation for the IgE reactivity of sarcoplasmic calcium-binding protein from the black tiger shrimp Penaeus monodon[J]. European Food Research and Technology, 2013, 236(1): 165-170.
[21] TOMURA S, ISHIZAKI S, NNAGASHIMA Y J, et al. Reduction in the IgE reactivity of Pacific mackerel parvalbumin by mutations at Ca2+-binding sites[J]. Fisheries Science, 2008, 74(2): 411-417.
[22] 阮密密, 蔡秋凤, 刘光明. 鲫和鳜主要过敏原小清蛋白的基因克隆及序列分析[J]. 水产学报, 2012, 36(11): 1650-1657.
[23] UNTERSMAYR E, SZALAI K, RIEMER A B, et al. Mimotopes identify conformational epitopes on parvalbumin, the major fish allergen[J]. Molecular Immunology, 2006, 43(9): 1454-1461.
Purification, Identification and Cloning of a Novel Crab Allergen, Sarcoplasmic Calcium Binding Protein, from Scylla paramamosain
MAO Hai-yan, CAI Na, CHEN Heng-li, CAO Min-jie, CAI Qiu-feng, LIU Guang-ming*
(Key Laboratory of Science and Technology for Aquaculture and Food Safety, College of Biological Engineering, Jimei University, Xiamen 361021, China)
For acquiring more information about crab allergens, a 21 kD protein was purified from Scylla paramamosain by ammonium sulfate fractionation, anion exchange chromatography and gel filtration column chromatography. The protein was identified as a novel allergen having IgE binding activity with serum from shellfish-allergic patients. According to the results of Western blotting and matrix assi sted laser desorption ionization-time of flight-mass spectrometry (MALDI-TOF/ TOF-MS) studies, the protein was confirmed as a sarcoplasmic calcium binding protein (SCP). The method of switching mechanism at RNA termi ni-rapid amplification of cDNA ends (SMART-RACE) was applied to clone the cDNA of SCP. A full length cDNA with 986 bp was obtained, which included an open reading frame (ORF) coding for 193 amino acid residues with a predicted molecular weight of 21.94 kD and t heoretical isoelectric point of 4.44. The protein had a high homology with SCP from other shellfishes, but the homology with insects was low. Its tertiary structure was constructed using Phyre 2.0 server and the results showed that the SCP had five helix-loop-helix motifs, namely EF-hand domains, two of which formed two Ca2+binding sites. Furthermore, bioinformatics analysis predicted that this SCP contained four linear and three conformational epitopes.
Scylla paramamosain; novel allergen; sarcoplasmic calcium binding protein; purification; mass spectrometry; cloning; bioinformatics analysis
TS254.2;Q785;R392.8
A
1002-6630(2014)03-0122-06
10.7506/spkx1002-6630-201403025
2013-03-16
国家自然科学基金项目(31171660);福建省杰出青年科学基金项目(2010J06012)
毛海燕(1986—),女,硕士研究生,研究方向为食品生物技术。E-mail:kathleen_mm@nwsuaf.edu.cn
*通信作者:刘光明(1972—),男,教授,博士,研究方向为食品生物技术。E-mail:gmliu@jmu.edu.cn

