台兰ISSR-PCR反应体系的建立与优化
王朝雯,王云艳,肖春宏,孙小琴,杨柏云
(1.临沧师范高等专科学校数理系,云南临沧677000;2.南昌大学生命科学与食品工程学院,江西南昌330031)
台兰(Cymbidium floribundum var.pumilum)又名蜜蜂兰、蜂子兰、金棱边、蒲兰等,为兰科(Orchidaceae)兰属(Cymbidium)多年半地生性兰科植物。兰花的种质资源是选种育种的基础,种质资源一旦灭绝,无法再造,从这一意义上来说,野生兰花若再不加以保护,将会对世界兰花的育种、研究造成不可弥补的损失,并将会直接威胁到我国兰花经济的持续发展。目前,关于兰科植物的研究主要集中在形态学、分类学、生理学、孢粉学、区系地理学和繁殖生物学等方面[1-2],而关于居群遗传学的研究则很少。
近年来,应用ISSR-PCR分子标记技术对植物进行遗传多样性研究已有较多报道[3-5],而采用ISSR技术对野生台兰的遗传多样性和居群遗传结构进行的研究鲜有报道。笔者以采自江西省赣州市齐云山的台兰作为试验材料,对台兰ISSR-PCR反应体系进行优化,以建立比较完善的反应条件,以期为建立为进一步利用ISSR分子标记技术进行台兰遗传多样性研究提供基础。
1 材料与方法
1.1 材料 试验样品采自江西省赣州市齐云山的一个自然居群,每个居群采集15~20个样本。记录采集样品的经纬度、海拔和生境,同时对每个居群采集凭证标本供研究用。采集完成后用硅胶干燥法进行处理、保存,备用。
1.2 基因组DNA的提取 采用改良的CTAB法提取台兰基因组DNA,步骤如下:①取0.05 g硅胶干燥的台兰叶片材料,置于1.5 ml离心管中加液氮研磨成粉末后,加入0.75ml 65 ℃预热的2×CTAB 抽提缓冲液(pH8.0),20μlβ-硫基乙醇,轻轻摇动使溶液分散均匀,65℃水浴1 h,水浴过程每隔10 min轻轻摇动。②冷却至室温,加等体积的氯仿∶异戊醇(24∶1),混合均匀,12 000 r/min离心10 min。③吸取上层液相转入新的1.5 ml离心管,加等体积氯仿异戊醇,摇匀。④12 000 r/min离心10min。取上层液相,加1/10体积3mol/L的冰醋酸钠,2倍体积-20℃的无水乙醇,-20℃保存20 min。⑤勾出DNA。⑥加70%乙醇洗涤2次,用无水乙醇洗涤1次,风干。⑦用40μl 0.1TE溶解 DNA,-20℃长期保存备用。
1.3 DNA样品的检测 用1.0%琼脂糖电泳检测DNA质量;用分光光度计测定其纯度和浓度,DNA纯度以OD260/OD280的比值来估算,浓度估算法为:DNA浓度(ng/μl)=OD260×50×稀释倍数。计算DNA获得率(DNA量/所用叶片量×100%)为1.8%。
1.4 ISSR-PCR 扩增反应
1.4.1 ISSR-PCR 条件筛选。反应体系为25 μl,其中10×buffer 2.5 μl,引物浓度为 0.4 μmol/L,双蒸水 15.78 μl。为确定PCR反应中其他4项因素(DNA模板、Taq DNA聚合酶、Mg2+和dNTPs)的最佳水平,试验用引物对ISSR-PCR反应的这4项影响因素逐个进行5个水平的研究,各反应参数变化量见表1。反应总体积为25μl(含2.5μl10×buffer和15.78 μl ddH2O)。
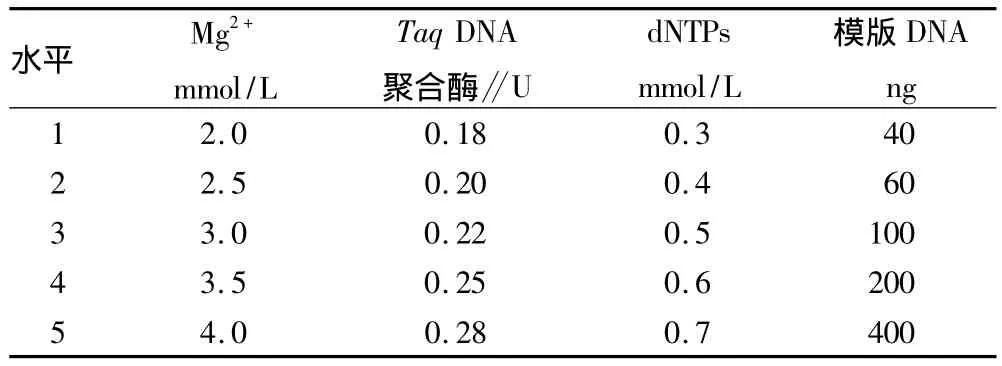
表1 ISSR-PCR反应体系各成分优化试验设计
1.4.2 ISSR引物筛选。ISSR引物根据加拿大British Columbia大学公布的序列设计,由上海生物工程技术服务有限公司合成,编号为UBC 808~UBC ISSR22,共96条引物。每次试验选择Tm值接近的12个引物,具体见表2。

表2 ISSR引物及其序列
1.4.3 PCR 扩增步骤及参数。取1.5 ml已灭菌 eppendorf管,依扩增的样本数计算各成分的量,依次加入ddH2O→10×buffer→dNTPs→Taq酶,混匀后分装到各扩增薄壁管中,依次加入模板,按循序放入PCR扩增仪样本中,按以下程序进行扩增。扩增完毕,将样本取出,置于4℃ 冰箱保存,等待电泳。反应条件:94℃预变性5 min;94℃变性30 s,50~60℃退火30 s,72℃延伸50 s,共40个循环;72℃延伸7min,4℃保存。PCR产物用1%琼脂糖凝胶进行电泳检测,并回收纯化目的条带。
1.5 电泳与拍照 PCR扩增结束后,以 GeneRuler 100 bp DNA Ladder Plus(上海生物工程公司产品SM0321)为分子量标记,用含有0.1%EB的1.5%琼脂糖凝胶电泳(0.6 g琼脂糖,40ml1×TAE缓冲液),电泳缓冲液为1×TAE电泳缓冲液100 V稳压100mA电泳45~60min,凝胶成像仪下成像拍照并保存。
2 结果与分析
2.1 Taq DNA聚合酶对 ISSR-PCR反应的影响 试验设计了 Taq DNA 聚合酶5 个浓度梯度为0.18、0.20、0.22、0.25和0.28 U,同时对 5 个引物 18291、18294、18295、18297 和18298进行筛选。图1表明,当Taq DNA聚合酶浓度为0.18和0.20 U 时,扩增谱带模糊不清;浓度为 0.20、0.25、0.28 U时,扩增谱带较弱,且数量相对较少;浓度为0.22 U时扩增条带较多且较亮,效果最好,故确定为最佳浓度。同时可以看出引物18257和18297的条带较为清晰而且数量较多,筛选出效果较好的引物为18257和18297。

图1 Taq DNA聚合酶对ISSR扩增的影响
2.2 dNTPs浓度对ISSR-PCR反应的影响 图2表明,当浓度为0.3 mmol/L时,几乎无扩增产物;在0.4 mmol/L时,虽有扩增产物,但谱带较弱不易辨认;浓度为0.5~0.7 mmol/L时,均能扩增出清晰的谱带,但在0.6~0.7 mmol/L,扩增产物不稳定且有非特异性扩增;在0.6 mmol/L时,扩增谱带较弱或一些大的片段扩增缺失。考虑到结果的稳定性和减少试验成本,选用0.5 mmol/L的dNTPs浓度,在此浓度下,扩增产物稳定、重复性强。同时对引物18262、18265、18266、18268和18269进行筛选,得出18265和18269扩增效果较好。
2.3 M g2+浓度对 ISSR-PCR反应的影响 图3表明,Mg2+浓度对反应体系影响不是很明显,除浓度为2.0 mmol/L时扩增条带稍亮些以外,其他浓度电泳出的条带数目及清晰度基本类似。由此可见,台兰基因组DNA的ISSR扩增反应对Mg2+浓度不敏感,Mg2+含量许可范围较大,但考虑到结果的稳定性和可重复性,选用2.0mmol/L为最佳浓度,同时筛选出较好的引物为18264和18267。
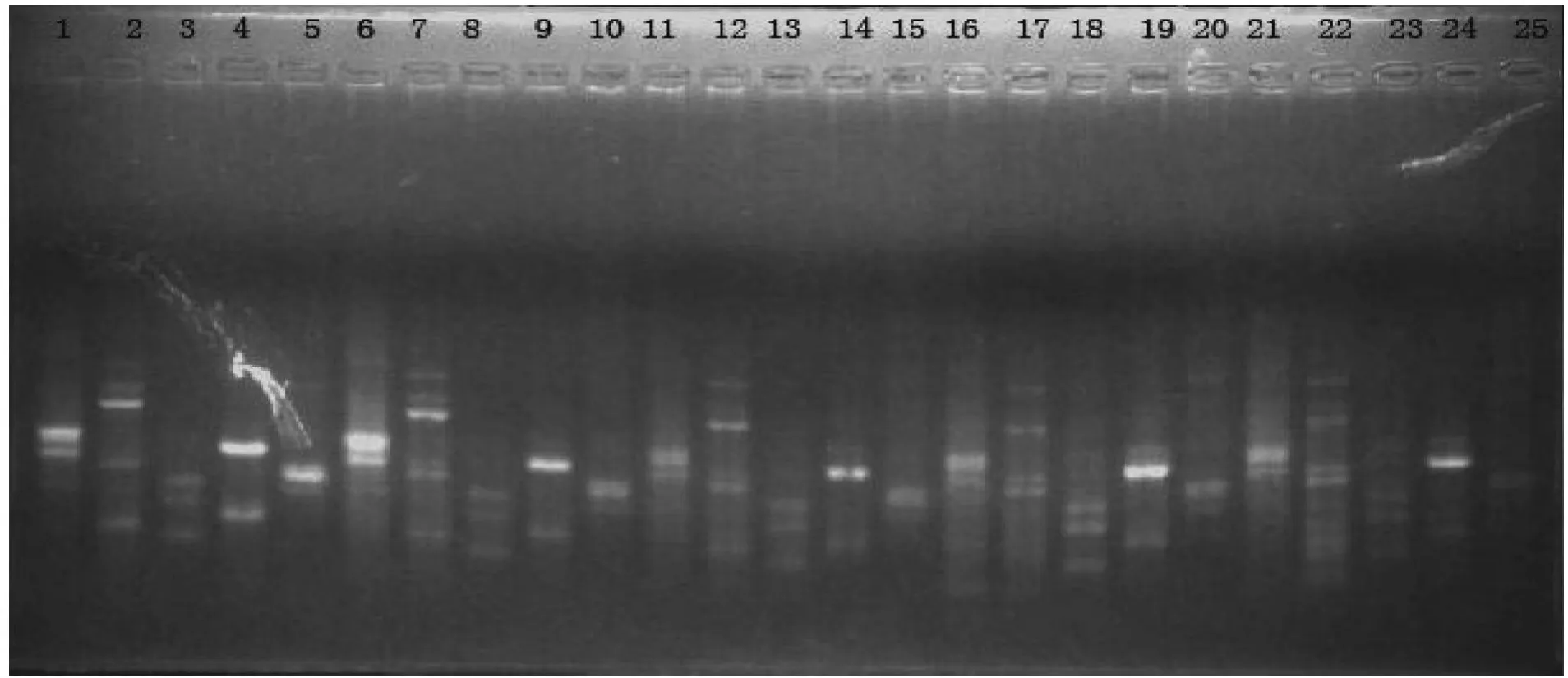
图3 Mg2+浓度对ISSR扩增的影响
2.4 模板DNA浓度对ISSR-PCR反应的影响 图4表明,模板DNA浓度对台兰ISSR-PCR扩增效果有一定的影响。台兰ISSR反应对模板DNA浓度不甚敏感,模板含量许可范围较大。在25μl反应体系中,除了浓度400 ng几乎没有扩增条带,浓度在40~200 ng均能获得比较清晰的谱带,但在100 ng时扩增出的条带最多且清晰,又考虑到结果的稳定性和可重复性,因此选用100 ng作为适宜的模板浓度。同时对引物18249、18270、18315、18320 和18333 进行筛选,选出效果较好的引物为18249和18315。

图2 dNTPs浓度对ISSR扩增的影响
2.5 台兰优化体系的建立 通过对以上各种影响因素的分析优化,建立了反应稳定、重复性好的台兰ISSR-PCR反应体系:在25 μl反应体系中含 2.5 μl 10 ×buffer,0.5 mmol/L dNTPs,2.0mmol/LMgCl2,0.4 μmol/L 引物,0.22 U Taq DNA聚合酶,100 ng模板DNA,双蒸水15.78μl。PCR扩增程序:94℃预变性5min;94℃变性30 s,50~60℃退火(退火温度随引物不同而定,根据各引物的Tm值略低1~2℃)30 s,72℃延伸50 s,40个循环;72℃延伸7 min,4℃保存。
为了检测优化的效果,试验利用建立的优化体系,选用UBC822引物,在复性温度为50℃条件下,对12个筛选的引物进行批量扩增。图5表明,优化后的反应体系是比较理想的。
3 结论与讨论
3.1 ISSR反应体系主要成分对ISSR-PCR反应稳定性的影响 ISSR是基于PCR反应的一种分子标记技术,具有DNA用量少、操作简单、快速灵敏、成本低等优点[6],但ISSRPCR扩增反应容易受许多因素的影响,如:Taq DNA聚合酶、Mg2+浓度、dNTPs用量、DNA模板的浓度和纯度等,而且这些因素之间存在相互作用。因此,不同物种的最佳扩增条件各有不同,为确保ISSR分析结果的可靠性和重复性,获得较高的ISSR-PCR扩增谱带,提高分析的准确性,针对不同物种相应的反应体系中各种影响因子进行优化,筛选出最适宜的ISSR-PCR扩增反应条件非常重要。
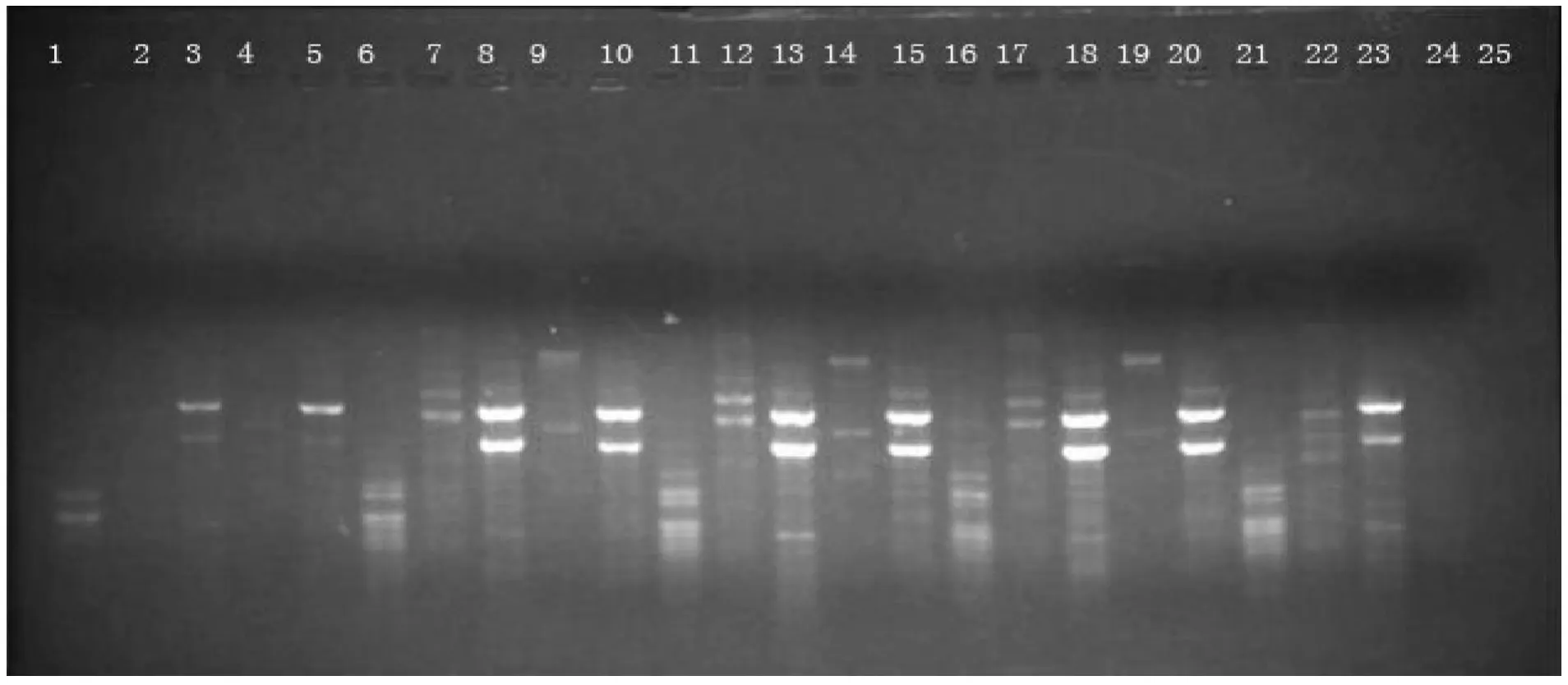
图4 模版DNA浓度对ISSR扩增的影响

图5 引物UBC822的扩增结果
在ISSR-PCR反应体系中,Taq DNA聚合酶的用量直接决定着实验的成功与否,量多不仅增加试验成本而且容易产生非特异性扩增产物;量少则会使酶过早地消耗完,产物合成效率低[7]。试验中Taq DNA聚合酶用量低于0.22 U时条带数量少且比较暗,用量多于0.22 U时条带虽然没有减少,但是出现了非特异性扩增产物,结果表明0.22 U是台兰ISSR-PCR反应的最佳条件。
dNTPs是ISSR-PCR反应的原料,通常dNTPs浓度范围为 0.02 ~0.20mmol/L[8]。dNTPs为 Taq DNA 聚合酶提供底物,使产物得以延伸。当dNTPs浓度过高,则导致Taq DNA聚合酶的错误掺入,会导致PCR错配,从而使扩增出现非特异性扩增,影响扩增的准确性;浓度过低,又会影响合成效率,甚至会因过早的消耗而使产物单链化,影响扩增效果[9]。试验中dNTPs浓度为0.3和0.4 mmol/L时,因浓度太低而扩增产物过少,浓度为0.5、0.6 和0.7mmol/L 时都有较多扩增产物,但后两者非特异性扩增相对较多,结果表明0.5 mmol/L为dNTPs最佳浓度。
Mg2+浓度是影响ISSR-PCR结果的一个重要因素,Mg2+浓度不仅影响Taq酶的活性[10],还能与反应液中的dNTPs、模板DNA及引物结合,影响引物与模板的合效率、模板与产物的解链温度以及产物的特异性和引物二聚体的形成[11]。试验中Mg2+浓度对反应无明显影响,所设置的几个浓度都有较多扩增产物,但浓度为2.0 mmol/L时条带较亮,结果表明2.0mmol/L为Mg2+最佳浓度。
DNA模板浓度也是影响ISSR-PCR扩增效果的因素之一,浓度过低,扩增产物不稳定或无扩增产物;浓度过高,又会相应增加非特异性产物的扩增。最佳的模板浓度范围取决于研究的物种和模板纯度,在DNA模板不纯的情况下,宁可使用有效浓度范围内的最低浓度,使抑制Taq DNA聚合酶的影响降到最小。试验中随着DNA模板浓度升高,扩增产物也相应增加,但同时非特异性产物也在增加,因此,考虑到稳定性和节约成本,试验采用的最佳DNA模板浓度为100 ng/L。
3.2 扩增程序对ISSR-PCR反应稳定性的影响 PCR程序设计中,重要的是复性温度的制定,引物的退火温度也极大地影响着ISSR反应的进行,由于引物碱基序列长短不同使得引物的退火温度也不尽相同。即使同一引物,在不同的植物样品中的退火温度也不一样。在同一PCR反应系统中,退火温度不同,产生错配的程度也不同,通常较低的温度在保证引物与模板结合稳定性的同时,也会使引物与模板之间为完全配对的一些位点间得到扩增,即产生一定的错误扩增[12]。因此,在允许的范围内,选择较高的退火温度可减少引物与模板之间的非特异性结合,提高PCR反应的特异性[13]。通过试验表明复性温度最好比引物TM值略低1~2℃,这个温度复性效果比较好。
PCR循环数对扩增产物量有明显的影响,选择适宜的循环次数将会获得良好的扩增图谱。从理论上说,循环次数少,产物量少;循环次数越多,扩增产物产率越高。但实际上,次数太多,达到反应平台后,循环不会使产物明显增加,反而引起非特异性扩增[14]。
[1]罗毅波,王春玲.中国兰科植物保育现状和展望[J].植物多样性,2003,11(1):70-77.
[2]CHRN SC,LUO Y B.Advances in some plant groups in China.I.A retrospect and prospect of Orchidology in China[J].Acta Botanica Sinica,2003,45(S1):2-20.
[3]杨玉玲,马祥庆,张木清.ISSR分子标记及其在树木遗传育种研究中的应用[J].亚热带农业研究,2006,2(1):18-24.
[4]张立荣,徐大庆,刘大群.SSR和ISSR分子标记及其在植物遗传育种研究中的应用[J].河北农业大学学报,2002,25(1):90-94.
[5]王建波.ISSR分子标记及其在植物遗传学研究中的应用[J].遗传,2002,24(5):613-616.
[6]陈业,张玉晶.兜兰属植物ISSR-PCR反应体系的优化[J].山地农业生物学报,2012,31(4):297-300.
[7]周俊亚,宾晓芸,彭云滔,等.罗汉果ISSR-PCR反应体系的建立[J].广西师范大学学报:自然科学版,2004,22(3):81-84.
[8]邹喻萍,葛送,王晓东.系统与进化植物学中的分子标记[M].北京:科学出版社,2001.
[9]卢圣栋.现代分子生物学技术[M].2版.北京:中国协和医科大学出版社,1999:458-463.
[10]余艳,陈海山,葛学军.简单重复序列区间ISSR引物反应条件优化与筛选[J].亚热带热带植物学报,2003,1(1):15-19.
[11]高丽,杨波.春兰ISSR-PCR反应体系的优化[J].华中农业大学学报,2006,6(3):305-309.
[12]冯夏莲,何承忠,张志毅,等.毛白杨 ISSR反应体系的建立及优化[J].北京林业大学学报,2006,28(3):61-65.
[13]LU SD.Current protocols formolecular biology[M].2nd ed.Beijing:Peking Union Medical College Press,1999:458-463.
[14]张志红,谈月笑,何航航,等.红树植物海漆 ISSR条件的优化[J].中山大学学报:自然科学版,2004,43(2):63-66.

