简易-高盐沉淀法提取云南松针叶DNA的条件优化
袁晓慧,段安安,许玉兰,2,刘惠民*
(1.西南林业大学林学院,云南昆明650224;2.北京林业大学林木育种国家工程实验室林木花卉遗传育种教育部重点实验室,北京100083)
云南松(Pinus yunnanensis)是分布于我国西南季风影响下的亚热带山地暖性气候条件下的重要树种,具有适应性强、耐干旱瘠薄以及木材用途广泛等特点[1],是我国西南特有种,也是组成滇黔桂亚热带山地针叶林植被的主要成分之一。其面积、蓄积量分别占云南省有林地面积、蓄积量的29.2%和15.8%,在云南林业生产中占有重要的地位,对生态经济建设也具有举足轻重的作用[2]。
高质量的基因组DNA是进行云南松遗传多样性研究及其他相关分子生物学研究的前提和基础,是研究云南松种质资源、调查云南松基因多样性以及制定有效保护措施的前提。云南松针叶中含有较多的松脂(萜烯类化合物)和酚类等次生代谢产物,这些物质容易与基因组DNA形成复合物,导致高纯度的DNA的提取相对比较困难。将简易提取法所得DNA充分溶解于TE后,再经过高盐沉淀法的进一步处理,可有效去除多糖和其他次生代谢杂质,获得可满足试验要求的高质量的 DNA[3]。笔者采用正交试验设计[4],对简易-高盐沉淀法提取云南松针叶基因组DNA的提取条件进行优化,并以定性和定量检测为指标,从而得出简易-高盐沉淀法提取云南松针叶基因组DNA的最佳处理组合,以期为云南松分子水平的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 研究对象。云南松针叶,采集于云南省昆明市西南林业大学格林温室内种植的云南松新鲜幼嫩的针叶。
1.1.2 主要仪器。Beckman Avanti-30高速冷冻离心机,购自北京时代北利离心机厂;Synoptics Genegenius凝胶成像分析仪和Bio-Rad Pac-300电泳仪,购自Bio-Rad公司;微量紫外分光光度计,购自上海元析仪器有限公司。
1.1.3 主要试剂。Tris和PVP,购自Sigma公司;β -巯基乙醇,购自Amresco公司;CTAB,购自Solarbio公司;TE缓冲液,购自生工生物工程(上海)有限公司;DL2000 Marker和Loading buffer,购自TaKaRa公司;100mmol/L Tris-HCL(pH 8.0)、1.4 mmol/L NaCl、20 mmol/L、EDTA、2%CTAB、3%PVP、3%β-巯基乙醇、氯仿、异戊醇、TE缓冲液(10 mmol/L Tris-HCL,pH 8.0;0.1 mmol/L EDTA)和无水乙醇等均为国产分析纯,市售。
1.2 方法
1.2.1 材料的采集及保存。随机采集云南松当年生嫩针叶,平均分成16份,分别放入自封袋中,加入标签,挤压出自封袋内的空气,置于-20℃的冰箱中保存。
1.2.2 DNA的提取。DNA提取的因素水平表见表1,设置水浴温度、离心时间、V氯仿∶V异戊醇、NaCl浓度4 个因素,每个因素设置4个水平。提取步骤如下:①从冰箱中取出保存的云南松针叶样品,取适量针叶放入研钵中,往研钵中迅速加入液氮研磨(液氮没过针叶,一边研磨一边不断加入液氮),充分研磨至细粉末状后,迅速装入2 ml离心管中(装到1/3处);②迅速往离心管中加入50μlβ-巯基乙醇和预热(水浴温度)的DNA提取液至刻度处,充分摇匀,放入水浴锅中保温50min,期间每隔10 min摇匀1次;③将离心管放入预冷(-4℃)的超速离心机中离心;④取上清液,加入等体积的氯仿:异戊醇,充分混匀后,将离心管放入预冷(-4℃)的超速离心机中离心;⑤重复步骤“④”2次后,取上清液,加入2.5倍体积预冷(-20℃)的无水乙醇;⑥在冰箱中静置过夜后,将离心管放入预冷预冷(-4℃)的超速离心机中离心,倒掉上清液(注意不要将白色絮状物倒掉);⑦将所得沉淀用浓度70%乙醇洗涤2次,风干后溶于100μl的TE中;⑧加入适量的NaCl溶液,使溶液中NaCl的终浓度达到所定标准,然后再次用无水乙醇将DNA沉淀出来,经洗涤风干后,溶于100μl的TE缓冲液中。
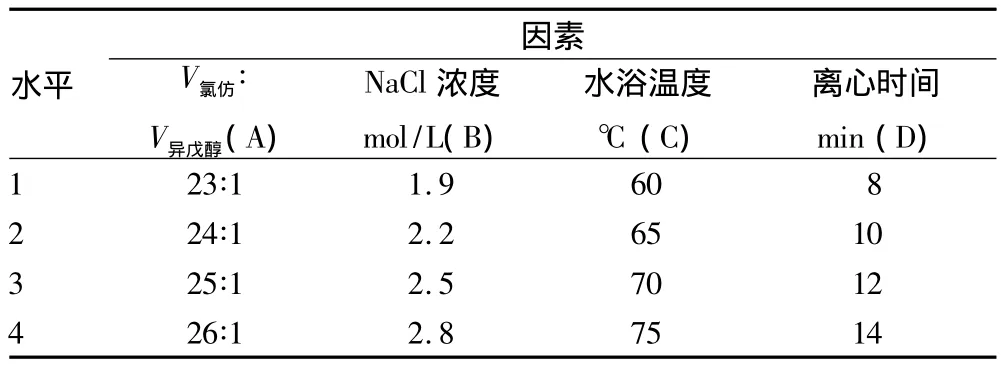
表1 DNA提取的因素和水平
1.2.3 DNA质量检测。待用TE缓冲液溶解的DNA解冻后,用浓度1%琼脂糖凝胶在120 V恒压下电泳40 min。电泳结束后在GeneGenins公司的Bio Imaging System上观测并拍照和分析。结果统计参照何正文等[5]的方法,依扩增条带的敏感性和特异性(即条带强弱及杂带的多少)计分,分数越高,表示DNA含量越高,所含杂质越少。
1.2.4 DNA的纯度和浓度检测。用微量紫外分光光度计对DNA的纯度和浓度进行检测,测定 OD260值、OD280值、OD260/OD280值,以此检测DNA的质量,计算DNA浓度,若OD260/OD280值为1.7 ~1.9,表明 DNA 杂质污染较小,纯度较好[6];若比值 >1.9,则表明存在 RNA 的污染;若比值 <1.6,则表明有蛋白质、酚类等杂质的影响[7]。
2 结果与分析
2.1 云南松针叶DNA的质量 将图1中条带的强弱及杂带的多少对16个处理组合进行打分,即条带数量丰富、清晰度高、背景低的产物记为16分,而最差的记为1分。图中1 ~16 处理组合计分分别为:13、9、14、11、12、7、9、6、7、16、7、12、5、3、11、15,并对不同因素与水平的电泳评分平均值和极差进行计算分析,结果如表3所示。极差R大小表明各因素影响程度的高低,R越大,说明该因素对结果影响越大。因此,在试验范围内,对试验指标影响最大的因素是水浴温度(C),其次是离心时间(D),再是 V氯仿∶V异戊醇(A),最后是NaCl浓度(B)。根据k值确定各因素的最优水平组合为:C3D1A3B3和 C3D1A3B4(表2)。
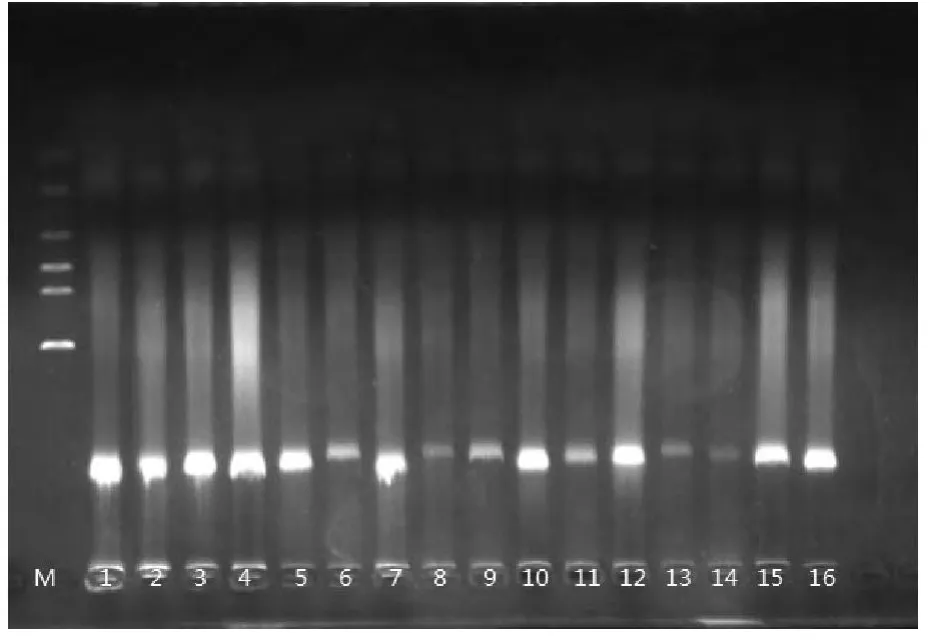
图1 云南松针叶DNA电泳检测结果
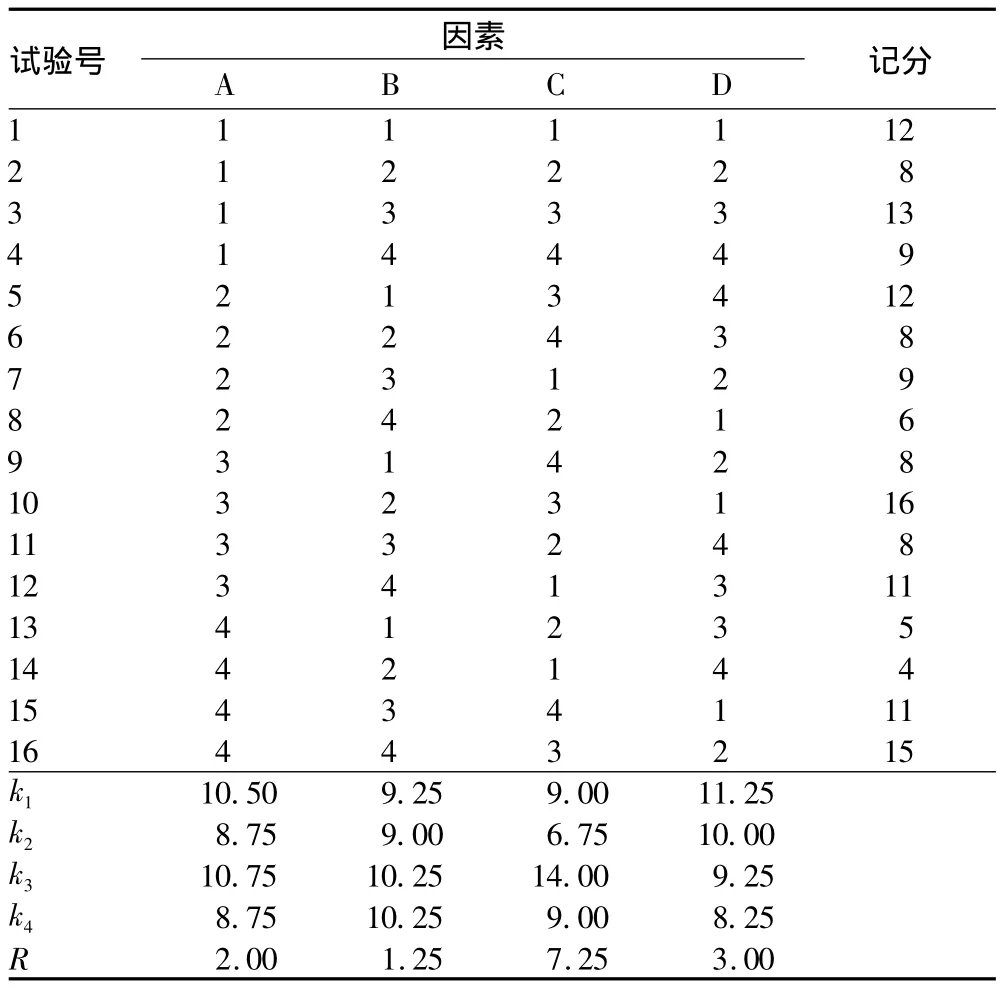
表2 正交试验极差分析表
2.2 云南松针叶DNA的纯度和浓度测定 用微量紫外分光光度计对DNA的浓度与纯度进行检测。由表3可知,处理组合10(C3D1A3B2)为最佳处理组合,所得DNA杂质污染较小,纯度较好;其次是处理组合16(C3D2A4B4)。
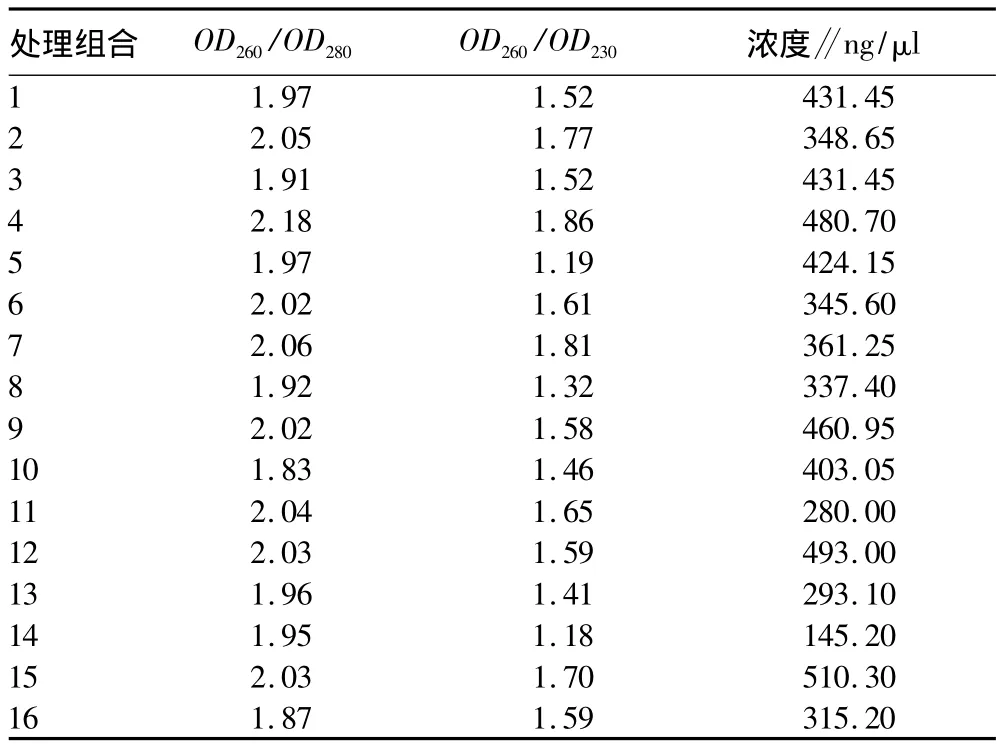
表4 云南松针叶DNA的纯度和浓度
3 结论与讨论
提取高质量的DNA是现代生物技术研究中分子生物学试验的第一步,也是关键的一步[8],虽然采用试剂盒提取比较快捷,但价格昂贵[9]。正交设计筛选具有正交的均衡分散、综合可比及可伸缩、效应明确等特性,在减少试验规模的同时又不损失信息,能快速找到最优组合,同时可分析不同因素对试验结果的影响程度[10-11]。正交试验设计对于多因素、多水平的试验具有简便、节省试验单元且统计效率高等特点。
根据极差分析的结果,在试验范围内,对试验指标影响最大的因素是水浴温度(C),其次是离心时间(D),再其次是V氯仿∶V异戊醇(A),最后是 NaCl浓度(B),最佳处理组合为:C3D1A3B3和C3D1A3B4。
根据对浓度1%琼脂糖凝胶电泳检测的结果打分,结合用微量紫外分光光度计对DNA的浓度与纯度进行检测的结果,处理组合10(C3D1A3B2)、组合16(C3D2A4B4)所提DNA量大、污染少,其中以处理组合10(C3D1A3B2)最佳,这与极差分析的结果基本一致。大多数处理组合所提DNA溶液的OD260/OD280值大于1.9,表明存在RNA的污染。所以,在以后的研究中可以考虑加入RNnase,去除RNA,这样,所得的DNA不仅量大而且所含杂质少,有利于后续研究。
[1]中国科学院中国植物志编辑委员会.中国植物志(第7卷)[M].北京:科学出版社,1978:255-259.
[2]金振洲,彭鉴.云南松[M].昆明:云南科技出版社,2004:6 -332.
[3]吴丽圆.4种思茅松总DNA提取方法比较[J].福建林学院学报,2004,24(3):237 -240.
[4]袁志发,周静芋.试验设计与分析[M].北京:高等教育出版社,2000:467.
[5]何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4):403 -404.
[6]周诗捷,曹福祥.华南五针松成熟针叶基因组DNA的提取方法[J].中南林业科技大学学报,2010,30(5):97 -100.
[7]闫庆祥,黄东益,李开棉,等.利用改良CTAB法提取木薯基因组DNA[J].中国农学通报,2010,26(4):30 -32.
[8]马明,杨克强,郭起荣.改良CTAB法提取林木树种基因组DNA的研究[J].生物技术,2007,17(3):36 -38.
[9]黄真池,余秋梅,欧阳乐军,等.一种木本植物RNA和DNA的简捷提取方法[J].湖北农业科学,2010,49(4):773 -774.
[10]杨传平,王艳敏,魏志刚.利用正交设计优化白桦的SSR-PCR反应体系[J].东北林业大学学报,2006,34(6):1 -3.
[11]续九如,黄智慧.林业试验设计[M].北京:中国林业出版社,1998:65-79.

