ERAP1 基因标准品质粒的构建
冯燕艳 吴卫东 普雄明
ERAP1 内质网氨基肽酶(endoplasmic reticulum aminopeptidase,ERAP)又名与抗原递呈相关的内质网氨肽酶,分布于细胞表面和内质网,具有复杂多样的生物学功能,如参与血管形成、蛋白水解、抗原加工和递呈,调节天然免疫反应、抗细菌等。人类基因组中有2 个高度同源的ERAP 基因,分别编号为ERAP1 和ERAP2。研究发现ERAPl 参与许多恶性肿瘤的发生、发展及浸润转移过程[1,2]。目前研究发现ERAP1 基因与强制性脊柱炎和银屑病发病相关,但对其作用机制和调控机制尚缺乏深入研究[3,4]。
实时荧光定量PCR 是目前进行核酸定量检测较为准确的方法,可检测组织中mRNA 含量,标准品的制备是实时荧光PCR 进行定量的基础。考虑到标准品的稳定性,把目的片段重组至质粒中得到稳定的重组质粒,是制备荧光定量PCR 标准品的一种策略。本研究采用T-A 克隆法成功构建了用于ERAP1 基因实时荧光定量PCR 检测的标准质粒。
材料与方法
1.实验材料:手术切取人类皮肤约30g。通过GenBank 报道的人ERAP1 基因序列,使用Oligo 6.0 结合Primier 5.0 引物设计软件进行引物设计。目的片段大小为120bp,由上海生工生物工程有限公司合成,上游引物(P1):5' -ACAGATGGTGTAAAAGGGATGG - 3,下游引物(P2):5' - GCAGTGTCCAAGTGTTCATCAT-3'。pMDl9 -T 载体购自宝生物有限公司。pMDl9 -T 载体购自宝生物有限公司。大肠杆菌DH5α、琼脂糖凝胶DNA 片段回收纯化试剂盒、质粒DNA 纯化试剂盒购自北京天根生化科技有限公司。Real - time PCR 试剂盒、SYBR Green Ⅰ试剂购自QIAGEN 公司。
2.实验方法:(1)使用异氰酸胍、三氯甲烷抽提法提取人皮肤组织总RNA:将约30g 皮肤组织中加入液氮中研磨,尽量磨碎,加入1ml TRNzol,15 ~30℃静置5min,4℃13000r/min离心10min,吸上清于一新管中,加入200μl 氯仿,上下颠倒剧烈振荡15s,15 ~30℃静置2 ~3min,4℃13000r/min 离心15min,将上清液小心转移到Rnase -free 的1.5ml 离心管中,加入等体积的异丙醇,混合均匀。15 ~30℃静置10min,4℃12000r/min 离心10min。弃去上清,1000μl 70%的乙醇洗涤1次沉淀,4℃7500r/min 离心5min,倒掉液体,静置干燥,待乙醇挥发干净,加30μl ddH2O 水,反复吹打溶解,-70℃保存。得到的总RNA 使用核酸蛋白分析仪定纯度和浓度。1%琼脂糖电泳检测后,可见28S、18S、5.8S 条带,RNA 纯度在1.80 以上,总RNA 质量符合要求。(2)反转录合成cDNA:反转录反应使用TAKARA 公司AMV 反转录酶按40μl 体系进行反转录,使用QIAquick PCR Purification Kit 进行cDNA 的纯化。(3)PCR 扩增目的基因:以所提取并纯化的cDNA,进行普通PCR,扩增出标准DNA 片段。配置25μl 反应体系进行PCR反应,PCR 反应条件为:94℃预变性3min,94℃变性30s,60℃退火30s,72℃延伸30s,35 次循环,72℃延伸5min。对PCR 产物2%琼脂糖电泳,对目的片段进行切胶回收。(4)重组质粒pMD19 -T Vector -GAPDH 的转化、筛选及鉴定:将胶回收产物以1∶3 比例由T4DNA 连接酶连接到pMD19 -T Vector,将连接产物转化入DH5α 感受态细胞中,涂布在含X -GAL 和IPTG 的氨苄青霉素平板中。37℃过夜培养,约14h 后菌落形成,挑选白色菌落,进行菌落PCR 检测,检测阳性者,加入有5ml 氨苄LB 培养基的15ml 离心管中,于37℃摇床中震摇培养12 ~16 h,收集菌液送上海生工进行测序,Chromas 软件分析测序结果。(5)质粒提取及酶切:测序正确菌液提取质粒,使用Promega 公司的Wizard Plus SV Minipres DNA Purification System 的试剂盒提取质粒,以BamHⅠ进行过夜酶切使其线性化,酶切产物用DNA 纯化回收试剂盒进行纯化。测A260 和A280 以分析纯度,并计算原始拷贝浓度。(6)Real-time PCR标准曲线的建立:1)梯度浓度标准品质粒溶液的准备:通过公式计算回收纯化产物(DNA)原液的拷贝数。计算公式如下:DNA 拷贝数(copies/μl)=C ×10-9×6.02 ×1023/M ×660,其中C 为质粒DNA 的质量浓度(ng/μl),M 为质粒DNA 的碱基对数(空载体碱基对数+ 插入目的片段碱基对数),6.02 ×1023为阿佛加德罗常数。将重组质粒标准品原液进行10 倍倍比稀释成108~104copies/μl 梯度数量级的标准品,进行Real-time PCR 扩增。2)荧光定量PCR 测标准曲线:检测使用QuantiTect SYBR GEEN 试剂(Qiagen)进行real - time PCR(Light Cycler 2.0,Roche)生成ERAP1 基因的标准曲线。Real-time PCR 反应体系:SYBR Green 荧光染料10μl,上下游引物各0.5μl,质粒DNA 2μl,ddH2O 7μl;反应条件:Denaturation 95℃5min;Amplification 95℃30s,55℃30s,72℃30s,45 个循环;Melting curve 95℃1s,40℃1s。
结 果
1.总RNA 的提取与检测:琼脂糖凝胶电泳检查提取的总RNA,其条带清晰,1% 琼脂糖凝胶电泳100 伏15min 电泳结果见图1。
2.DNA 片段普通PCR 产物电泳:以cDNA 为模板进行普通PCR,ERAP1 基因PCR 产物电泳图见图2。
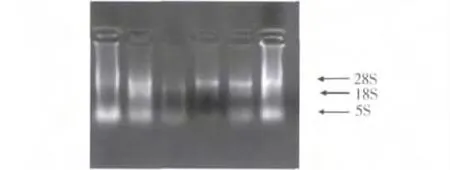
图1 RNA 电泳图
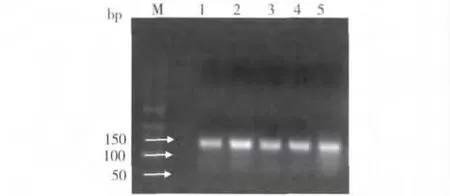
图2 ERAP1 基因PCR 产物2%琼脂糖凝胶电泳图
3.酶切质粒电泳:提取的质粒需要经过酶切线形化后,才能进行梯度稀释进行标准曲线的生成。酶切线形化质粒电泳结果如图3。
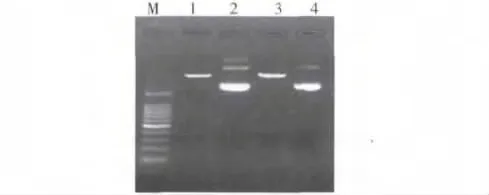
图3 PUC18 -ERAP1 重组质粒双酶切鉴定
4.重组质粒的测序鉴定:重组质粒酶切片段测序,将测序结果与GenBank 提供的序列比较,结果完全重合,表明重组质粒PUC18 - ERAP1 构建成功。
5.基因标准曲线图:基因标准曲线制备,不同梯度质粒1、1 ×10-1、1 ×10-2、1 ×10-3、1 ×10-4和1 ×10-5ng/μl real -time PCR 标准曲线图,标准曲线图由软件自动生成,结果见图4。real -time PCR 构建的标准曲线(图4)斜率达-3.935,灵敏度达1.0 ×104拷贝/毫升,线性范围为1.0 ×104~1.00 ×108拷贝/毫升,阈值循环数(Ct)与PCR 体系中起始模板量的对数值之间有着良好的线性关系(r2=0.978),扩增效率高(E =89.916%)。经过熔解曲线测定,其Tm 值为78.65℃,主峰位置重叠(图5)。
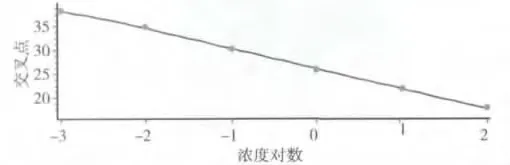
图4 ERAP1 基因扩增曲线图
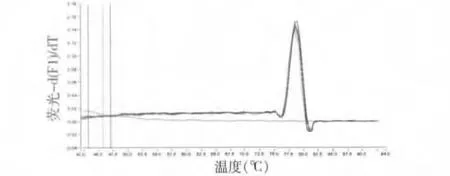
图5 ERAP1 基因熔解曲线
讨 论
本实验以从人类皮肤中提取全基因组RNA,并反转录为cDNA,用该cDNA 为模板PCR 扩增出120 bp 的片段,通过T - A 连接重组至pMD19 - T 载体中,并转化入DH5α 受体菌,经Amp+抗性筛选获得阳性克隆。经PCR 扩增、双酶切鉴定和序列分析,证明成功构建了标准品重组质粒,对质粒模板进行不同浓度梯度稀释,实时荧光定量PCR 结果分析,所获得的标准曲线具有较高的扩增效率和良好的线性关系。且PCR 产物为单一的主峰,证明该外标准品为ERAP1 序列上的特异性产物。上述结果表明,构建的重组质粒完全可以作为ERAP1 基因荧光定量检测的参照标准。
ERAP1 内质网氨基肽酶1 基因(endoplasmic reticulum aminopeptidase 1,ERAP1)又名与抗原递呈相关的内质网氨肽酶,位于5q15,属于锌指金属基质肽酶M1 家族中的“缩宫素酶亚家族”,在人类细胞均由IFN-γ 和TNF-α 诱导表达[5,6]。参与许多生化过程:在细胞内质网中参与内源性抗原肽的修饰及递呈,被认为是内质网中参与内源性抗原肽修饰的关键酶[7],参与调节血压和血管生成及细胞因子受体的脱落[8]。而来自GNF 的数据显示,ERAP1 基因mRNA 在正常皮肤组织和皮肤肿瘤组织均有表达,但表达量差别不大。
本实验所需样本为皮肤组织,由于目前常规活检手术所取皮肤组织包含部分真皮的纤维组织,研磨相对困难,故目前提取皮肤组织RNA 方法多为使用试剂盒,虽然提取过程中需要组织较少、实验要求相对偏低,但费用昂贵,笔者预实验结果显示所提取RNA含量相对较低;但本研究只需30g 新鲜皮肤组织,取材后液氮保存,随后尽量保持液氮中研磨,防止RNA降解,随后进行常规异氰酸胍、三氯甲烷抽提法提取人皮肤组织总RNA,所提取的基因组RNA 浓度、纯度也能达到反转录标准,反转录后DNA 片段作为PCR 模板,也能获得预期效果。荧光染料的优势在于它能监测任何dsDNA 序列的扩增,不需要探针的设计,使检测方法变得简便,同时也降低了检测的成本。本研究过程中已获得了优化的实时定量PCR 反应程序,为继续开展ERAP1mRNA 检测创造了良好的条件,为今后针对性检测不同来源、不同病种ERAP1 的RNA 含量,并为进一步进行功能研究打下了一定基础。
1 Fruci D,Giacomini P,Nicotra MR,et al. Altered expression of endoplasmic reticulum aminopeptidases ERAP1 and ERAP2 in transformed non-lymphoid human tissues[J]. Cell Physiol,2008,216(3):742 -749
2 Liu B,Li DR,Ni P,et al. Expression and significance of differentially expressed protein endoplasmic reticulum aminopeptidase 1 in ovarian carcinoma with lymph node metastasis[J]. Zhonghua Fu Chan Ke Za Zhi,2010,45(1):41 -44
3 Sun LD,Cheng H,Wang ZX,et al. Association analyses identify six new psoriasis susceptibility loci in the Chinese population[J]. Nat Genet,2010,42(12):1005 -1009
4 Stuart PE,Nair RP,Ellinghaus E,et al. Genome -wide asso - ciation analysis identifies three psoriasis susceptibility loci[J]. Nat Genet,2010,41(12):1000 -1004
5 Tsujimoto M,Hattori A. The oxytocinase subfamily of M1 aminopeptidases[J]. Biochim Biophys Acta,2005,1751:9 -18
6 Forloni M,Albini S,Limongi MZ,et al. NF-kappaB,and not MYCN,regulates MHC class I and endoplasmic reticulum aminopepti -dases in human neuroblastoma cells[J]. Cancer Res,2010,70:916 -924
7 Saveanu L,Carroll O,Lindo V,et al. Concerted peptide trimming by human ERAP1 and ERAP2 aminopeptidase complexes in the endoplasmic reticulum[J]. Nat Immunol,2005,6:689 -697
8 Yamamoto N,Nakayama J,Yamakawa-Kobayashi K. Identification of 33 polymorphisms in the adipocyte - derived leucine aminopeptidase(ALAP)gene and possible association with hypertension[J]. Hum Mutat,2002,19:251 -257

