siRNA 沉默PACE4 基因对乳腺癌MCF-7 细胞生物学行为的作用
王菲菲 王 林 潘继红
乳腺癌发生率自20 世纪70 年代末开始一直呈上升趋势。在我国,近年来由于人们生活方式、生活环境的改变,乳腺癌发生率的增长速度也迅速上升。迄今为止,乳腺癌的病因还未完全清楚,但是发病具有一定的规律性,其中许多研究表明,乳腺癌的发生与某些特定的基因密不可分[1,2]。近年来研究发现,蛋白原转化酶家族与癌症的关系密切,其中furin 和PACE4 尤为重要,二者在肿瘤的增殖、迁移等过程中均发挥着重要的作用[3]。Cheng 等[4]已经证实,与正常组织相比,PACE4 在乳腺癌中呈过表达。因此,本实验借助RNA 干扰技术,以化学合成的siRNA 瞬时转染人的乳腺癌MCF-7 细胞,通过qRT-PCR 以及Western blot 检测基因沉默效率,筛选出特异性的siRNA,采用体外培养的方法观察其对MCF -7 细胞的增殖能力和迁移能力以及细胞周期的影响。
材料与方法
1.试剂与材料:HiPerFect 转染试剂(QIAGEN,德国),胎牛血清(Hyclone,美国),DMEM 培养基(Hyclone,美国),兔抗人多克隆抗体ab39877(Abcom,美国),RNA 提取试剂盒(OMEGA,美国),反转录试剂盒(TOYOBO,日本),实时荧光定量PCR 试剂(Roche,德国),3 -(4,5 -二甲基噻唑-2)-2 -二苯基四氮唑溴盐、DMSO 均购自索莱宝公司,siRNA 和PACE4引物由上海吉玛设计合成,人乳腺癌MCF -7 细胞株购自中科院上海细胞库。
2.细胞的瞬时转染:细胞培养于含10% 胎牛血清的DMEM 中,正常培养至80%融合时,加入胰酶消化,以3.0 ×105接种于24 孔板,按照HiPerFect 转染试剂的说明书进行瞬时转染,在24h 和36h 收集细胞。细胞分组:①siRNA-1 oligo干扰(1 -siPACE4)组;②siRNA -2 oligo 干扰(2 -siPACE4)组;③NC 组(阴性对照组);④MOCK 组(转染试剂对照组)。
3.实时荧光定量PCR:采用RNA 提取试剂盒提取细胞RNA,按照反转录试剂盒的方法将RNA 反转录成cDNA,以cDNA 为模板进行PCR 扩增。Human GAPDH 作为内参,进行标准化。反应条件为:95℃预变性5min,95℃变性10s,60℃退火10s,72℃延伸10s,反应40 个循环。以CT 法比较表达含量的表达变化。同时,产物进行琼脂糖凝胶电泳,进一步验证定量结果。实验重复3 次。其中PACE4 引物设计:5' - AAGCAAGGGAAGTTGAAAGA-3'(上游引物),5' - CACTGAAGGTGTGGTACG-3'(下游引物),GAPDH 引物设计:5' -CACCATCTTCCAGGAGC - 3' (上游引物),5' - AGTGGACTCCACGACGTA-3'(下游引物)。
4.蛋白水平检测:采用Western blot 方法检测:取转染后细胞提取蛋白,利用Bradford 方法对蛋白定量,采用湿法转膜将蛋白转到PVDF 膜上,脱脂奶粉封闭洗脱1h,加入兔抗人-PACE4 多克隆抗体,4℃过夜,洗膜后,加入二抗37℃孵育1h,增强型化学发光试剂(ECL)显影、定影。
5.MTT 法检测细胞增殖:细胞以3.0 ×104接种于96 孔板上,瞬时转染,设置对照组,每组设置3 个重复孔,分别在转染后24、36、48h 加入20μl MTT,避光培养4h 后吸出培养基MTT 混合物,加入150μl DMSO,室温摇床放置10min,酶标仪上测定各孔A 值。
6.细胞迁移试验:将处于对数生长期的细胞以8.0 ×104接种于24 孔板,细胞融合达到80%时,采用20μl 枪头在孔中划3 条平行线,用PBS 漂洗2 次去除划下的悬浮细胞,瞬时转染,继续培养36h 后,倒置显微镜下分别观察0h 和36h 时划痕中细胞迁移情况。显微镜下任取5 个视野对进入划痕中的细胞计数。实验重复3 次。
7.流式细胞仪检测细胞周期:将处于对数生长期的细胞以1.0 ×106接种于6 孔板,干扰过程同前。设置干扰组,阴性对照组和转染试剂组。干扰24h 和36h 后按照周期试剂盒测定,使用BD 流式细胞仪,分析软件,重复3 次试验。
8.统计学方法:应用SPSS 17.0 统计分析软件,结果以均数±标准差(±s)表示,多样本间比较采用单因素方差分析,P <0.05 为差异有统计学意义。
结 果
1.siRNA 基因沉默对PACE4 基因的影响:(1)mRNA 水平:通过荧光定量PCR 对PACE4 的表达进行检测,与对照组相比,PACE4 基因的2 -siRNA 的mRNA 在36h 抑制效果最明显(图1,P <0.01)。将36h 的qRT-PCR 结果进行琼脂糖凝胶,结果如图2,与上述结果一致。(2)蛋白水平:通过Western blot检测转染后PACE4 蛋白在MCF -7 细胞中的表达,结果显示,在36h 时2 -siRNA 蛋白水平与对照组相比表达明显降低,抑制效果最明显,如图3、图4,此结果也与实时荧光定量PCR 结果一致。
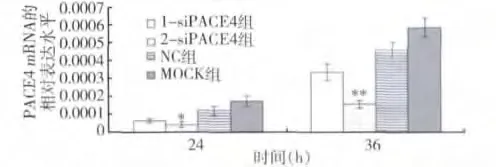
图1 siRNA 转染MCF-7 细胞PACE4 mRNA 在24h 及36h 的相对表达水平

图2 琼脂糖凝胶电泳验证siRNA 转染乳腺癌MCF-7 细胞36h 时的PCR 结果

图3 siRNA 转染MCF-7 细胞24h 蛋白表达量
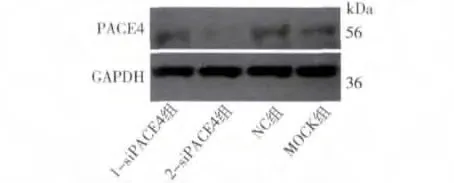
图4 siRNA 转染MCF-7 细胞36h 蛋白表达量
2.MTT 法检测siRNA 对乳腺癌MCF -7 细胞增殖能力的影响:结果表明在转染24、36和48h后,细胞的增殖速度与对照组相比明显降低,且差距具有统计学意义(图5,P <0.05),结果也表明2 -siRNA在36h 的抑制效果最明显。故挑选2 -siRNA 继续进行以下实验。
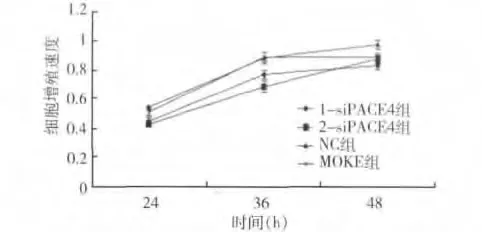
图5 MTT 方法检测siRNA 沉默PACE4 的表达对乳腺癌MCF-7 细胞增殖的影响
3.PACE4 siRNA 对MCF -7 细胞迁移能力的影响:采用细胞划痕的方法对细胞迁移能力进行检测,结果表明,在转染36h 后,与0h 相比,沉默组细胞进入划痕的细胞数明显少于对照组,任取5 个视野对进入划痕的细胞进行计数比较发现,处理组与对照组间差距具有统计学意义(图6、图7,P <0.05)。
4.PACE4 siRNA 对MCF-7 细胞周期的影响:利用流式细胞仪测定沉默PACE4 后对MCF -7 的作用,结果表明在24h 和36h,PACE4 的沉默对细胞周期的影响没有统计学意义,如图8 中A、B 所示。
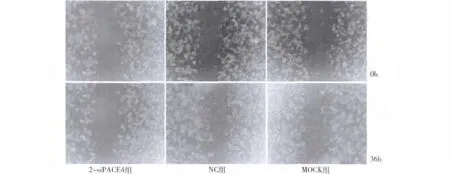
图6 细胞划痕检测siRNA 沉默PACE4 对乳腺癌MCF-7 细胞迁移能力的影响
讨 论
乳腺癌的发生率已经位居女性恶性肿瘤的首位。随着筛查工作以及综合治疗的开展,乳腺癌已经成为疗效最佳的实体肿瘤之一,但是其病因的不确定性,使得对于乳腺癌的预防和治疗仍需要得到人们的重视。目前对于乳腺癌的治疗主要是放疗、化疗以及手术的方法,但是对于病患造成的伤害也是巨大的。随着基因治疗的不断发展,分子靶向治疗有望对于乳腺癌的治疗提供新的希望。目前,在肿瘤的研究中,RNA 干扰技术已经作为一种高度特异性沉默基因的方法被广泛使用[5,6]。它的使用对肿瘤的基因研究,特别是作为对基因功能和基因治疗等方面,以及体外实验的顺利进行提供了新的途径。

图7 细胞划痕实验36h 进入划痕中的细胞

图8 流式细胞仪测定siRNA 沉默PACE4 对MCF-7 细胞周期的影响
PACE4 是一种Ca2+依赖的枯草杆菌样内切蛋白酶,具有裂解偶合基本氨基酸序列的活性,其主要通过激活多种神经肽类激素、生长因子、金属蛋白酶类、膜结合蛋白及转录因子等来发挥其作用[7~10]。对肿瘤细胞的增殖、转移等起着重要作用。PACE4 在不同类型的肿瘤中表达特点不同,Bassi 等[11]发现PACE4 在皮肤癌中呈现过表达,此后他们还证明了利用PACE4 抑制剂可以明显降低癌细胞的增殖率和迁移率[12]。另外D'Anjou 等[13]发现在蛋白原转化酶家族中,只有PACE4 在前列腺癌中过表达。然而PACE4 在卵巢癌、子宫内膜癌中都呈低表达[14~16]。
近年来随着新的致病基因被不断的发现和提出,人们对于乳腺癌易感基因的研究也进入了一个新阶段[17]。本研究中利用siRNA 技术,合成靶向PACE4基因的siRNA,成功转染MCF -7 细胞。特异性沉默PACE4 的表达,研究其对乳腺癌细胞的增殖、迁移以及细胞周期的影响。结果表明PACE4 基因的沉默,可以有效地降低细胞的增殖和迁移能力,沉默组与对照组相比差距都具有统计学意义(P <0.05)。后续笔者在不同的时间采用流式细胞仪对细胞周期进行测定发现,PACE4 的沉默对于细胞周期的影响没有统计学意义,其原因为细胞是一个具有复杂功能的个体,其周期的影响涉及很多因素。
本研究初步表明,PACE4 在乳腺癌的增殖和迁移中起到了重要的作用,下调其表达可以明显抑制乳腺癌细胞的增殖和迁移,但其具体的作用机制还需进一步的研究。近来我们实验室利用基因芯片的方法对PACE4 的下游基因进行了一系列的筛查,正在努力找出在乳腺癌中与增殖和迁移相关的下游基因,对PACE4 的作用机制进一步探索。相信PACE4 有望作为乳腺癌基因治疗的一个新的靶点,为新药的开发提供一个新的依据。
1 Filippini SE,Vega A. Breast cancer genes:beyond BRCA1 and BRCA2[J]. Front Biosci (Landmark Ed),2013,18:1358 -1372
2 Kuusisto KM,Bebel A,Vihinen M,et al. Screening for BRCA1,BRCA2,CHEK2,PALB2,BRIP1,RAD50,and CDH1 mutations in high-risk Finnish BRCA1/2 -founder mutation -negative breast and/or ovarian cancer individuals[J].Breast Cancer Res,2011,13(1):R20
3 Bassi DE,Mahloogi H,Klein-Szanto AJ. The proprotein convertases furin and PACE4 play a significant role in tumor progression[J]. Mol Carcinog,2000,28(2):63 -69
4 Cheng M,Watson PH,Paterson JA,et al. Pro -protein convertase gene expression in human breast cancer[J]. Int J Cancer,1997,71(6):966 -971
5 Kanasty R,Dorkin JR,Vegas A,et al. Delivery materials for siRNA therapeutics[J]. Nat Mater,2013,12(11):967 -977
6 Bakhtiyari S,Haghani K,Basati G,et al. siRNA therapeutics in the treatment of diseases[J]. Ther Deliv,2013,4(1):45 -57
7 Nour N,Mayer G,Mort JS,et al. The cysteine-rich domain of the secreted proprotein convertases PC5A and PACE4 functions as a cell surface anchor and interacts with tissue inhibitors of metalloproteinases[J]. Mol Biol Cell,2005,16(11):5215 -5226
8 Scamuffa N,Calvo F,Chrétien M,et al. Proprotein convertases:lessons from knockouts[J]. FASEB J,2006,20(12):1954 -1963
9 Tsuji A,Kikuchi Y,Sato Y,et al. A proteomic approach reveals transient association of reticulocalbin - 3,a novel member of the CREC family,with the precursor of subtilisin-like proprotein convertase,PACE4[J]. Biochem J,2006,396(1):51 -59
10 Nagahama M,Taniguchi T,Hashimoto E,et al. Biosynthetic processing and quaternary interactions of proprotein convertase SPC4(PACE4)[J]. FEBS Lett,1998,434(1 -2):155 -159
11 Bassi DE,Lopez De Cicco R,Cenna J,et al. PACE4 expression in mouse basal keratinocytes results in basement membrane disruption and acceleration of tumor progression[J]. Cancer Res,2005,65(16):7310 -7319
12 Bassi DE,Zhang J,Cenna J,et al. Proprotein convertase inhibition results in decreased skin cell proliferation,tumorigenesis,and metastasis[J]. Neoplasia,2010,12(7):516 -526
13 D'Anjou F,Routhier S,Perreault JP,et al. Molecular validation of PACE4 as a target in prostate cancer[J]. Transl Oncol,2011,4(3):157 -172
14 Fu Y,Campbell EJ,Shepherd TG,et al. Epigenetic regulation of proprotein convertase PACE4 gene expression in human ovarian cancer cells[J]. Mol Cancer Res,2003,1(8):569 -576
15 Fu Y,Nachtigal MW. Nachtigal,Analysis of epigenetic alterations to proprotein convertase genes in disease[J].MethodsMol Biol,2011,768:231 -245
16 Singh H,Heng S,Nicholls PK,et al. Proprotein convertases in post-menopausal endometrial cancer:distinctive regulation and non -invasive diagnosis[J]. Biochem Biophys Res Commun,2012,419(4):809 -814
17 Li S,Shen D,Shao J,et al. Endocrine - therapy - resistant ESR1 variants revealed by genomic characterization of breast -cancer -derived xenografts[J]. Cell Rep,2013,4(6):1116 -1130

