AP-1 和Smad3 双功能诱骗寡核苷酸对L929 成纤维细胞增殖及纤维化介质表达的影响
亓俊华 聂 刚 徐 祥 黄 宏 刘晓萍 王晓慧 吴 梅
瘢痕形成是高等哺乳动物创伤愈合的自然结局,但瘢痕异常增生则会导致病理性瘢痕产生[1]。病理性瘢痕是创面过度修复和组织纤维化的结果,增厚的瘢痕组织不仅严重影响美观,而且后期较易发生挛缩导致组织或器官移位变形,引起不同程度的功能障碍[2]。病理性瘢痕包括增生性瘢痕和瘢痕疙瘩两种,其形成主要是由于不同原因所引起成纤维细胞的异常增殖和胶原纤维大量合成,最终导致细胞外基质中胶原成分过度沉积[4]。其中,成纤维细胞又被认为是病理性瘢痕形成的关键效应细胞[5]。对于病理性瘢痕的预防和治疗一直是临床上亟待解决的难题之一[3]。
本研究以病理性瘢痕形成和组织纤维化的关键环节为突破口,试图设计并合成可同时抑制Smad3(small mothers against decapentaplegic 3)和AP - 1(activator protein 1)两种转录因子转录活性的双功能诱骗寡核苷酸转染L929 成纤维细胞,竞争抑制活化AP-1 和Smad3 与启动子区域的结合位点结合,进而抑制了L929 成纤维细胞的生长、增殖,旨在为进一步研发并制备治疗病理性瘢痕和组织纤维化疾病的药物奠定基础。
材料与方法
1.材料:L929 成纤维细胞购自ATCC。脂质体转染试剂LipofectamineTM2000(美国Invirtogen 公司),96 孔酶联板(美国Active Motif 公司的TransAMTMTranscription factor assay kits),RPMI1640 培养基(Gibco 公司),胎牛血清(杭州四季青公司)。D-Hanks、胰酶、TGF -β1、BSA(Hyclone 公司)。Fn抗体、TGF-β1 抗体、PAI -1 抗体、c -fos 抗体、Col1α2 抗体、CTGF 抗体和β-actin 抗体、二抗(Cell Signaling 公司)。随机诱骗核苷酸序列、AP-1 阳性诱骗核苷酸序列、Smad3 阳性诱骗核苷酸序列及AP -1 和Smad3 双功能诱骗核苷酸序列由华大基因合成
2.方法:(1)诱骗寡核苷酸的设计和合成:应用美国PE公司391 型DNA 合成仪,以亚磷酰胺固相合成法合成所设计的硫代诱骗核苷酸。随机诱骗寡核苷酸序列正义链:5' -GACGCAAGCAGTAGCTATTGCTCAGTCTACCATC - 3',反 义链:5' - GATGGTAGACTGAGCAATAGCTACTGCTTGCGTC -3';AP-1 阳性对照诱骗寡核苷酸序列正义链:5' -GTGTCTGACTCATGTACTGTCTTACCTCATGTC -3',反义链:5' - GACATGAGGTAAGACAGTACATGAGTCAGACAC -3';Smad3 阳性对照诱骗寡核苷酸序列正义链:5' -GTCTGAGCCAGACATAGTGATGCAGACATACTC-3',反义链:5' - GAGTATGTCTGCATCACTATGTCTGGCTCAGAC-3';AP -1 和Smad3 双功能诱骗寡核苷酸序列正义链:5' - GAGCCAGACATGAGTCATGTCTGCATTACCTCAC - 3',反义链:5' - GTGA GGTAATGCAGACATGACTCATGTCTGGCTC-3'。以上序列全硫代修饰,由上海博亚公司合成并纯化。各对链溶于无菌TE 溶液,分别退火形成双链,4℃保存。(2)ELISA 法:提取细胞核抽提物,加入完全结合缓冲液中稀释,然后依次加入96 孔酶联板中混匀,室温孵育1h。注以3 复孔进行各种样品的检测实验分为:空白对照组、随机诱骗核酸组、AP -1 阳性诱骗核酸组、Smad阳性诱骗核酸组和双功能诱骗核酸组。以1∶500稀释度稀释c-fos 抗体或Smad3 抗体,后以100 微升/孔加入稀释的抗体,室温孵育1h;洗脱液洗涤;以1∶1000稀释度稀释羊抗兔IgG -HRP 二抗,后以100 微升/孔加入稀释的二抗,室温孵育1h;洗脱液洗涤4 次;以100 微升/孔加入底物反应液,室温孵育2~20min,待阳性对照液变深蓝色后,以100 微升/孔加入终止液终止反应;于450nm 和655nm 双波长检测OD 值,然后计算竞争抑制率,抑制百分数计算公式为:(空白对照OD-诱骗核酸OD)/空白对照OD。(3)细胞培养和转染:L929 细胞为本实验室冻存,速溶、离心、用含10%FBS 的RPMI 1640 培养基重悬,接种到培养瓶中,37℃、5%CO2细胞培养箱中培养。次日换液,取对数生长期的细胞以2 ×104接种于96 孔板上,培养12h 后更换为无血清培养基,分别按照0.6 微升/孔脂质体和终浓度为100nmol/L 的诱骗核苷酸的条件转染L929 成纤维细胞。实验分为以下几组:正常对照组、TGF -β1 对照组、随机诱骗核酸组、AP-1 阳性对照组、Smad3 阳性对照组和双功能诱骗核酸组。(4)细胞计数:96 孔板接种细胞,转染5h后更换为完全培养基,除了正常对照组外,其他组同时加入终浓度为5ng/ml TGF - β1 诱导细胞增殖,培养72h 后各取3孔,0.25%胰酶消化,制成细胞悬液,血细胞计数板计数,每孔计数6 次。(5)ATP 生物荧光法:如上所述,培养72h 后每孔加入ATP 提取液100μl,混匀后室温下放置30min,取50μl 细胞提取液于检测板中,加入荧光素-荧光素酶50μl,混匀后置于荧光分析仪进行检测,测定每孔样品的荧光值。并计算细胞生长抑制率,作为诱骗核酸抑制L929 细胞增殖的评价指标,细胞生长抑制率=(空白对照组荧光值-药物组荧光值)/空白对照组荧光值。(6)免疫印迹实验:将L929 细胞以1 ×105个/平板接种在6cm 平板中,转染5h 后更换为完全培养基,除非诱导随机诱骗核酸对照组外,其余同时加入终浓度5ng/ml 的TGF -β1 诱导细胞,在37℃、5% CO2饱和湿度培养24h;收获细胞,离心后重悬细胞,用细胞裂解液裂解细胞,抽提蛋白,并进行PAGE 电泳,用抗Fn 抗体(1∶1000)、抗TGF-β1 抗体(1∶1000)、抗PAI -1 抗体(1∶500)、抗c -fos 抗体(1∶500)、抗Col1α2 抗体(1∶1500)、抗CTGF 抗体(1∶2000)和抗β-actin 抗体(1∶2000)进行行免疫印迹实验。
结 果
1.ELISA 法检测诱骗核酸对AP -1/Smad3 与其顺式作用元件结合的竞争抑制:与随机诱骗核酸对照相比,双功能诱骗药物既能明显抑制AP -1 的DNA结合活性,又能抑制Smad3 的DNA 结合活性(P <0.01)。然而AP-1 阳性对照核酸仅能抑制AP -1的DNA 的结合活性(P <0.01),而对Smad3 的DNA结合活性则无抑制作用。于此相似,Smad3 阳性对照核酸仅能抑制Smad3 的DNA 结合活性(P <0.01),而对AP-1 的DNA 结合活性则无抑制作用(图1、图2)。
2.诱骗核苷酸对L929 细胞数量的影响:TGF -β1 处理组于正常对照组相比细胞数量有所增加,但是和随机诱骗核酸组相比没有明显的变化。与随机诱骗寡核酸相比,AP -1、Smad3 阳性对照诱骗寡核酸处理组的细胞数量都有所减少(P <0.05),其中双功能诱骗核酸组的细胞数量相较于随机诱骗核酸组降低更加明显(P <0.01),详见图3。

图1 诱骗核酸对AP-1 DNA 结合活性的抑制作用
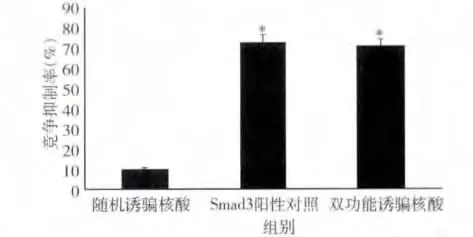
图2 诱骗核酸对Smad3 DNA 结合活性的抑制作用

图3 细胞计数检测细胞数量
3.诱骗寡核苷酸对L929 细胞增殖的影响:随机诱骗寡核酸相比,AP -1、Smad3 阳性对照诱骗寡核酸以及AP -1 和Smad3 双功能诱骗寡核苷酸均对L929 细胞的生长均有明显的抑制作用(P <0.01),其中以AP-1 和Smad3 双功能诱骗寡核苷酸的抑制作用最强(图4)。
4.诱骗核酸对L929 细胞表达纤维化介质的抑制作用:TGF - β1 能显著诱导FN、PAI - 1、c - fos、Collα2、TGF-β1、CTGF 纤维化介质的表达。与随机诱骗核酸相比,AP -1、Smad3 阳性对照诱骗寡核酸以及AP-1 和Smad3 双功能诱骗寡核苷酸均能显著降低TGF-β1 诱导L929 细胞表达这些纤维化介质的效应,其中以AP -1 和Smad3 双功能诱骗寡核苷酸的抑制作用最强(P <0.05,图5)。

图4 诱骗核酸对L929 细胞增殖抑制情况

图5 Western blot 检测L929 成纤维细胞纤维介质的表达
讨 论
Smad 信号通路和AP -1 信号通路是两条与伤口愈合、瘢痕形成和组织纤维化关系最为密切的信号通路,它们的过度活化诱导了成纤维细胞的过度增殖,最终导致病理性瘢痕的形成[6]。Smad 信号通路主要参与TGF-β 诱导的应答反应,而AP-1 是伤口愈合和瘢痕形成过程中信号放大效应的始动者,其可被TGF-β 活化,而活化的AP -1 又可上调TGF -β的表达,由此放大伤口愈合的信号[7~10]。
Decoy ODNs 指双链的脱氧寡核苷酸,转染入细胞,竞争性抑制转录因子与顺式作用元件的结合,干扰转录因子的DNA 结合活性及其后续基因的表达[11]。由于该策略具有以下优点:①潜在的药物靶点(转录因子);②诱骗ODNs 的合成相对简单且可靶向特异的组织;③不必弄清转录因子靶分子的精确分子结构;④诱骗ODNs 可阻断与同一顺式作用元件结合的多种转录因子的效应,且也可阻断同一转录因子所调控的多个靶基因的表达,其作用能力比反义ODNs 更强。因此国外众多学者一致认为该策略可作为治疗某些人类疾病的一种有效的手段。目前,有关单独靶向Smad 或者AP-1 的“诱骗”策略,已应用于探讨Smad 和AP-1 在癌症、心血管和肾脏等相关疾病中的作用机制,以及对这些疾病的治疗性研究,体外实验和动物试验结果已显示出确切的结果。
本研究以伤口愈合和瘢痕形成相关基因调控的关键环节为突破口,应用转录因子“诱骗”策略设计并合成可同时与Smad3 和AP -1 结合,并具有同时抑制两种转录因子转录活性的双功能诱骗寡核苷酸。通过ELISA 方法检测诱骗核酸对AP-1/Smad3 与其顺式作用元件结合的竞争抑制作用。与随机诱骗核酸对照相比,双功能诱骗药物既能明显抑制AP -1的DNA 结合活性,又能抑制Smad3 的DNA 结合活性,而AP-1 阳性对照核酸仅能抑制AP -1 的DNA的结合活性,对Smad3 的DNA 结合活性则无抑制作用。与此相似,Smad3 阳性对照核酸仅能抑制Smad的DNA 结合活性,而对AP-1 的DNA 结合活性则无抑制作用。说明笔者设计合成的诱骗寡核苷酸是成功的。
笔者通过脂质体介导的DNA 转染技术将AP-1和Smad3 双功能诱骗寡核苷酸和AP-1 阳性、Smad3阳性、Scramble 诱骗寡核苷酸序列导入了L929 成纤维细胞株内,通过细胞计数检测了细胞数量的变化同时也检测了转染后TGF-β1 诱导的细胞增殖率的变化,发现AP-1 和Smad3 双功能诱骗寡核苷酸和AP-1 阳性、Smad3 阳性诱骗寡核苷酸组无论是细胞数量还是细胞增殖抑制率明显高于Scramble 组,其中以AP -1 和Smad3 双功能诱骗寡核苷酸组最为明显,增殖抑制率高达70%。
在L929 成纤维细胞中持续活化的AP - 1 和Smad3 双功能诱骗寡核苷酸组和AP -1 阳性、Smad3阳性诱骗寡核苷酸组是通过下调纤维介质的表达来抑制细胞的增殖[12~15]。本实验在蛋白水平上检测了相关纤维介质的表达情况,发现转染AP-1 和Smad3双功能诱骗寡核苷酸组和AP -1 阳性、Smad3 阳性组与Scramble 组相比FN、PAI-1、c-fos、Collα2、TGF-β1、CTGF 等纤维化介质的表达均受到高效抑制,但AP-1 和Smad3 双功能诱骗寡核苷酸组的抑制作用更强。而未用TGF -β1 诱导和TGF -β1 诱导的细胞同时转染Scramble 诱骗寡核苷酸,明显的看到TGF-β1 诱导组FN、PAI -1、c -fos、Collα2、TGF -β1、CTGF 等纤维化介质的表达明显增高。通过本研究初步证实这种双功能诱骗寡核苷酸可以减少细胞数量并且可以高效抑制FN、PAI -1、c -fos、Collα2、TGF- β1、CTGF 等纤维化介质的表达,从而抑制L929 成纤维细胞的生长、增殖。
目前,同时针对Smad3 和AP -1 这两条信号通路的抑制剂国内外均未见报道。本研究应用转录因子“诱骗”策略设计并合成了Smad3 和AP-1 双重抑制剂,并证实其能高效抑制L929 成纤维细胞的生长、增殖,为进一步研发并制备高效抗病理性瘢痕和组织纤维化的药物奠定了理论基础。
1 肖刚,王智园,谭敏胡,等. 转化生长因子TGF-β1 对病理性瘢痕中成纤维细胞增殖及凋亡水平的影响[J].实用医学杂志,2008,24(13):2242 -2245
2 庞久玲,马征,刘军,等. Smad3 和转化生长因子-1 在瘢痕疙瘩、增生性瘢痕及正常皮肤中的表达:48:40:40 例标本病理检测[J]. 中国组织工程研究与临床康复,2010,14(11):1927 -1930
3 肇阅,张荣明. 病理性瘢痕治疗的研究进展[J]. 山东医药,2011,51(36):114 -115
4 Kose O,Waseem A.Keloids and hypertrophic scars:are they two different sides of the same coin?[J].Dermatol Surg,2008,34(3):336-346
5 Ranzato E,Martinotti S,Volante A,et al. Platelet lysate modulates MMP-2 and MMP-9 expression,matrix deposition and cell -to -matrix adhesion in keratinocytes and fibroblasts[J]. Exp Dermatol,2011,20(4):308 -313
6 Xia W,Kong W,Wang Z,et al. Increased CCN2 transcription in keloid fibroblasts requires cooperativity between AP-1 and SMAD binding sites[J]. Ann Surg,2007,246(5):886 -895
7 杨平,吴志宏,黄静,等. 氧化苦参碱通过TGF -β -Smad 信号通路调控人增性瘢痕成纤维细胞增殖及功能[J]. 中国美容整形外科杂志,2010,21(9):557 -559
8 Sethi A,Jain A,Zode GS,et al. Role of TGFbeta/Smad signaling in gremlin induction of human trabecular meshwork extracellular matrix proteins[J].Invest Ophthalmol Vis Sci,2011,52(8):5251 -5259
9 贾效伟,刘秉慈,叶萌,等. 活化蛋白-1 和细胞周期蛋白在石英诱导的细胞周期改变中的作用[J]. 中华劳动卫生职业病杂志,2011,29(11):812 -815
10 Jurzak M,Adamczyk K.Influence of genistein on c-Jun,c-Fos and Fos- B of AP -1 subunits expression in skin keratinocytes,fibroblasts and keloid fibroblasts cultured in vitro[J]. Acta Pol Pharm,2013,70(2):205 -213
11 徐晓云,李冬斌,李彬,等. NF -κB“诱骗”寡核苷酸对LPS 诱导的SW480 细胞IL -1β 表达的影响[J]. 疑难病杂志,2012,11(1):38 -40
12 姚恒,李世荣,刘剑毅.三七总苷对人增生性瘢痕成纤维细胞TGF-β1 和细胞周期的作用[J].中国实用美容整形外科杂志,2005,16(4):243 -245
13 程悦,王代红,张耀全,等. PTEN 编码蛋白对TGF -β1 刺激大鼠肾成纤维细胞分泌ColⅣ、FN 的抑制作用[J]. 解放军医学杂志,2007,32(7):719 -721
14 李海剑,刘章锁,刘书真,等.罗格列酮对高糖条件下大鼠肾脏成纤维细胞TGF-β1 和PAI -1 mRNA 表达的影响[J]. 郑州大学学报,2007,42(1):47 -49
15 周莹,熊丽霞,董蕙,等.白细胞介素13 对瘢痕成纤维细胞增生及转录因子c-fos 表达的影响[J].南昌大学学报,2012,52(12):23-26

