柱前衍生化HPLC法测定CHO细胞培养上清中氨基酸浓度
段须杰,任 彤
(江苏先声药业有限公司,江苏 南京210042)
由于抗体药物具有靶向明确、副作用小等优势,近年来受到国内外药企的广泛关注。2012年,全球抗体药物销售额已达650亿美元[1-2]。我国通过“新药创制”科技重大专项为生物医药产业发展提供强有力的科技支撑,同时越来越多的抗体药物面临“专利悬崖”,因此形成了抗体药物的开发热潮[3]。然而,动物细胞大规模培养工艺开发已成为国内抗体药物研发过程中的主要限制因素[4-5]。其中,动物细胞培养基优化更是为国外生物技术公司所垄断,严重制约着国内抗体药物产业化进程。氨基酸作为培养基中的重要营养物质,直接对细胞生长、抗体表达以及抗体质量有着重大影响[6]。因此,实时监测培养过程中的氨基酸浓度将为自主开发培养基产生重要的指导作用。但到目前为止,关于动物细胞培养上清中氨基酸浓度的测定却鲜有报道[7]。
按照是否衍生可将氨基酸分析方法分为直接分析法和衍生化间接分析法。然而基于离子交换色谱的氨基酸分析仪由于专属性强、价格昂贵,大大限制了其推广和应用。柱前衍生化凭借着方法灵活、灵敏度高、分析时间短等优点,近年来得到迅速发展,并已在众多领域中广泛应用[8]。6-氨基喹啉基-N-羟基琥珀酰-亚氨基甲酸酯(6-aminoquinolyl-N-hydroxysuccinimidyl carbamate,简称AQC),作为一种较新的柱前衍生化试剂,具有灵敏度高、定量准确、操作简单等优点,非常适合于复杂样品中的氨基酸分析[9-11]。作者在此首次报道了采用AQC柱前衍生化HPLC法测定CHO细胞培养上清中21种氨基酸浓度,旨为动物细胞培养基优化提供理论指导[12-15]。
1 实验
1.1 样品、试剂与仪器
所用样品均来自实际CHO细胞培养上清。
美国Waters公司AccQ.Tag氨基酸测定试剂盒:包括AccQ-FlourTM氨基酸专利衍生剂,专用氨基酸分析柱,玻璃样品衍生管,17种氨基酸混合标准溶液(氨基酸浓度均为2.5mmol·L-1)。羟脯氨酸、色氨酸、天冬酰胺,德国Applichem公司;谷氨酰胺,美国Life Technologies公司;乙腈为色谱纯。
Agilent 1260型高效液相色谱仪:包括1260Duat Pump VL四元泵、1260FLD荧光检测器、1260DAD检测器;便携式pH计,梅特勒-托利多公司。
1.2 方法
1.2.1 流动相的制备
流动相A:美国Life Technologies公司提供。配制储备液为10×,使用时用Milli-Q水将其稀释;流动相B:乙腈-水(60∶40,体积比)。
1.2.2 氨基酸标准溶液的配制
添加谷氨酰胺、天冬酰胺、色氨酸、羟脯氨酸等4种氨基酸至17种氨基酸混合标准溶液中,并控制21种氨基酸终浓度为0.2mmol·L-1。
1.2.3 CHO细胞培养上清的处理
CHO细胞培养上清成分复杂,包含多种成分(如多肽和蛋白质等)。为防止这些成分对氨基酸测定产生影响以及造成柱堵塞,需将多肽和蛋白质等物质去除[8],由于流动相中含有乙腈,因此利用乙腈将其沉淀。
为将CHO细胞培养上清中蛋白质全部沉淀,对乙腈与CHO细胞培养上清的体积比(1∶1、2∶1、3∶1和4∶1)进行了对比研究。过程如下:将CHO细胞培养上清用一定量的乙腈沉淀后,取上清,再加入等体积的乙腈,如果此时没有沉淀生成表明蛋白质已经去除完全。
1.2.4 衍生化试剂的制备和CHO细胞培养上清衍生化处理
移取衍生剂1mL至衍生化粉末中,55℃加热10min使粉末充分溶解,即得衍生化试剂。该衍生化试剂在室温干燥箱内至少可储存一周。
衍生化溶液由10μL CHO细胞培养上清、70μL硼酸缓冲溶液和20μL衍生化试剂组成。
1.2.5 色谱条件的确定
就不同pH值流动相A对色谱峰分离效果的影响进行考察。由于配制的10×流动相A储备液pH值为5.72,因此考察的pH值范围为5.8~6.0。
通过多次摸索和调整,确定适宜的梯度洗脱程序。
2 结果与讨论
2.1 CHO细胞培养上清处理结果
分别用1∶1、2∶1、3∶1、4∶1(乙腈与CHO细胞培养上清的体积比)的乙腈沉淀CHO细胞培养上清,结果发现乙腈与CHO细胞培养上清的体积比为2∶1时,蛋白质即可以去除完全,因此,用2BV乙腈与CHO细胞培养上清混合静置1h后,于10 000r·min-1离心10min,取上清用于氨基酸浓度测定。
2.2 色谱条件的确定
色谱柱:Waters AccQ.Tag氨基酸分析色谱柱C18(3.9mm×150mm,4μm);流速1mL·min-1;荧光激发波长250nm,发射波长395nm;由于色氨酸对荧光猝灭,因此采用250nm紫外检测器对其进行检测;柱温为42.5℃;进样量为5μL。
实验发现,有4对峰对pH值变化较敏感,分别为ASN/AMQ、HIS/NH4、ARG/ALA和CYS/VAL。当pH值低于5.85时,ASN/AMQ峰重合无法分开,其余3对峰随pH值变化分离度呈现不同变化规律:CYS/VAL随pH值升高分离度降低,HIS/NH4随pH值升高分离度略有上升,ARG/ALA随pH值升高分离度降低。综合考虑所有峰的分离水平,确定流动相A的pH值为5.93。
经多次摸索和调整,确定梯度洗脱程序如表1所示。

表1 梯度洗脱程序Tab.1 Gradient elution program
2.3 HPLC图谱
氨基酸标准品和样品的HPLC图谱见图1。
2.4 线性关系考察
将氨基酸终浓度为0.2mmol·L-1的标准溶液分别稀释至0.15mmol·L-1、0.10mmol·L-1、0.08 mmol·L-1、0.06mmol·L-1、0.04mmol·L-1和0.02mmol·L-1。精密量取上述不同浓度的氨基酸标准溶液5μL,按1.2.4进行衍生化处理。按色谱条件进样,记录色谱图。以摩尔数(y)对峰面积(x)作图并进行线性回归,得到21种氨基酸的回归方程及线性范围,列于表2。
由表2可看出,21种氨基酸在浓度范围内具有良好的线性关系,相关系数均大于0.99。
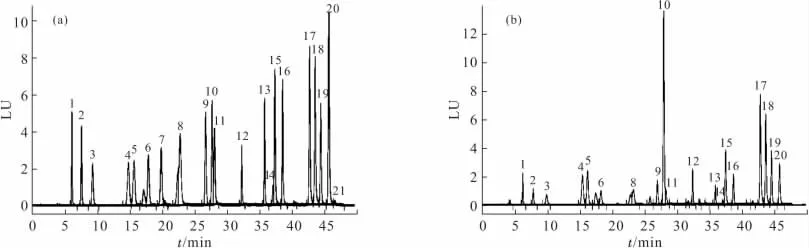
图1 氨基酸标准品(a)及样品(b)的HPLC图谱Fig.1 HPLC Chromatograms of amino acid standard(a)and sample(b)

表2 回归方程及线性范围Tab.2 Regression equations and linear ranges
2.5 精密度实验
将实际CHO细胞培养上清适当稀释以保证氨基酸浓度在检测范围内。按1.2.3进行样品处理,按1.2.4进行衍生化处理。连续进样6针,计算氨基酸出峰面积,结果见表3。
由表3可看出,各氨基酸的峰面积RSD均小于5%,说明该方法的精密度良好。
2.6 加样回收率实验
将实际CHO细胞培养上清适当稀释以保证氨基酸浓度在检测范围内。按1.2.3进行样品处理,取50μL处理后的上清,分别加入0.10mmol·L-1氨基酸标准溶液40μL、60μL和70μL。每个样品连续进样3针,计算回收率(表4)。平均回收率(n=9)为96.8%,RSD=4.93%。表明该方法可行、准确,符合氨基酸浓度测定要求。

表3 精密度实验结果(n=6)Tab.3 Results of precision experiment(n=6)
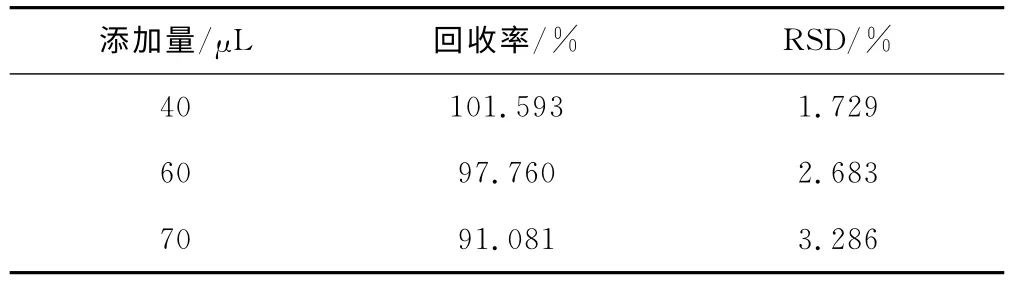
表4 回收率实验结果(n=3)Tab.4 Results of recovery experiment(n=3)
2.7 样品稳定性考察
取衍生化后的CHO细胞培养上清,在4℃进样盘中分别于0h、10h、36h和60h进样测定,记录色谱图,并计算各氨基酸浓度。结果表明:与0h测定的19种氨基酸浓度相比,10h测定的偏差在5%以内,36h测定的偏差在20%以内,60h测定的偏差在30%以内。这与衍生化溶剂乙腈随放置时间延长而挥发有关,导致测定浓度增大。为了保证测定的准确性,衍生化样品放置时间应控制在36h以内。
3 结论
首次报道了AQC柱前衍生化HPLC方法测定CHO细胞培养上清中21种氨基酸含量,并对该分析方法进行了方法学验证。结果表明,该方法线性范围较宽,相关系数均大于0.99,能够在50min内完成21种氨基酸浓度的测定。该方法经济,具有较高的灵敏度、精密度和准确度,可以满足动物细胞培养上清中氨基酸分析的要求,对后续培养基优化具有重要的指导意义。
(致谢:感谢美国Life Technologies公司在氨基酸方法建立过程中提供的技术支持!)
[1]Therapeutic monoclonal antibodies approved or in review in the European Union or United States[EB/OL].[2013-04-05].http://antibodysociety.org/news/approvedmabs.php.
[2]TOP 20best-selling drugs approved and launched during 2012[EB/OL].[2013-04-08].http://www.genengnews.com/insight-and-intelligenceand153/top-20-best-selling-drugs-approvedand-launched-during-2012/77899791/.
[3]生物谷.Biosimilar & FOB China 2011——生物仿制药高峰论坛[EB/OL].http://www.bioon.com/z/biosimilar/introduction.shtml.
[4]刘伯宁.治疗性单抗与抗体产业关键技术[J].中国生物工程杂志,2013,33(5):132-138.
[5]刘伯宁.用于重组抗体生产的细胞大规模培养技术[J].中国生物工程杂志,2013,33(7):103-111.
[6]段须杰,刘睿,徐卫涛,等.细胞培养工艺条件对抗体异质性影响的研究进展[J].生物工程学报,2013,29(12):1880-1886.
[7]陆苏飚,孙祥明,张元兴.邻苯二甲醛柱前衍生反相高效液相色谱法测定CHO细胞内氨基酸浓度[J].华东理工大学学报(自然科学版),2004,30(4):383-386.
[8]王志有,王海洋,臧娜.氨基酸分析方法的进展[J].材料导报,2005,19(11):381-382.
[9]侯松嵋,孙敬,何红波,等.AQC柱前衍生反相高效液相色谱法测定土壤中氨基酸[J].分析化学,2006,34(10):1395-1400.
[10]黄莉,吴小曼,纪宇,等.柱前衍生高效液相色谱法测定胎盘多肽注射液中的氨基酸[J].中国生化药物杂志,2012,33(4):373-376.
[11]马晓丽,孟磊,李琳琳,等.两种柱前衍生反相高效液相色谱法测定血液和尿液中游离氨基酸[J].氨基酸和生物资源,2012,34(3):19-24.
[12]王永民,陈昭烈.动物细胞无血清培养基的研究与设计方法[J].中国生物工程杂志,2007,27(1):110-114.
[13]Zhang H F,Wang H B,Liu M,et al.Rational development of a serum-free medium and fed-batch process for a GS-CHO cell line expressing recombinant antibody[J].Cytotechnology,2013,65(3):363-378.
[14]Ma N N,Ellet J,Okediadi C,et al.A single nutrient feed supports both chemically defined NSO and CHO fed-batch processes:Improved productivity and lactate metabolism[J].Biotechnol Bioeng,2009,25(5):1353-1363.
[15]Dietmair S,Hodson M P,Quek L E,et al.Metabolite profiling of CHO cells with different growth characteristics[J].Biotechnol Bioeng,2012,109(6):1404-1414.

