降解含硫杂环芳烃中度嗜盐菌的筛选及降解特性研究
李 琳,赵朝成,刘其友,张云波,王 雷
(中国石油大学(华东)化学工程学院,山东 青岛 266580)
含硫杂环芳烃(polycyclic aromatic sulfur heterocycles,PASHs)是原油中硫的主要存在形态,主要是噻吩类化合物,也包括少量带有芳基的硫醇、硫醚和二硫化物[1],属于污染面广、毒性较大的难降解有机物,广泛存在于石油污染土壤、海底沉积物、被污染的地下水及许多工业(如焦化、石油化工、农药、染料等)废水中。环境介质中的PASHs比多环芳烃(PAH)具有更强的致癌性和生物富集性,是最不易被降解的化合物之一[2-3]。
在石油的开采加工过程中,遗漏、井喷、输油管道泄漏等问题会导致油田区土壤受到PASHs的污染,对生态环境和人体健康构成严重威胁。相比物理和化学处理方法,微生物法处理PASHs污染土壤具有经济高效、无二次污染等优点,成为近年来的研究热点[4]。
我国许多油田都位于干旱和半干旱地区,如胜利油田、华北油田和新疆油田等。由于油田区特殊的气候和水环境条件,容易造成油田区土壤的盐分积累[5]。目前很多具有PASHs降解能力的细菌和真菌相继被筛选出来,但是由于油田区土壤的高盐度使得这些微生物的降解能力受到抑制。因此,筛选具有耐盐性的PASHs降解菌可能是有效的解决途径。中度嗜盐菌是一类依赖0.5~2.5 mol·L-1盐浓度生长的微生物类群,营养要求简单,对环境有很好的适应能力,在环境污染治理方面日益受到重视[6]。
作者以二苯并噻吩作为PASHs的模式化合物,从胜利油田石油污染的高盐土壤中筛选分离出6株具有PASHs降解能力的中度嗜盐菌,并考察了底物初始浓度、pH值、温度及氮磷比对降解效果的影响,通过正交实验得到其最佳培养条件,以期为深入研究中度嗜盐菌对PASHs的降解奠定基础。
1 实验
1.1 土样采集及预处理
以胜利油田石油污染土壤作为土样。取4种不同深度(0~5 cm、5~10 cm、10~15 cm、15~20 cm)的土样混合均匀,装入采集袋中。土样过2 mm筛,去除2 mm以上的沙砾和植物残体,采用四分法收集土样,于4 ℃保存备用。
1.2 培养基
无机盐培养基(g·L-1):Na2HPO40.6,KH2PO40.2,NaNO34.0,MgSO40.3,CaCl20.01,FeSO40.01,NaCl 50,酵母膏 0.5,pH值7.5。
LB培养基(g·L-1):蛋白胨10.0,酵母浸出汁5.0,NaCl 50.0,琼脂20.0(固体培养基用)。
筛选固体培养基:在固体培养基上涂一定浓度的二苯并噻吩。
富集培养基:在无机盐培养基中加入一定浓度的二苯并噻吩。
1.3 方法
1.3.1 中度嗜盐菌的筛选、分离与保藏
取5 g土样加入到含二苯并噻吩50 mg·L-1、盐度为5%的无机盐培养基(100 mL)中,于30 ℃、160 r·min-1条件下振荡培养7 d。再按15%的接种量转接至新的无机盐培养基中,如此重复5次进行驯化培养。最后将菌群富集培养液依次稀释成浓度梯度为10-3、10-4、10-5、10-6、10-7的菌悬液,然后取0.1 mL菌悬液涂布在筛选固体培养基上,倒置,于30 ℃培养12~16 h。挑选菌落周围出现清晰降解圈的菌株,转接斜面,于4 ℃冰箱保藏。观察菌株形态,并进行生理生化实验。
1.3.2 降解率的测定
将培养后的培养基用盐酸酸化至pH≤2,用乙酸乙酯等体积萃取,于3 000 r·min-1离心10 min后取上清液用气相色谱仪(Bruker 450 GC-FID)测定二苯并噻吩含量,按下式计算降解率(η):
式中:c0、ck分别为降解前后二苯并噻吩的浓度;η0为空白降解率。
色谱条件:以恒流方式进样,进样量1 μL;升温程序:柱温50 ℃保持4 min,然后以3 ℃·min-1升温至130 ℃,再以15 ℃·min-1升温至300 ℃,最后在300 ℃下保持15 min;进样器和检测器的温度均为300 ℃,载气为氦气,流速1 mL·min-1。
1.3.3 最佳培养条件的研究
针对筛选得到的降解效果最好的中度嗜盐菌,通过单因素实验考察底物初始浓度、pH值、温度、氮磷比等因素对其降解效果的影响,并在此基础上设计pH值、温度及氮磷比的3因素3水平正交实验,确定其最佳培养条件。
2 结果与讨论
2.1 降解二苯并噻吩中度嗜盐菌的筛选及生理生化特征
将经过5次富集驯化后的混合培养物在筛选固体培养基上稀释涂布,挑选有明显降解圈、不同颜色和形态的单菌落,经过复筛、纯化后得到6株能够以二苯并噻吩为唯一碳源和能源生长的中度嗜盐菌,其中菌株SL-4对二苯并噻吩的降解率最高(37.2%),如图1所示。
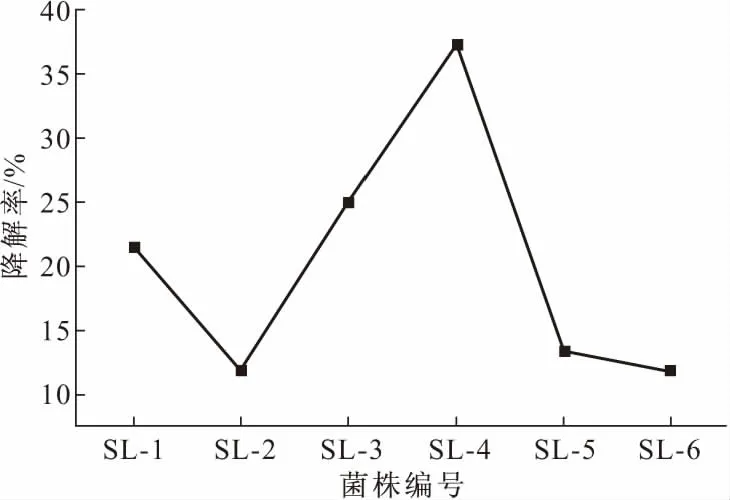
图1 筛选菌株的降解率Fig.1 The degradation rate of the strains screened
对筛选得到的6株具有降解能力的中度嗜盐菌进行形态观察和生理生化实验,结果如表1所示。
表1筛选菌株的形态特征及生理生化特征
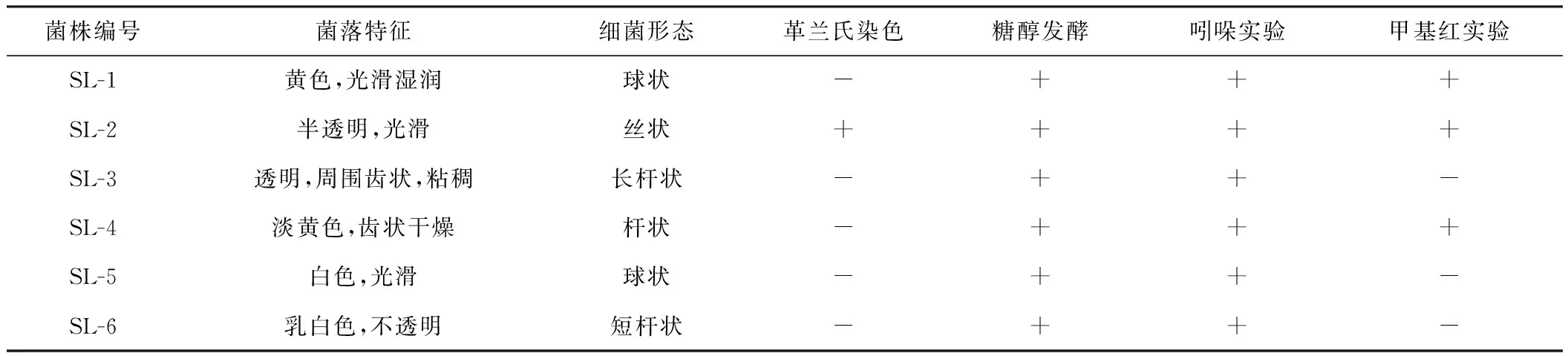
Tab.1 The morphological,physiological and biochemical characteristics of the strains screened
注:“+”表示阳性,“-”表示阴性。
2.2 底物初始浓度对SL-4菌株降解效果的影响(图2)

图2 底物初始浓度对SL-4菌株降解二苯并噻吩的影响Fig.2 The effect of initial substrate concentration on degradation of dibenzothiophene by strain SL-4
由图2可知,SL-4菌株在以二苯并噻吩为唯一碳源的含盐(NaCl 5%)培养基中可以降解不同浓度的二苯并噻吩,其降解率随底物初始浓度的增大先升高后降低,当底物初始浓度为100 mg·L-1时,降解效果最好,降解率达到56.4%。原因可能是低浓度的底物满足不了微生物的生长需要,不利于维持降解所必需的微生物量,而高浓度的底物又对微生物有一定的毒害作用,不利于微生物的生长代谢,同时降解产生的代谢产物也会抑制底物的降解[7]。
2.3 pH值对SL-4菌株降解效果的影响
培养基盐度为5%,pH值对SL-4菌株降解二苯并噻吩效果的影响如图3所示。

图3 pH值对SL-4菌株降解二苯并噻吩的影响Fig.3 The effect of pH value on degradation of dibenzothiophene by strain SL-4
由图3可知,SL-4菌株在pH值为5.5~9.5范围内均能降解二苯并噻吩,但pH值对降解效果影响较大,SL-4菌株的最适pH值为7.5。原因可能是pH值会改变微生物细胞的表面电荷,从而影响微生物对营养物质的吸收[8-9]。相对于酸性环境,偏碱性(7.5~8.5)的环境更适于SL-4菌株的生长。
2.4 温度对SL-4菌株降解效果的影响
微生物的生长代谢是在酶的催化作用下进行的,适宜的温度是保证酶活性的重要条件之一[10]。温度对SL-4菌株降解二苯并噻吩效果的影响如图4所示。

图4 温度对SL-4菌株降解二苯并噻吩的影响Fig.4 The effect of temperature on degradation ofdibenzothiophene by strain SL-4
由图4可知,SL-4菌株在25~45 ℃范围内均能降解二苯并噻吩。随着温度的升高,SL-4菌株对二苯并噻吩的降解率先升高后降低,在温度为30 ℃时,降解率最高。原因可能是温度过高时SL-4菌株的活性降低,降解效果变差。
2.5 氮磷比对SL-4菌株降解效果的影响
微生物的生长受到氮磷营养盐浓度的影响,而氮、磷的影响往往是相互的,所以在实际生物修复污染物的过程中,应当投加适宜比例的氮磷物质来提高降解微生物的修复效果。氮磷比对SL-4菌株降解二苯并噻吩效果的影响如图5所示。
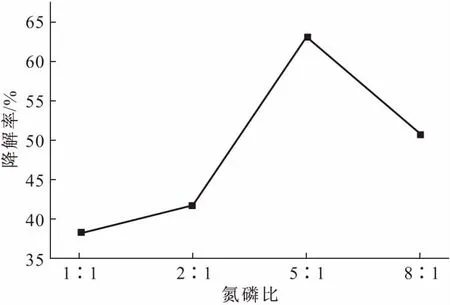
图5 氮磷比对SL-4菌株降解二苯并噻吩的影响Fig.5 The effect of N∶P on degradation ofdibenzothiophene by strain SL-4
由图5可知,当氮磷比为5∶1时,SL-4菌株对二苯并噻吩的降解效果最好,降解率达到63.2%。
2.6 正交实验结果与分析
基于单因素实验结果,以pH值、温度及氮磷比为考察因素,以二苯并噻吩的降解率为考核指标进行3因素3水平正交实验,实验结果及分析如表2所示。
表2正交实验结果及分析
Tab.2Theresultsandanalysisoforthogonalexperiment
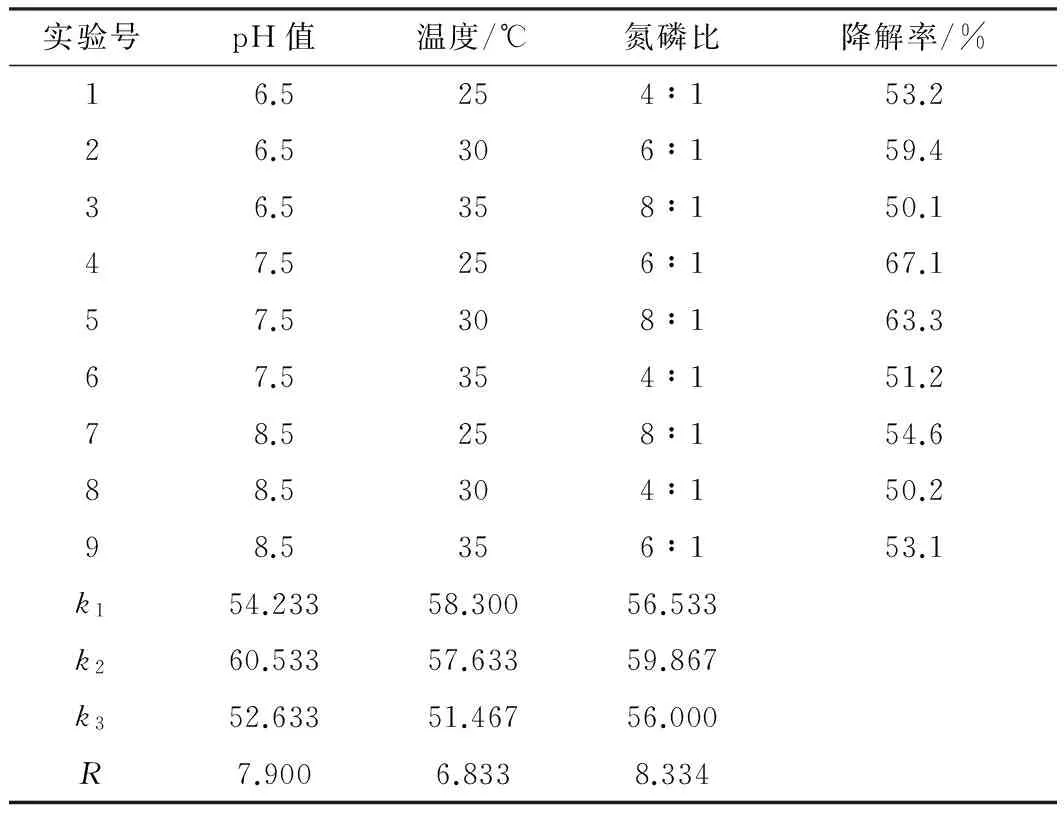
实验号pH值温度/℃氮磷比降解率/%16.5254∶153.226.5306∶159.436.5358∶150.147.5256∶167.157.5308∶163.367.5354∶151.278.5258∶154.688.5304∶150.298.5356∶153.1k154.23358.30056.533k260.53357.63359.867k352.63351.46756.000R7.9006.8338.334
由表2可知,各因素对SL-4菌株降解效果的影响大小依次为:氮磷比>pH值>温度;该中度嗜盐菌株的最佳培养条件为:pH值7.5,温度25 ℃,氮磷比6∶1。
3 结论
从胜利油田石油污染土壤中筛选得到6株对二苯并噻吩具有降解能力的中度嗜盐菌,其中SL-4菌株降解效果最好,在底物浓度为50 mg·L-1、培养基盐度为5%条件下对二苯并噻吩的降解率达到37.2%。通过单因素实验考察了底物初始浓度、pH值、温度及氮磷比对SL-4菌株降解效果的影响,正交实验结果表明氮磷比对SL-4菌株降解效果的影响最为显著,最佳培养条件为:pH值7.5、温度25 ℃、氮磷比6∶1。
[1] Mezcua M,Femandez-Alba A R,Boltes K,et al.Determination of PASHs by various analytical techniques based on gas chromatography-mass spectrometry:Application to a biodesulfurization process[J].Talanta,2008,75(5):1158-1166.
[2] Eastmond D A,Booth G M,Lee M L.Toxicity,accumulation,and elimination of polycyclic aromatic sulfur heterocycles inDaphniamagna[J].Arch Environ Contam Toxicol,1984,13(1):105-111.
[3] Kropp K G,Fedorak P M.A review of the occurrence,toxicity,and biodegradation of condensed thiophenes found in petroleum[J].Can J Microbiol,1998,44(7):605-622.
[4] Kuyukina M S,Ivshina I B,Kamenskikh T N,et al.Survival of cryogel-immobilizedRhodococcusstrains in crude oil-contaminated soil and their impact on biodegradation efficiency[J].International Biodeterioration & Biodegradation,2013,84:118-125.
[5] 贾建丽,刘莹,李广贺,等.油田区土壤石油污染特性及理化性质关系[J].化工学报,2009,60(3):726-731.
[6] 赵百锁,杨礼富,宋蕾,等.中度嗜盐菌在生物技术中的应用[J].微生物学通报,2007,34(2):359-362.
[7] Papizadeh M,Ardakani M R,Motamedi H,et al.C-S Targeted biodegradation of dibenzothiophene byStenotrophomonassp.NISOC-04[J].Appl Biochem Biotechnol,2011,165(3-4):938-948.
[8] 何良菊,李培杰,魏德洲,等.石油烃微生物降解的营养平衡及降解机理[J].环境科学,2004,25(1):91-94.
[9] 陈晓鹏,易筱筠,陶雪琴,等.石油污染土壤中芘高效降解菌群的筛选及降解特性研究[J].环境工程学报,2008,2(3):413-417.
[10] 苏荣国,牟伯中,王修林,等.微生物对石油烃的降解机理及影响因素[J].化工环保,2001,21(4):205-208.

