响应面优化超声波快速提取鳕鱼皮中胶原蛋白的工艺研究
王 希,钟耀广*,市川寿
(1.上海海洋大学食品学院,上海 201306;2.日本长崎大学水产学部,长崎 852-8043,日本)
响应面优化超声波快速提取鳕鱼皮中胶原蛋白的工艺研究
王 希1,钟耀广1*,市川寿2
(1.上海海洋大学食品学院,上海 201306;2.日本长崎大学水产学部,长崎 852-8043,日本)
以冷冻阿拉斯加深海鳕鱼皮为原料,利用响应面分析法(RSM)优化超声波快速提取胶原蛋白的工艺。根据单因素试验影响因子的分析,选取pH、提取温度、超声波提取时间作为响应面分析法中的影响因子,以胶原蛋白提取率为响应值,利用Box-Behnken中心组合试验设立建立数学模型,进行响应面分析。结果表明,最优提取工艺:pH 2.0、温度35℃、超声波辅助提取时间3.5 h、酶解时间7.5 h,胶原蛋白提取率达33.75%。
响应面;超声波;胶原蛋白;鳕鱼
胶原蛋白是占哺乳动物总蛋白20%~30%的主要结构蛋白[1]。支持和保护身体各器官,是结缔组织结构蛋白重要主体[2]。胶原分子多肽链相互缠绕成一种三螺旋结构[3]。胶原蛋白提取可使用或结合酸提取、碱提取、盐萃取、酶法提取、热水提取法提取[4]。由于传统单一方法提取时间长、效率低,本文采用超声波酶解提取法,该方法污染小、时间短,能较完整提取生物活性大分子[5]。
纯正鳕鱼指鳕属鱼类,分为大西洋鳕鱼(Ga⁃dus morhua)、格陵兰鳕鱼(Gadus ogac)和太平洋鳕鱼(Gadus macrocephalus)[6]。阿拉斯加三面环海,是全球为数不多能大量供应多种深海鱼类的产地[7]。研究利用胃蛋白酶对深海鳕鱼皮的作用,制备可溶性胶原蛋白,切去胶原肽链端肽的交联区,使酸性pH条件下胶原组织膨胀,溶解[8]。酶解鳕鱼皮胶原蛋白具有独特的保湿性能,抗氧化,减缓皮肤衰老[9]。超声波可提高提取率,促进酶活性,或者破坏酶结构,使酶失活。本研究以阿拉斯加鳕鱼鱼皮为原料,采用超声波辅助酶解条件,利用响应面分析法分析,为胶原蛋白提取与开发提供理论依据。
1 材料与方法
1.1 材料
阿拉斯加深海鳕鱼皮,购自大连市鸿运鱼皮加工厂;胃蛋白酶(1 200 U·g-1),羟脯氨酸,乙二胺四乙酸(EDTA),氯胺T,对二甲基氨基苯甲醛,均购自国药集团化学试剂有限公司,以上试剂均为分析纯(AR)。
1.2 主要仪器
THZ-82(A)气浴恒温振荡器,购自金坛市科析仪器公司;台式高速离心机,购自上海安亭科学仪器厂;紫外分光光度计,购自上海天美科学仪器有限公司;超声波仪,购自上海生析超声仪器有限公司。
1.3 方法
1.3.1 提取胶原蛋白[10]
冷冻阿拉斯加深海鳕鱼皮先解冻,浸泡在10倍体积的NaCl溶液中,置于4℃冰箱冷藏2~3 h,去除杂蛋白。取处理后鱼皮10 g,加入10 mL乳酸,0.65 mL胃蛋白酶(1 200 U·g-1)和2~3颗玻璃珠,在室温下放入超声波(180 W)中提取胶原蛋白,使蛋白酶和鱼皮充分反应[11]。一定时间后放入恒温培养箱,恒温一定时间。所得提取液在离心力560 N(10 000 r·min-1)下高速离心15 min,上层粘性液体加入NaCl至浓度2.5 mol·L-1,2 h后絮状沉淀,再次以560 N(10 000 r·min-1)高速离心15 min,得到沉淀,置于透析袋中透析,透析内外液均设为蒸馏水,用10%硝酸银检验透析外液无白色沉淀为止,将提取液进行冷冻干燥得胶原蛋白成品[12]。为确定胶原蛋白最佳提取工艺,在前期研究基础上设计以超声波提取时间、酶提取时间、酶解温度、pH为因素的正交试验。
1.3.2 绘制羟脯氨酸标准曲线
本文通过测得吸光度值,利用公式计算出胶原蛋白中羟脯氨酸含量,羟脯氨酸为胶原蛋白独有氨基酸,此方法可计算出胶原含量[13]。
先用0.01 mol·L-1盐酸溶解100 mg L-羟脯氨酸,加蒸馏水至100 mL以制备羟脯氨酸标准储存液,并于4℃冷藏贮存。再取储存液10 mL,倒入100 mL容量瓶加蒸馏水定容,由于溶液常温光照易分解,需现用现配,把标准液稀释为100 mg·L-1,得到羟脯氨酸标准工作液[14]。取8支试管,分别加标准工作液从1~4.5 mL每隔0.5 mL,之后加蒸馏水稀释至100 mL。取各浓度标准液1 mL,再加入1 mL C6H8O7及1 mL氯胺T溶液,氧化10 min,加HClO4溶液1 mL,静置10 min后置于65℃水浴锅显色反应,加入对二甲基氨基苯甲醛显色剂1 mL,水浴显色10 min后冷却,在560 nm处测量吸光度(蒸馏水为空白对照)[15]。羟脯氨酸浓度为x轴,紫外分光光度计测得吸光度为y轴绘制标准曲线,求得回归方程,见图1。

图1 羟脯氨酸标准曲线Fig.1 Standard curve of hydroxyproline
标准曲线方程:y=0.0501x+0.132,R2=0.999。
式中,x—羟脯氨酸标准液质量浓度(μg·mL-1)。
1.3.3 鳕鱼皮胶原蛋白提取液中羟脯氨酸含量的测定
将1.3.1制备的胶原蛋白提取液加至100 mL容量瓶内,再加入蒸馏水定容。取稀释后1 mL溶液再加入50 mL蒸馏水稀释。取上述溶液1 mL置于试管内,加入柠檬酸缓冲液1 mL,氯胺T 1 mL,混合氧化10 min,之后加入HClO4溶液1 mL,静置10 min。利用显色剂在65℃水浴锅显色反应,上述稀释溶液中加入对二甲基氨基苯甲醛显色试剂1 mL,显色10 min,静置冷却。利用紫外分光光度仪在560 nm处测量吸光度(蒸馏水为空白对照)[16]。代入标准曲线,得样品液中羟脯氨酸质量浓度,再用公式得到羟脯氨酸得率:

式中,W—样品中羟脯氨酸得率(%);ρ—羟脯氨酸标准液质量浓度(μg·mL-1);V—提取液总体积(mL);k—稀释倍数;m—原料质量(g);n—换算系数(为0.1)。
成品得率(%)=冷冻干燥后胶原蛋白重量(g)/鱼皮原重量(g)×100%°
1.3.4 单因素试验
通过预试验设定选取超声波提取时间、胃蛋白酶提取时间、酶解温度、pH 4个单因素水平。在pH 2.0、酶解温度35℃、酶解提取时间7.5 h条件下,选取超声波时间为2、2.5、3.0、3.5、4、4.5 h,测定并计算胶原蛋白提取率;在pH 2.0、酶解温度35℃、超声波提取时间3.5 h条件下,选取提取时间4、5、6、7、8、9 h,测定提取率;在超声波提取时间3.5 h、酶解时间7.5 h、pH 2.0条件下,选取胃蛋白酶水解温度25、30、35、40、45℃进行单因素试验测定提取率;在超声波提取时间3.5 h、酶解时间为7.5 h、提取温度35℃条件下,pH分别选取1.0、1.5、2.0、2.5、3.0进行提取试验。每个水平平行3次取平均值。
1.3.5 响应面优化试验
根据单因素试验结果选取超声波提取时间、酶解温度、pH 3个因素为参考因素,根据Box-Behnken设计3因素3水平试验(见表1),采用Design expert 8.0.6软件处理数据,得到提取胶原蛋白的优化工艺。
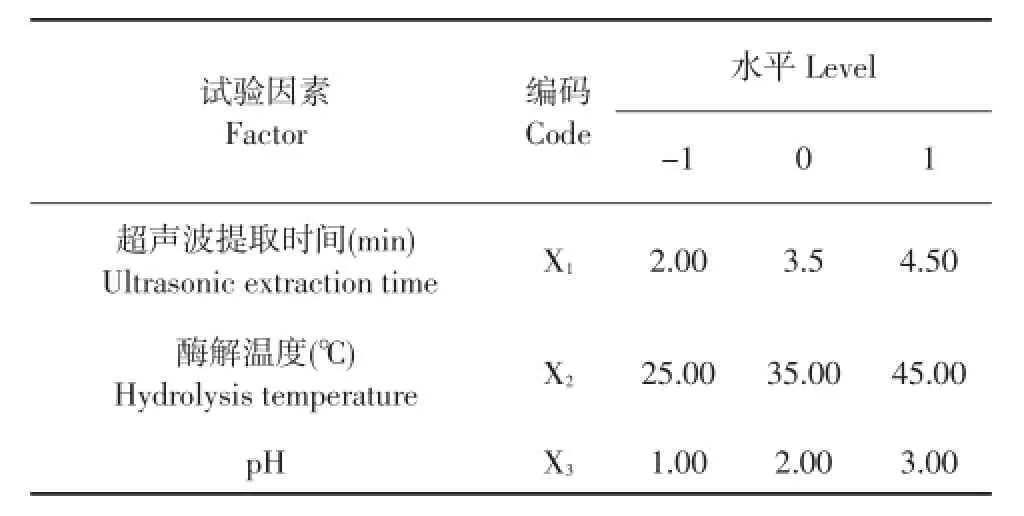
表1 Box-Behnken试验3因素水平编码Table 1 Codes and levels on three factors of Box-Behnken experimental
1.3.6 数据处理与分析
所有试验进行3次重复,数据采用Excel 2007、Design expert 8.0.6软件对数据进行处理分析。
2 结果与分析
2.1 单因素试验
2.1.1 超声波提取时间对胶原蛋白提取率的影响
由图2可知,随超声波提取时间延长,提取率不断增大,说明超声波可增加提取率,缩短提取时间,但当超声波提取时间超过3.5 h后,提取率不变,说明胶原蛋白与胃蛋白酶间传质推动力趋于零。
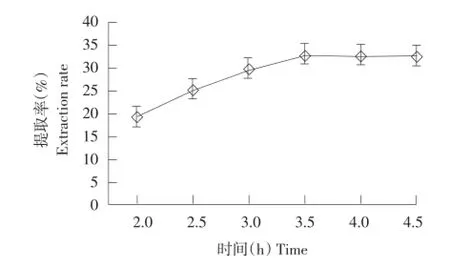
图2 超声波提取时间对胶原蛋白提取率的影响Fig.2 Effects of supersonic extraction time on extraction rate of collagen
2.1.2 胃蛋白酶水解时间对胶原蛋白提取率的影响
结果见图3,酶解时间7.5 h最佳,继续增加酶量,得率增加缓慢,不适宜增加更高酶量。

图3 胃蛋白酶水解时间对胶原蛋白提取率的影响Fig.3 Effects of enzymatic time on extraction rate of collagen
2.1.3 酶解温度对胶原蛋白提取率的影响
选取不同温度条件下,探讨温度对胶原蛋白酶解提取效果的影响。结果见图4,随温度提高,提取率不断上升,在35℃时达最大,温度继续升高则提取率下降,说明酶活性被高温抑制。结果说明,35℃是胃蛋白酶适宜温度,其活性达最大。

图4 酶解温度对胶原蛋白提取率的影响Fig.4 Effects of temperature on extraction rate of collagen
2.1.4 pH对胶原蛋白提取率的影响
调节不同pH测定对胶原蛋白提取率的影响,结果如图5所示,在pH 2.0时提取率最佳,同时也适合胃蛋白酶的活性酸度范围。
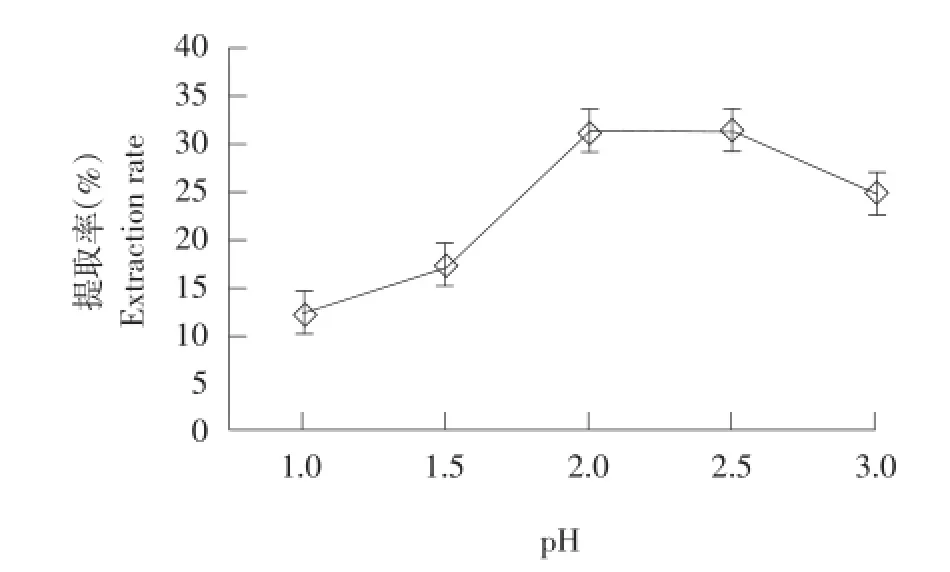
图5 pH对胶原蛋白提取率的影响Fig.5 Effects of pH on extraction rate of collagen
2.1.5 优化正交试验
上述单因素试验可得出,胶原蛋白提取率与胃蛋白酶解时间关系较不明显,与超声波提取时间、pH、温度关系影响较大。取超声波提取时间、pH、提取温度为影响因素,确定胃蛋白酶解时间7.5 h,每个因素取3个水平,设计L9(33)正交试验,进一步优化提取条件[17]。每组试验取10 mL胶原蛋白提取液,各组试验提取液按1.3.2方法测定吸光度,计算胶原蛋白提取率。结果见表2。
按照正交试验所得结果,分析3个因素水平对提取率影响程度分别为:超声提取时间>pH>温度;经分析结果得出胶原蛋白提取最优工艺A2C2B2,即pH 2.0、温度35℃、超声波提取时间3.5 h。

表2 L9(33)正交试验结果与分析Table 2 Results and analysis of L9(33)'s orthogonal experiment
2.1.6 响应面法优化试验
根据Box-Behnken试验设计方案,选取超声波提取时间(X1)、酶解温度(X2)、pH(X3)3个影响因子,胶原蛋白提取率为响应值,可得到试验设计结果见表3。
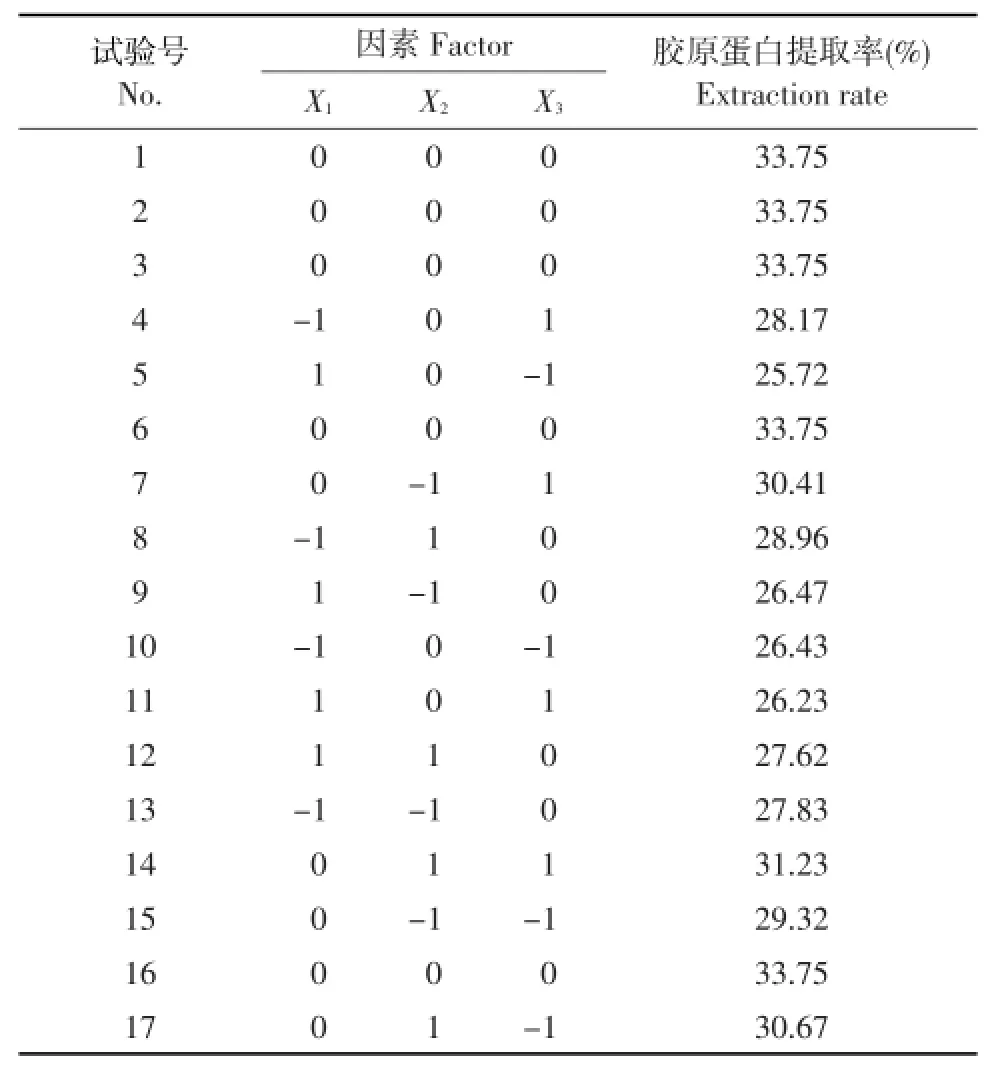
表3 胶原蛋白提取工艺Box-Behnken试验设计及结果Table 3 Results of Box-Behnken design and corresponding for collagen extraction
采用Design expert 8.0.6软件对17组试验数据进行多项拟合回归分析,可以得到pH、超声波提取时间及酶解温度对提取率影响的多元二次回归方程:

检验回归方程有效性及3个单因素因子对鳕鱼皮中胶原蛋白提取率的影响,对数学模型进行方差分析(见表4)。P<0.0001表示有极显著的差异,0.0001<P<0.01较为显著差异,0.01<P<0.05有显著差异。P值为0.1183不显著,决定系数R2= 0.9875,表明超声波提取时间、酶解温度及pH等3个因子对鳕鱼皮胶原蛋白提取率有98.75%影响。可以看出,此模型拟合度较适合分析鳕鱼蛋白提取率,回归方程可以表示3因素对响应值函数关系。
由表4可知,回归模型中X2的P<0.0001,表明酶解温度(X2)对胶原蛋白的提取率影响极其显著。pH(X3)P值为0.0001~0.01,其对鳕鱼蛋白提取率影响较为显著。超声波提取时间(X1)的P>0.01也说明其显著影响蛋白提取率,不如pH及酶解温度影响明显。X1X3和X2X3项对响应值有显著影响,而X1X2没有。二次项3个因素显著性X22>X32>X12。显示3个因子超声波提取时间、酶解温度、pH对鳕鱼皮胶原蛋白提取影响相关联,不是单因素影响的线性关系,通过数学建模可表示3因素对提取率的影响。
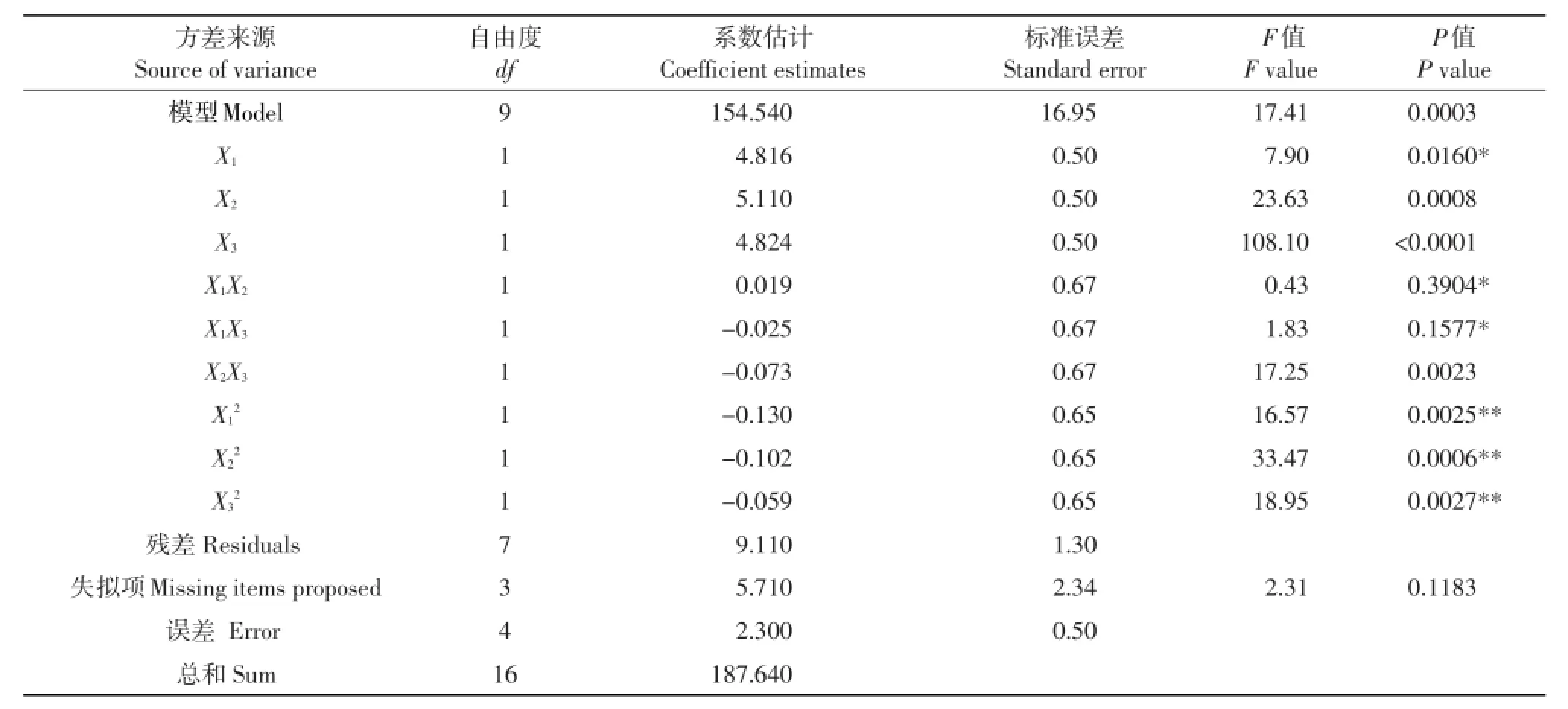
表4 提取工艺回归模型方差分析结果Table 4 ANOVA for the regression equation describing the extraction process
由响应面图6~8可知,3个因子对响应值的敏感程度,酶解温度响应曲面最陡峭,对蛋白提取率作用最显著,其次是pH,再次是超声波提取时间。通过使用软件Design expert 8.0.6对回归方程进行计算,进而得到最优工艺:在酶解时间7.5 h条件下,超声波辅助提取时间3.5 h,pH 2.0,温度35℃,胶原蛋白的模型最优提取率达33.28%。利用数学建模得出模型条件,进行3次平行试验,所得蛋白提取率为33.75%,与预测模型相差不大。实际试验操作结果与数学模型结果一致,说明拟合度良好,可以响应面优化试验数据得出工艺参数。
2.2 提取胶原蛋白纯度测定
经冷冻干燥后的胶原蛋白为浅黄色三维孔状结构,是一种含大量羟基的糖蛋白,通过氢键可与水分子结合,吸水性极强[18]。
取10 mg冷冻干燥后的胶原蛋白样品,加入20 mL浓度为6 mol·L-1盐酸溶解,测定特征氨基酸羟脯氨酸质量浓度,3次平行试验取平均值,计算胶原蛋白提取率(%)=干燥后胶原质量(mg)/干燥前胶原质量(mg)×100%=33.75%。
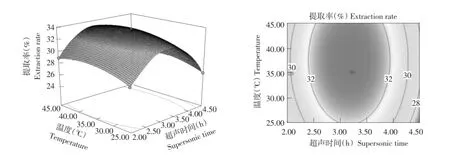
图6 pH 2.0时超声波提取时间和温度对胶原蛋白提取率的影响Fig.6 Effects of supersonic extraction time and temperature on extraction rate of collagen with pH 2.0

图7 超声波提取时间3.5 h时pH和温度对胶原蛋白提取率的影响Fig.7 Effects of pH and temperature on extraction rate of collagen with supersonic extraction time 3.5 h
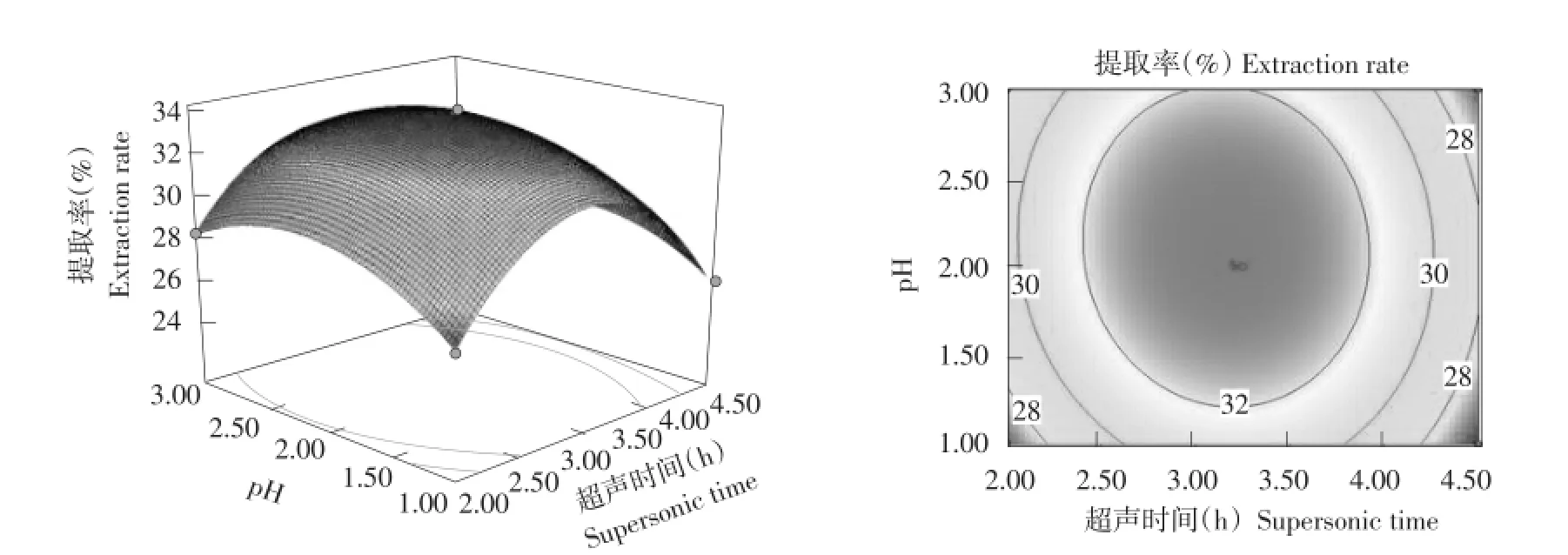
图8 温度为35℃时超声波提取时间和pH对胶原蛋白提取率的影响Fig.8 Effects of supersonic extraction time and pH on extraction rate of collagen with temperature 35℃
2.3 胶原蛋白光谱扫描
取适量稀醋酸溶解少量胶原蛋白提取液,置于紫外分光光度计中,以稀醋酸作为空白对照,在近紫外区200~300 nm进行光谱扫描,结果如图9所示。
由图9可知,在近紫外区200~300 nm进行光谱扫描,其最大特征吸收波长为226 nm,符合胶原蛋白紫外吸收特征[19]。
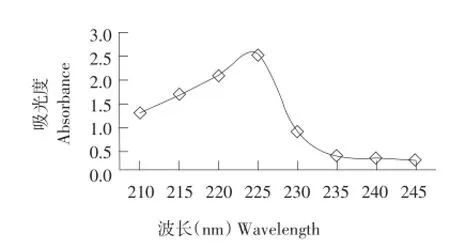
图9 胶原蛋白的紫外光谱Fig.9 UV absorption spectrum of collagen
3 讨论与结论
目前对胶原蛋白提取液进行盐析、透析多采用提取试剂溶解经NaCl盐析成的絮状沉淀,透析外液也用提取试剂进行透析,本试验用蒸馏水作为溶解液和透析外液,节约成本。在提取时加入少量玻璃珠于提取试剂中,加速块状鱼皮溶解速度。
超声波产生微声流能加快传质扩散,产生空化、震荡效应,活化酶分子构象及催化部位。本试验利用超声波和胃蛋白酶共同作用提取胶原蛋白,所用时间为3.5 h,与单独酶解所需时间23 h相比,能够显著缩短提取时间。
本研究将响应曲面法运用于优化鳕鱼皮胶原蛋白提取工艺。经试验优化后的胶原蛋白提取最佳工艺条件为:超声波辅助提取时间3.5 h、pH 2.0、温度35℃、酶解时间7.5 h。此工艺下建模理论提取率为33.28%,实际试验得出提取率为33.75%,误差小。因此,可采用此模型对试验进行数据分析。各因素对胶原蛋白提取率的影响分别为:超声波辅助提取时间>pH>温度>酶解时间。研究结果显示,超声波辅助酶法提取胶原蛋白时间短、得率高。如何将多种提取方法结合使用最大限度缩短提取时间并提高得率,尚待深入研究。
[1]安锋利,王建林,权美平,等.胶原蛋白的应用及其发展前景[J].贵州农业科学,2011,39(1):8-11.
[2]李二凤,何小维,罗志刚.胶原蛋白在食品中的应用[J].中国乳品工业,2006(2):50-52.
[3]刘䶮,刘玲蓉,陈名懋,等.胶原模拟多肽三螺旋结构的热变性过程[J].中国医学科学院学报,2010(3):343-346.
[4] 张彦民,李宝才,朱利平,等.多糖化学及其生物活性研究进展[J].昆明理工大学学报:理工版,2003(3):140-145,149.
[5]乔振峰.表面活性剂在提取中草药活性成分中的应用[D].兰州:兰州大学,2009.
[6]Swatschek D,Schatton W,Kellermann J,et al.Marine sponge col⁃ lagen:Isolation,characterization and effects on the skin parame⁃ters surface-pH,moisture and sebum[J].European Journal of Pharmaceutics and Biopharmaceutics,2002,53(1):107-113.
[7]Cho S M,Gu Y S,Kim S B.Extracting optimization and physical properties of yellowfin tuna(Thunnus albacares)skin gelatin com⁃pared to mammalian gelatins[J].Food Hydrocolloids,2005,19: 221-229.
[8]林琳.鱼皮胶原蛋白的制备及胶原蛋白多肽活性的研究[D].青岛:中国海洋大学,2006.
[9]Amesen J A,Gildberg A.Extraction and characterization of gela⁃tine from Atlanticsalmon(Salmo salar)skin[J].Bioresource Tech⁃nology,2007,98:53-57.
[10]Sadowska M,Kolodziejska I,Niecikowska C.Isolation of collagen from the skins of Baltic cod(Gadus morhua)[J].Food Chemistry, 2003(81):257-262.
[11]闫鸣艳.狭鳕鱼皮胶原蛋白结构和物理特性的研究[J].青岛:中国海洋大学,2009:17-42.
[12]程波,户业丽,吕中,等.人工养殖鲟鱼鳍中胶原蛋白含量的测定[J].中国食品添加剂,2008(4):126-129.
[13]Jongjareonrak A,Benjakul S,Visessanguan W,et al.Isolation and characterization of acid and pepsin-solubilised collagens from the skin of Brown stripe red snapper(Lutjanus vitta)[J]. Food Chemistry,2005,93:475-484.
[14]Skierka E,Sadowska M.The influence of different acids and pep⁃sin on the extractability of collagen from the skin of Baltic cod (Gadus morhua)[J].Food Chemistry,2007(105):1302-1306.
[15]Sadowska M,Kołodziejska I.Optimisation of conditions for precip⁃itation of collagen from solution using κ-carrageenan.Studies on collagen from the skin of Baltic cod(Gadus morhua)[J].Food Chemistry,2005(91):45-49.
[16]张俊杰,曾庆孝.比色法测定鱼鳞中羟脯氨酸的研究[J].食品科技,2004(4):83-85.
[17]刘瑞江,张业旺,闻崇炜,等.正交试验设计和分析方法研究[J].实验技术与管理,2010(9):52-55.
[18]李鑫.真空冷冻干燥技术及其制冷系统节能的实验研究[D].北京:北京工业大学,2012.
[19]吕婷,王红英,孙佳佳,等.酶法制取鱼皮胶原蛋白短肽[J].大连工业大学学报,2009,28(1):9-12.
Optimization of cod skin collagen extrating conditions by ultrasonic respose surface methodology
WANG Xi1,ZHONG Yaoguang1,ICHIKAWA Hisashi2(1. School of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China;2. Faculty of Fisheries,Nagasaki University,Nagasaki 852-8043,Japan)
Using fresh Alaska abysmal sea cod skin as raw material,the use of response surface methodology(RSM)optimized the ultrasonic extraction of collagen fast process.It could get the factor order by using single factor experiment.pH,temperature and the supersonic extraction time were chosen as influencing factors.The extraction rate of collagen was selected as response value.The mathematical model was established by Box-Behnken central composite design.The results showed that the optimum conditions were pH 2.0,temperature 35℃,supersonic extraction time 3.5 h,the decomposition time of enzyme 7.5 h, extraction rate of collagen was 33.75%.
response surface;ultrasonic wave;collagen;cod
TS254.9;S965.321
A
1005-9369(2014)07-0117-07
时间2014-7-4 17:27:09 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140707.0843.011.html
王希,钟耀广,市川寿.响应面优化超声波快速提取鳕鱼皮中胶原蛋白的工艺研究[J].东北农业大学学报,2014,45(7):117-123.
Wang Xi,Zhong Yaoguang,Ichikawa Hisashi.Optimization of cod skin collagen extrating conditions by ultrasonic respose surface methodology[J].Journal of Northeast Agricultural University,2014,45(7):117-123.(in Chinese with English abstract)
2014-04-13
上海市科委工程中心建设项目(11DZ2280300)
王希(1987-),女,硕士研究生,研究方向为功能食品。E-mail:195184808@qq.com
*通讯作者:钟耀广,教授,博士生导师,研究方向为食品安全与功能食品。E-mail:ygzhong@shou.edu.cn

