三株生防酵母菌对Botrytis cinerea的抑菌作用研究
王傲雪,关 鑫,张俊峰,张珍珠,王瑞虎,陈秀玲
(1.东北农业大学园艺学院,哈尔滨 150030;2.东北农业大学生命科学学院,哈尔滨 150030)
三株生防酵母菌对Botrytis cinerea的抑菌作用研究
王傲雪1,2,关 鑫1,张俊峰2,张珍珠2,王瑞虎1,陈秀玲1
(1.东北农业大学园艺学院,哈尔滨 150030;2.东北农业大学生命科学学院,哈尔滨 150030)
针对三株生防酵母菌Cryptococcus albidus63(Ca63)、Cryptococcus albidus64(Ca64)、Candida parapsilosisyett1006对番茄灰霉病病原菌B.cinereat08016b的抑菌作用进行研究。三株生防酵母菌与B.cinereat08016b的对峙培养过程中,未产生明显抑菌圈,均可减弱B.cinerea t08016b生长势;几丁质酶和β-1,3-葡聚糖酶活性测定结果表明,t08016b并无诱导三株酵母菌分泌酶活显著增加(P>0.05);研究酵母菌对B.cinerea t08016b菌丝生长和孢子萌发率影响发现,C.albidus63、C.albidus64和C.parapsilosisyett1006对菌丝生长量的抑制率分别为88.57%、90.66%和85.65%,高浓度菌液对孢子萌发有显著抑制效果,1×108cfu·mL-1菌体活细胞能完全抑制病原菌孢子萌发,菌体活细胞浓度越低抑制效果越不明显,无菌滤液和灭活的菌体活细胞对病原孢子的萌发无显著抑制效果。结果表明,生防酵母菌主要通过竞争有限的生长空间和营养条件,而非通过分泌抑菌物质实现拮抗作用。
生防酵母菌;菌丝生长;孢子萌发率;几丁质酶酶活;β-1,3-葡聚糖酶酶活
果蔬采后病害可导致果蔬失去商品性,造成资源浪费和经济损失。朱丽娅等研究报道,绝大多数果蔬采后病害由致病真菌引起[1]。长期使用化学药剂能引起致病菌产生抗药性、药物残留等问题。因此,寻求可替代化学药剂的安全有效防治病害方法尤为必要[2]。目前运用生物防治技术控制果蔬采后病害已成为研究热点,与复杂多变的田间病害系统相比,果蔬相对简单稳定的采后病害发生环境使生防制剂施用更具操作性。果蔬在生长成熟、采摘收获和贮藏管理过程中产生的伤口是致病菌主要入侵途径。利用生防菌与病原菌竞争伤口处有利环境可起到抑制病原菌生长作用[3]。在多种生防菌中,酵母菌因具有遗传稳定、安全性高、营养需求低、增殖速度快等优点,具有广阔应用前景[4]。
在果蔬采后病害防治过程中,生防酵母菌受环境、寄主、病原菌等因素影响,其拮抗机理尚未得到明确阐述,大量研究表明,作用方式包括:对病原菌的寄生作用[5-6],分泌抗真菌化合物[7],诱导寄主产生抗性[8]和营养和空间竞争[9-11]。
本研究通过PDA平板对峙试验和PDB液体培养试验的方法统计分析三株生防酵母菌对灰葡萄孢菌t08016b生长的抑制作用和对孢子萌发率的影响变化,采用DNS法对三株生防酵母菌的几丁质酶和β-1,3-葡聚糖酶活性进行测定,为深入研究生防酵母菌拮抗机理奠定理论基础,也可为生防酵母菌的后续开发应用、生防效果的提高、基因改造以及相应生防制剂产品开发研制提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株及培养
生防酵母菌Ca63(Cryptococcus albidus)、Ca64 (Cryptococcus albidus)、yett1006(Candida parapsilosis)和灰葡萄孢菌t08016b(Botrytis cinerea)均由东北农业大学园艺学院番茄课题组保存。将三株生防酵母菌接种在YPD固体培养基(葡萄糖20 g溶解于100 mL蒸馏水中,酵母粉10 g、蛋白胨20 g溶解于900 mL蒸馏水中,两瓶溶液于121℃高压蒸汽灭菌20 min,用时将两瓶溶液混合均匀后使用)上划线活化,挑取单菌落于NYDB液体种子培养基(葡萄糖20 g溶解于100 mL蒸馏水中,酵母膏5 g和牛肉膏8 g溶解于900 mL蒸馏水中,两瓶溶液于121℃高压蒸汽灭菌20 min,用时将两瓶溶液混匀使用)中,28℃,180 r·min-1振荡培养20 h,作种子液备用。
灰葡萄孢菌t08016b在PDA(去皮马铃薯200 g切成小块,加入500 mL蒸馏水煮沸30 min后用双层纱布过滤,向滤液中加入葡萄糖20 g和琼脂20 g,用蒸馏水定容至1 L,121℃高压蒸汽灭菌20 min)平板上培养7 d以上使之大量产孢。用无菌水将孢子冲洗下来调配成浓度为1×106cfu·mL-1备用。
1.1.2 供试试剂
1 mg·mL-1葡萄糖标准溶液、1 mg·mL-1N-乙酰氨基葡萄糖标准溶液和1 mg·mL-1昆布多糖溶液均按常规方法配制,粉末状药品称量之前在烘箱内烘至恒重;DNS试剂:在含有185 g酒石酸钾钠的500 mL热溶液中加入3,5-二硝基水杨酸6.3 g和2 mol·L-1NaOH溶液262 mL,然后依次加入结晶酚5 g和亚硫酸钠5 g,蒸馏水定容至1 L,避光保存;胶体几丁质:称取5 g几丁质粉末,加入4℃预冷的浓HCl 200 mL,4℃静置过夜,用玻璃棉过滤后将滤液缓慢加入到剧烈搅拌50%乙醇中,使胶体几丁质沉淀析出。收集胶体几丁质沉淀用蒸馏水反复洗涤直至pH为7.0。将中性的胶体几丁质沉淀悬浮于200 mL蒸馏水中,即为胶体几丁质溶液,避光保存于4℃备用。
1.2 方法
1.2.1 生防酵母菌对灰葡萄孢菌t08016b的抑菌作用(PDA平板对峙试验)
在PDA平板上等距离放置四张直径为5 mm的圆形滤纸片,在平板中心针刺1个4 mm(深)×2 mm(宽)的小孔。在圆形滤纸片上分别滴加10 μL的1× 108cfu·mL-1的三株生防酵母菌悬液,在平板中心小孔中加入10 μL的1×106cfu·mL-1灰葡萄孢菌t08016b孢子悬浮液,25℃静置培养7 d,以接种灰葡萄孢菌的平板为对照,观察灰葡萄孢菌生长状态,每个处理3次重复。
1.2.2 生防酵母菌对灰葡萄孢菌t08016b相互作用的显微观察
按照2%(V/V)接种量在NYDB液体培养基中接入酵母种子液并于28℃,200 r·min-1振荡培养20 h得到3株生防酵母菌发酵液。离心取适量菌体用无菌水调配成浓度为1×106cfu·mL-1菌悬液。在平板中倒入薄薄一层PDA固体培养基,待凝固后用无菌刀片将培养基分成20 mm×20 mm放置在无菌载玻片上,将带有培养基的载玻片放置在底部铺有润湿滤纸的空平板内,把已调配好的酵母菌悬液和灰葡萄孢菌t08016b孢子悬浮液(1×106cfu·mL-1)各取5 μL混合均匀后滴在培养基上,25℃静置培养24 h,取出载玻片置于显微镜下观察,每个处理10次重复。
1.2.3 生防酵母菌几丁质酶和β-1,3-葡聚糖酶活性的测定
参照李世贵[12]和陶刚[13]等方法,建立葡萄糖和N-乙酰氨基葡萄糖标准曲线。在PDB液体培养基(PDA培养基中不加琼脂)中按照2%(V/V)接种量接入酵母种子液并于25℃,180 r·min-1振荡培养;同时将酵母发酵液和灰葡萄孢菌悬液(1×106cfu·mL-1)取等体积混匀以2%(V/V)接种量转接到PDB液体培养基中也于25℃、180 r·min-1振荡培养。3~12 h期间每3 h取样1次,12~96 h期间每12 h取样1次,将样品于4℃,8 000 r·min-1离心5 min,弃去沉淀,以加热灭活的上清液为对照,分别测定几丁质酶和β-1,3-葡聚糖酶活性(见表1、2),每个处理3次重复。
1.2.4 生防酵母菌对灰葡萄孢菌t08016b菌丝生长的影响
在50 mL PDB液体培养基中接种1 cm2灰葡萄孢菌,然后再按照2%(V/V)接种量分别接入三株生防酵母种子液,25℃,100 r·min-1振荡培养7 d,不接种生防酵母菌为对照,观察灰葡萄孢菌菌丝生长状态,用纱布过滤收集菌丝,烘干并称重,每个处理3次重复。

表1 几丁质酶活性的测定Table 1 Assay of chitinase activity

表2 β-1,3-葡聚糖酶活性的测定Table 2 Assay of β-1,3-glucanase activity
1.2.5 生防酵母菌对灰葡萄孢菌t08016b孢子萌发的影响(PDB试验)
按照2%(V/V)接种量在NYDB液体培养基中接入酵母种子液并于28℃,200 r·min-1振荡培养20 h得到三株生防酵母菌发酵液。10 000 r·min-1离心10 min后作如下处理:①沉淀菌体用无菌水调配成浓度分别为1×108、1×106、1×104cfu·mL-1菌悬液,将调配好的菌液分为等体积两份,其中1份经沸水浴20 min灭活;②将离心后得到的发酵上清液分为等体积两份,其中1份经沸水浴20 min灭活。
取上述菌悬液、灭活菌悬液、发酵上清液、灭活发酵上清液、无菌水各50 μL分别和50 μL灰葡萄孢菌t08016b孢子悬浮液(1×106cfu·mL-1)、50 μL PDB培养基加入到无菌离心管中,混合均匀后置于25℃恒温培养过夜,以无菌水处理为对照,在显微镜下统计各处理中灰葡萄孢菌t08016b孢子萌发率,每个处理观察100个孢子,每个处理3次重复。
1.2.6 数据处理
所有数据的统计与分析均采用统计分析软件SPSS 17.0。
2 结果与分析
2.1 生防酵母菌对灰葡萄孢菌t08016b的抑菌作用
由图1可知,在接种三株生防酵母菌的PDA对峙平板上均无明显抑菌圈出现,说明三株生防酵母菌在PDA平板上都不能分泌强效抗菌类物质对病原菌产生较强抑制作用。与对照相比,接种三株生防酵母菌的PDA平板上灰葡萄孢菌生长状态明显较弱。25℃静置培养7 d后对照组菌丝铺满培养皿、菌丝浓密、生长旺盛且产孢量较高;接有生防酵母菌的平板上灰葡萄孢菌长势较弱、未能铺满培养皿、菌丝稀疏、生长不旺盛且产孢量低。说明三株生防酵母菌虽没有分泌强效的抗菌类物质形成抑菌圈,但可能分泌能抑制灰葡萄孢菌生长和孢子萌发物质,减弱病原菌生长态势和活力。
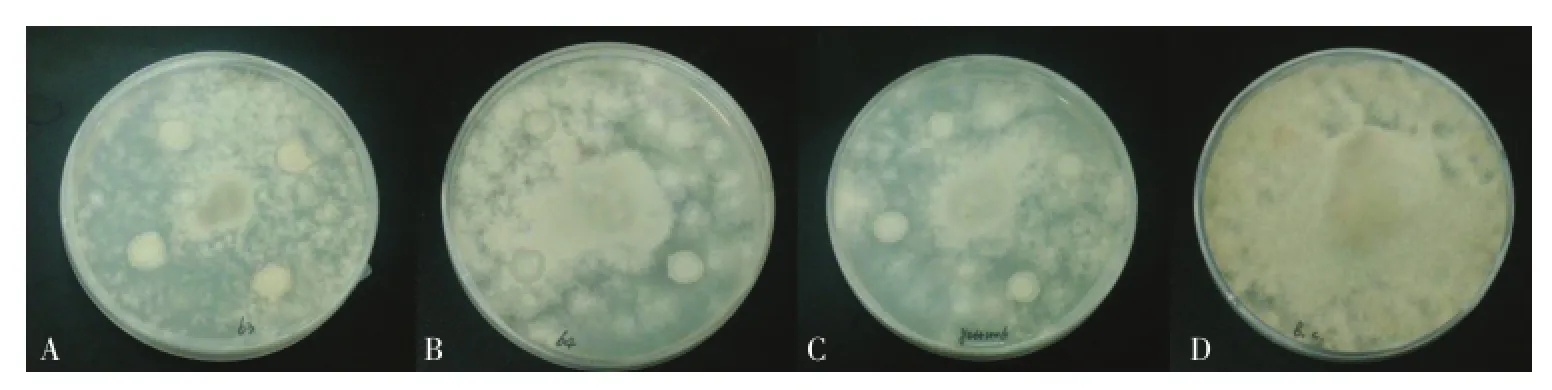
图1 三株生防酵母菌对灰葡萄孢菌的抑菌作用Fig.1 Antifungal activities of three biocontrol yeast strains against B.cinerea
2.2 生防酵母菌与灰葡萄孢菌t08016b相互作用的显微观察
由图2可知,三株生防酵母菌均与灰葡萄孢菌t08016b菌丝存在接触部分,但不能确定生防酵母菌是否分泌胞外水解酶并破坏病原菌菌丝细胞壁,甚至进一步寄生到病原菌内部,如果存在这种寄生关系,则在二者共培养液中胞外水解酶活性一定比酵母单培养液中的胞外水解酶活性高。因此可通过考查灰葡萄孢菌t08016b在共培养液中是否诱导酵母菌分泌更多的β-1,3-葡聚糖酶和几丁质酶这类胞外水解酶促使这些酶活性大幅提高,以验证对灰葡萄孢菌t08016b寄生现象的存在。
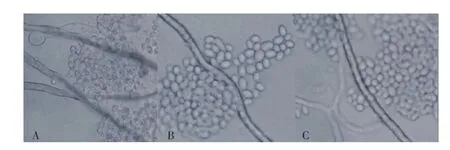
图2 生防酵母菌与灰葡萄孢菌t08016b菌丝相互作用光学显微图Fig.2 Micrograph of the interaction between biocontrol yeasts and B.cinerea mycelia in microscope
2.3 几丁质酶活性和β-1,3-葡聚糖酶活性的测定
按照上述方法绘制葡萄糖和N-乙酰氨基葡萄
糖标准曲线,得到标准曲线线性方程分别为y= 1.1797x(R2=0.9981)和y=1.3995x-0.0306(R2=0.9978)。
采用DNS法对三株生防酵母菌单培养液及与灰葡萄孢菌t08016b共培养液的上清液中几丁质酶活性和β-1,3-葡聚糖酶活性进行测定比较,结果见图3。
三株生防酵母菌几丁质酶活力和β-1,3-葡聚糖酶活力变化趋势相似,相同培养时间里菌株Ca64的两种水解酶活力均高于其他两种。加入灰葡萄孢菌进行诱导后,与单培养液中上述两种酶酶活性相比,两种水解酶酶活性并没有显著增加。这说明灰葡萄孢菌没有诱导生防酵母菌分泌更多水解酶,因此推测三株生防酵母菌与病原菌灰葡萄孢菌t08016b可能不存在寄生关系。
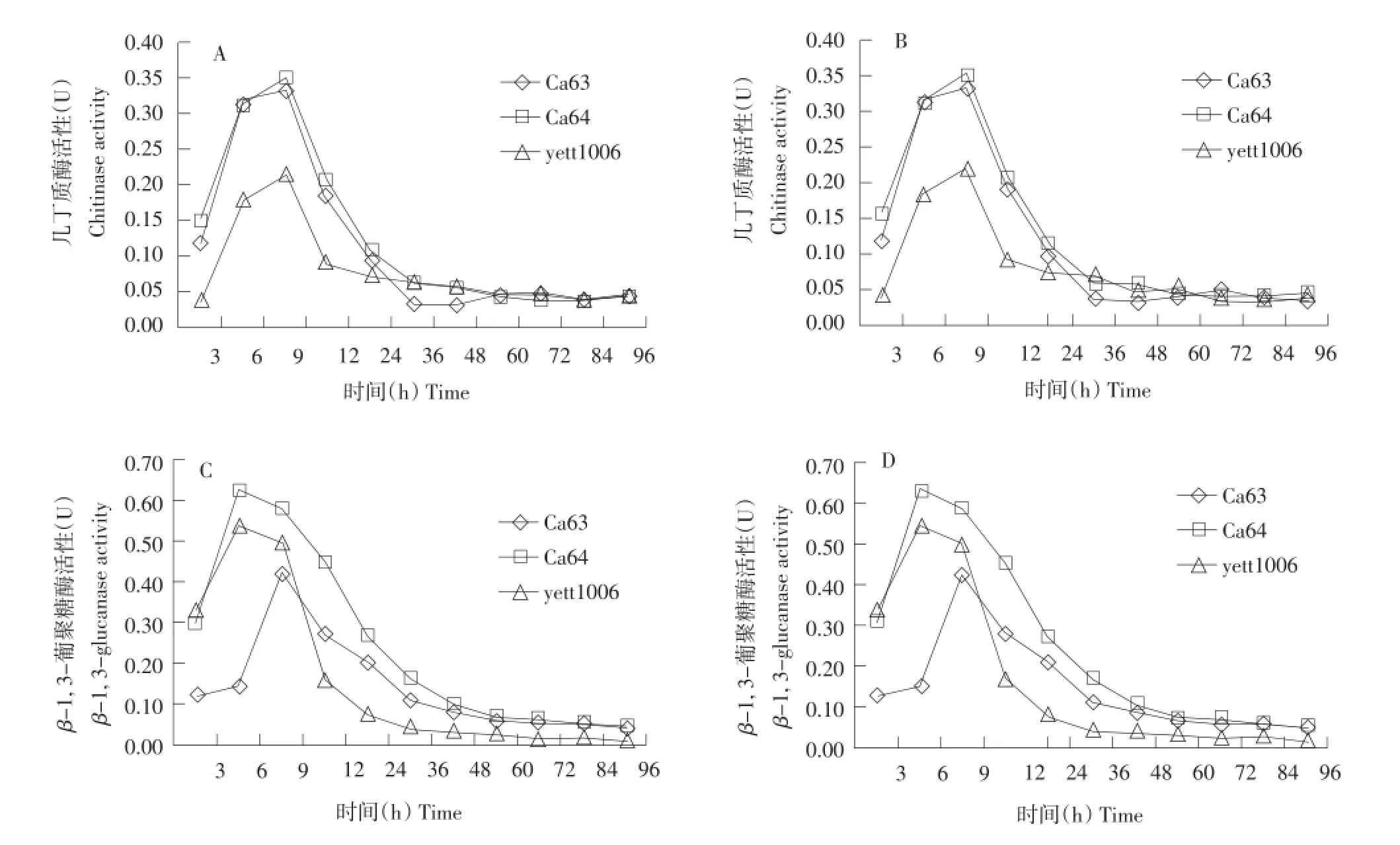
图3 三株生防酵母菌的几丁质酶和β-1,3-葡聚糖酶活性变化曲线Fig.3 Curves of chitinase and β-1,3-glucanase activity from three biocontrol biocontrol yeast strains
2.4 生防酵母菌对灰葡萄孢菌t08016b菌丝生长的影响
25℃下振荡培养7 d后发现,对照组菌丝大量生长,接种生防酵母菌的处理组则仅有少量菌丝(见图4),说明三株生防酵母菌对灰葡萄孢菌菌丝生长均有明显抑制作用。将菌丝过滤烘干并称重发现Ca64对灰葡萄孢菌菌丝生长量抑制率高于其他两种生防酵母菌,Ca63、Ca64和yett1006三株生防酵母菌对灰葡萄孢菌菌丝生长量抑制率分别为88.57%、90.66%和85.65%。

图4 三株生防菌对B.cinerea菌丝生长的影响Fig.4 Effect of three biocontrol yeasts on mycelium growth of B.cinerea
2.5 生防酵母菌对灰葡萄孢菌t08016b孢子萌发的影响
在PDB液体培养基中进行对孢子萌发影响的试验,通过显微镜观察,对不同处理下灰葡萄孢菌t08016b孢子萌发数量进行统计分析(见图5),发现菌株Ca64对孢子萌发的抑制效果要好于其他两种生防酵母菌,1×104cfu·mL-1的Ca64菌悬液对病原菌孢子萌发的抑制率仍能达到72%以上;三株生防酵母菌的活细胞均能有效抑制灰葡萄孢菌t08016b孢子萌发,且高浓度菌悬液对孢子萌发抑制效果要显著强于低浓度菌悬液(P<0.05),1×108cfu·mL-1生防酵母菌悬液基本完全抑制灰葡萄孢菌孢子萌发,结果表明,生防酵母菌活细胞数量与孢子萌发抑制率呈正相关,生防酵母菌悬液浓度越高,活细胞越多,则病原菌孢子萌发率越低。发酵上清液、灭活的菌悬液、灭活的发酵上清液以及对照组处理间孢子萌发率差异不显著(P>0.05),但均显著高于其他3组菌悬液处理组(P<0.05),说明三株生防酵母菌并不是通过分泌抑菌物质对病原菌产生抑制作用,菌体活细胞浓度对孢子萌发率影响较大且高浓度菌体具有更好的抑制效果,这可能是与酵母菌生长速率较快,在有限营养和空间条件中更具优势,能先于病原菌快速生长并抢夺有限的营养物质有关。
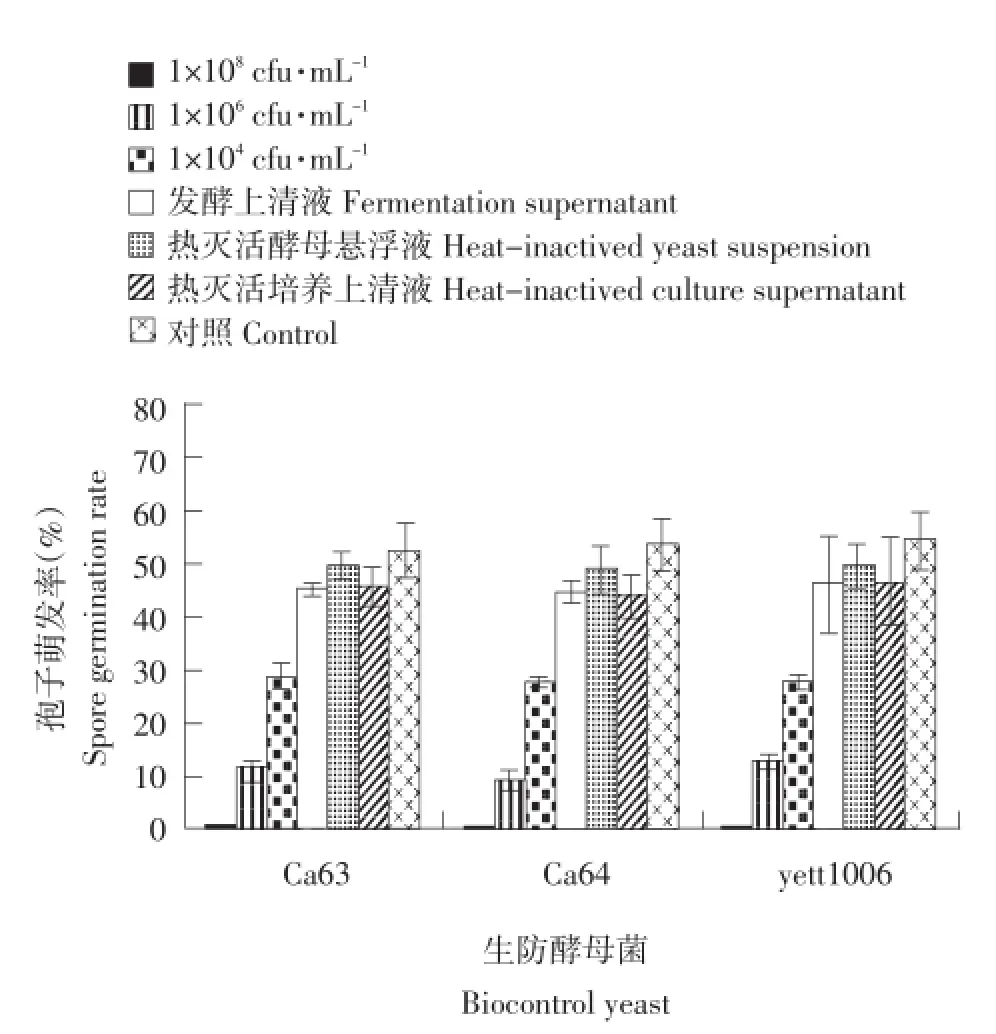
图5 三株生防菌的不同处理液对B.cinerea孢子萌发影响Fig.5 Effect of different processing on spore germination of B.cinerea
3 讨论
生防酵母菌适应性强、对大多数化学药剂不敏感等优点使生防酵母菌在果蔬采后病害防治中倍受关注[14-15]。目前已有多种生防酵母菌对果蔬采后病害具有防治效果,如Qin等发现丝孢酵母Trichosporon pullulans对苹果青霉病有良好防效[16];靳莎莎等从土壤中分离得到一株卡利比克毕赤酵母Pichia caribbica对草莓采后灰霉病和根霉病发生抑制效果显著[17]。许多假丝酵母属、隐球酵母属和毕赤酵母属的酵母菌也具有一定生防效力。
本研究发现在PDA试验中,三株生防酵母菌均未出现明显抑菌圈,与张红印研究结果[18]一致,说明三株生防酵母菌并不通过分泌抗生素起到拮抗作用。与对照相比,接种生防酵母菌平板上灰葡萄孢菌整体生长态势较弱,说明三株生防酵母菌虽未产生强效抗菌素,但可能分泌抑制灰葡萄孢菌生长物质,降低灰葡萄孢菌的生活力。PDB试验结果显示生防酵母菌浓度与其对病原菌孢子萌发抑制效果呈正相关,可能与有限的空间和营养条件中生防酵母菌能够快速消耗营养并占据空间有关,表明生防酵母菌是通过营养和空间竞争抑制病原菌生长,与Wisniewski、范青等研究结果[19-20]一致。Wisniewski等研究发现,高浓度拮抗菌能完全抑制病原菌孢子萌发[19];范青等研究发现,较高浓度拮抗假丝酵母能完全抑制桃果实采后软腐病原菌R.stolonifer孢子萌发[20]。三株生防酵母菌均能抑制灰葡萄孢菌菌丝生长,可能是由于生防酵母菌增殖速度快于病原菌孢子萌发和菌丝生长速度,先于病原菌消耗掉大量营养成分并占据大量空间,使病原菌无适合萌发生长环境,受到抑制。病原真菌细胞壁主要成分为几丁质和β-1,3-葡聚糖多聚体,这两种物质能够直接被几丁质酶和β-1,3-葡聚糖酶水解,生防菌可通过分泌水解这两种酶破坏病原真菌细胞壁,实现对病原真菌的抑制和寄生作用[21]。显微镜下观察发现,生防酵母菌能紧密附着在病原菌菌丝上,加入病原菌前后,两种水解酶活性并无显著变化,推测生防酵母菌所分泌水解酶对病原菌无明显作用,与病原菌不存在寄生关系,与秦丹研究结果[22]一致。
生防酵母菌防治效果受多因素影响,生防机制较为复杂。Li和Liu研究表明在生防酵母菌细胞接触到果蔬伤口最初24 h内,生防酵母菌作用机制是营养空间竞争,此时菌体数量呈指数倍增长,在消耗掉伤口处营养物质同时占据大量空间并形成菌膜;24 h后,生防酵母菌作用方式是由多种机制与竞争机制共同作用[23-24]。因此生防酵母菌作为生防制剂在果蔬上的具体防效及相关作用机理仍需进行深入验证研究。本研究可为下一步筛选防效较好的生防酵母菌和深入研究生防酵母菌对果蔬的生防效果及生防机理提供理论基础。
[1]朱丽娅,郜海燕,陈杭君,等.拮抗菌防治果蔬采后病害的概况[J].浙江农业科学,2013(7):853-857.
[2]王静,郑永华.拮抗菌在果蔬采后病害生物防治中的应用[J].生物技术进展,2013(6):393-398.
[3]Prusky D,Lichter A.Activation of quiescent infections by posthar⁃vest pathogens during transition from the biotrophic to the necro⁃trophic stage[J].FEMS Microbiology Letters,2007,268(1):1-8.
[4]刘普,方静凡,程运江,等.生防酵母菌防治果品采后病害机理的研究进展[J].华中农业大学学报,2013,32(3):134-140.
[5]Wisniewski M,Biles C,Droby S,et al.Mode of action of the post⁃harvest biocontrol yeast,Pichia guilliermondii.I.Characterization of attachment to Botrytis cinerea[J].Physiological and Molecular Plant Pathology,1991,39(4):245-258.
[6]蔡应繁,叶鹏盛,张利,等.β-1,3-葡聚糖酶及其在植物抗真菌病基因工程中的应用[J].西南农业学报,2001,14(2):78-81.
[7]Calvente V,De Orellano M E,Sansone G,et al.Effect of nitrogen source and pH on siderophore production by Rhodotorula strains and their application to biocontrol of phytopathogenic moulds[J]. Journal of Industrial Microbiology and Biotechnology,2001,26 (4):226-229.
[8] 赵妍.拮抗酵母及结合热空气处理对樱桃番茄采后病害的防治及其机理研究[D].南京:南京农业大学,2010:51-68.
[9]Liu J,Sui Y,Wisniewski M,et al.Review:Utilization of antagonis⁃tic yeasts to manage postharvest fungal diseases of fruit[J].Inter⁃national Journal of Food Microbiology,2013,167(2):153-160.
[10]Filonow A B.Role of competition for sugars by yeasts in the bio⁃control of gray mold of apple[J].Biocontrol Science and Technolo⁃gy,1998,8(2):243-256.
[11]Blakeman J P,Brodie I D S.Competition for nutrients between ep⁃iphytic microorganisms and germination of spores of plant patho⁃gens on beetroot leaves[J].Physiological Plant Pathology,1977,10 (1):29-42.
[12] 李世贵,顾金刚,姜瑞波,等.生防木霉菌β-1,3-葡聚糖酶活性研究[J].微生物学杂志,2010,30(4):88-90.
[13]陶刚,刘杏忠,王革,等.产几丁质酶木霉生防菌株的生化测定[J].西南农业学报,2005,18(4):452-455.
[14]Chan Z,Tian S.Interaction of antagonistic yeasts against posthar⁃vest pathogens of apple fruit and possible mode of action[J].Post⁃harvest Biology and Technology,2005,36(2):215-223.
[15]Wilson C L,Chalutz E.Postharvest biological control of Penicilli⁃um rots of citrus with antagonistic yeasts and bacteria[J].Scientia Horticulturae,1989,40(2):105-112.
[16]Qin G Z,Tian S P,Liu H B,et al.Biocontrol efficacy of three an⁃tagonistic yeasts against Penicillium expansum in harvested apple fruits[J].Acta Botanica Sinica-Chinese Eeition,2003,45(4):417-421.
[17]靳莎莎,庞水秀,赵利娜等.一株拮抗酵母的筛选鉴定及其对草莓采后病害的生防效果[J].食品科学,2013(13):212-218.
[18] 张红印.罗伦隐球酵母对水果采后病害的生物防治及其防治机理研究[D].杭州:浙江大学,2004:56-61.
[19]Wisniewski M,Wilson C,Hershberger W.Characterization of in⁃hibition of Rhizopus stolonifer germination and growth by Entero⁃bactercloacae[J].Canadian Journal of Botany,1989,67(8):2317-2323.
[20]范青,田世平,徐勇,等.季也蒙假丝酵母对采后桃果实软腐病的抑制效果[J].植物学报,2000,42(10):1033-1038.
[21]陈秀玲,李景富,王傲雪.β-1,3-葡聚糖酶及其在蔬菜抗真菌病害基因工程中的应用[J].东北农业大学学报,2008,39(12): 118-124.
[22]秦丹.生防制剂在葡萄保鲜中的应用与抑菌机理研究[D].长沙:湖南农业大学,2007:22-23.
[23]Li B Q,Zhou Z W,Tian S P.Combined effects of endo-and exoge⁃nous trehalose on stress tolerance and biocontrol efficacy of two antagonistic yeasts[J].Biological Control,2008,46(2):187-193.
[24]Liu J,Wisniewski M,Droby S,et al.Increase in antioxidant gene transcripts,stress tolerance and biocontrol efficacy of Candida oleophila following sublethal oxidative stress exposure[J].FEMS Microbiology Ecology,2012,80(3):578-590.
Study on antifungal activities of biocontrol yeasts against Botrytis cinerea
WANG Aoxue1,2,GUAN Xin1,ZHANG Junfeng2,ZHANG Zhenzhu2,WANG Ruihu1,CHEN Xiuling1(1.School of Horticulture,Northeast Agricultural University,Harbin 150030,China;2.School of Life Sciences,NortheastAgricultural University,Harbin 150030,China)
In this study,the antifungal activities of biocontrol yeastsCryptococcus albidus63(Ca63), Cryptococcus albidus64(Ca64)andCandida parapsilosisyett1006 againstBotrytis cinereawere investigated.The dual culture between three biocontrol yeasts andB.cinereat08016b results showed that no obvious inhibiting zone appeared,but the pathogen growed more weakly than the control.The results of chitinase andβ-1,3-glucanase activities assay showed that the levels of the two enzymes activities did not change significantly(P>0.05)when the three biocontrol yeasts cultured with pathogen.The inhibition rates of three biocontrol yeast strains on mycelium growth were 88.57%,90.66%and 85.65%,respectively.High concentrations of biocontrol yeasts had a strong inhibitory effect on the spore germination ofB.cinerea t08016b.Especially,1×108cfu·mL-1biocontrol yeasts almost stopped the spore germination ofB.cinereat08016b.Heat-inactived yeast suspension and culture supernatant had no significant inhibitory effects onB. cinerea.These results illustrated that the antagonic effect of biocontrol yeasts was mainly due to the competition of limited space and nutrient conditions,not secreting antifungal substances.
biocontrol yeast;mycelium growth;spore germination rate;chitinase activity;β-1,3-glucanase activity
S476
A
1005-9369(2014)07-0054-07
时间2014-7-4 17:28:09 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140707.0843.013.html
王傲雪,关鑫,张俊峰,等.三株生防酵母菌对Botrytis cinerea的抑菌作用研究[J].东北农业大学学报,2014,45(7):54-60.
Wang Aoxue,Guan Xin,Zhang Junfeng,et al.Study on antifungal activities of biocontrol yeasts againstBotrytis cinerea[J]. Journal of Northeast Agricultural University,2014,45(7):54-60.(in Chinese with English abstract)
2013-12-04
黑龙江省教育厅新世纪人才项目(1251-NCET-004);教育厅海外学人项目(1252HQ011);国家自然科学基金项目(31301780);教育部科学技术研究重点项目(211043)
王傲雪(1973-),男,教授,博士,博士生导师,研究方向为蔬菜分子生物学与植物生物技术。E-mail:axwang@neau.edu.cn

