苄嘧磺隆和丁草胺降解菌原生质体融合条件优化
李春艳,吴志洋,冯丽萍,熊明华,成小松
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.淮北师范大学生命科学学院,安徽 淮北 235000;3.哈尔滨医科大学第一临床医学院,哈尔滨 150001)
苄嘧磺隆和丁草胺降解菌原生质体融合条件优化
李春艳1,吴志洋1,冯丽萍1,熊明华2,成小松3
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.淮北师范大学生命科学学院,安徽 淮北 235000;3.哈尔滨医科大学第一临床医学院,哈尔滨 150001)
研究以苄嘧磺隆降解菌Rhodococcus sp.BX2与丁草胺降解菌Acinetobacter sp.LYC-1为亲本,优化用于构建可同时降解苄嘧磺隆与丁草胺的融合子的原生质体融合条件。通过单因素试验和正交试验,确定原生质体融合的最佳条件:PEG4000 40%、35℃、10 min,500 μL新生磷酸钙溶液,pH 7.5,此条件下融合频率达到2.67× 10-7。以青霉素和磷霉素作为筛选的遗传标记,最终获得在含有上述两种除草剂的无机盐培养基中可稳定继代培养8代以上的融合子F1。该融合子在含有100 mg·mL-1苄嘧磺隆和100 mg·mL-1丁草胺的无机盐培养基中,F1的降解率分别为65.35%和62.41%。
苄嘧磺隆;丁草胺;Rhodococcus sp.BX2;Acinetobacter sp.LYC-1;原生质体融合;条件优化
苄嘧磺隆和丁草胺是广泛用于稻田杂草防治的高效除草剂,长期使用会导致其大量沉积在土壤和水体中,破坏土壤微生物区系,降低土壤肥力,造成地下水污染[1-3]。目前,消除土壤中苄嘧磺隆和丁草胺残留污染主要依靠微生物降解。由于土壤环境中多种农药残留共存,情况纷繁复杂,从自然环境中驯化和筛选的针对苄嘧磺隆或丁草胺的土著微生物受多种环境条件限制等问题影响,存在降解谱单一或降解效率低等问题[4-6]。因此,构建同时降解苄嘧磺隆和丁草胺的工程菌对修复被其污染土壤具有重要意义。
原生质体融合技术因其具有致育性限制小、遗传物质完整传递、定向性好等优点成为构建多功能遗传工程菌株的主要手段之一。Kumari等将能够分解纤维素的Trichoderma reesei QM 9414和利用葡萄糖产酒精的S.cerevisiae NCIM 3288进行融合,得到能够将滤纸纤维素转化为酒精的融合子[7]。Zhang等利用真菌、酿酒酵母和芽孢杆菌进行原生质体融合构建一株能够有效处理制药厂污水的融合菌Xhhh[8]。田静通过原生质体融合获得一株可处理含苯二甲酸、二噁烷、乙二醇等有机污染物的化纤废水的融合菌[9]。
本研究利用原生质体融合技术筛选能同时降解苄嘧磺隆和丁草胺的融合菌株,优化原生质体融合条件,并对融合菌的降解能力进行检测,为苄嘧磺隆、丁草胺及其混剂污染土壤的生物修复提供菌株资源。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株
苄嘧磺隆高效降解菌Rhodococcus sp.BX2与丁草胺高效降解菌Acinetobacter sp.LYC-1由本实验室筛选获得并保存。BX2与LYC-1在对方的无机盐培养基中均不生长。
1.1.2 供试药剂
丁草胺(原药纯度,93%)购自山东绿邦化工有限公司;苄嘧磺隆(分析纯,96.74%)购自江苏激素研究所有限公司。
1.1.3 培养基及试剂
SMM稳定液:蔗糖171 g,MgCl2·6H2O 4.066 g,马来酸 2.321 g,pH 7.0;新生磷酸钙:KH2PO40.54 g,CaCl2·H2O 29.4 g分别溶于100 mL蒸馏水中,灭菌后等体积混合,现用现配;RNB再生培养基:蛋白胨10 g,牛肉膏5 g,酵母膏5 g,NaCl 5 g,葡萄糖2 g,蔗糖171 g,MgCl2·6H2O 4.066 g,1.5%聚乙烯吡咯烷酮(PVP-30),琼脂粉1.8%,加蒸馏水至1 000 mL,pH 7.2;苄嘧磺隆无机盐培养基:Na2HPO46.8 g,KH2PO43.0 g,NaCl 0.5 g,(NH4)2SO41.0 g,MgSO4·7H2O 0.24 g,CaCl2·2H2O 0.02 g,加蒸馏水至1 000 mL,pH 7.2;丁草胺无机盐基础培养液:K2HPO40.1 g,MgSO4·7H2O 0.2 g,FeSO4·7H2O 0.001 g,(NH4)2SO40.1 g,CaSO40.04 g,加蒸馏水至1 000 mL,pH7.2。
1.2 方法
1.2.1 菌株BX2和LYC-1抗性遗传标记的筛选
按Kirby—Baure法进行菌株BX2与LYC-1抗生素敏感性试验[10],筛选获得可满足BX2(A+B-)与LYC-1(A-B+)型抗生素,针对此类组合,设置浓度梯度进行最小浓度抑菌试验,依据结果确定研究中各抗生素的抑菌浓度。
1.2.2 原生质体制备
亲本Rhodococcus sp.BX2和Acinetobacter sp. LYC-1原生质体的制备采用文献[11-12]中的方法。
1.2.3 原生质体融合及再生
1.2.3.1 原生质体融合
将制备的亲本原生质体悬液各取1.5 mL混匀,3 000 r·min-1离心后去上清,加入0.5 mL SMM稳定液悬浮,再加入0.5 mL新生磷酸钙溶液,混匀后缓慢加入35℃预热的PEG溶液,轻轻混匀,不同温度下恒温水浴一定时间,3 000 r·min-1离心10 min弃上清,2 mL SMM洗涤沉淀,并制成1 mL的融合菌悬浮液。
1.2.3.2 原生质体的再生
原生质体的再生方式为双层平板培养法。将融合菌以双层平板培养法接种在含有一定浓度双抗生素的RNB再生培养基上,以单抗生素和无抗生素的平板为对照[13]。
1.2.4 融合菌筛选和稳定性检测
能够在含有双抗生素的再生培养基上生长的菌落即为融合菌株。将融合菌接种到同时含有双抗生素及双除草剂的固体RNB培养基平板中,30℃连续继代培养8次以上者,即为可稳定遗传生长的融合菌。将稳定融合菌分别接种在含100 mg·L-1苄嘧磺隆无机盐培养液(Ⅰ)、含100 mg·L-1丁草胺无机盐培养液(Ⅱ)、同时含100 mg·L-1苄嘧磺隆和100 mg·L-1丁草胺的无机盐培养液中(Ⅲ),能够在Ⅰ、Ⅱ、Ⅲ中均生长良好的即为目的菌株。
1.2.5 菌株BX2和LYC-1原生质体融合条件优化
分别以PEG种类:PEG4000、PEG6000;PEG作用的pH:6.5、7.0、7.5、8.0作为单因素试验组,并参考单因素对融合率的影响结果,设计3个指标,分别为PEG浓度(A)、融合温度(B)、融合时间(C),每个指标设计4个水平,即3因素4水平(见表1)。考虑各因素之间可能存在交互作用。因此,选用L16(43)正交表。所拟定的正交试验因素与水平见表2。

表1 原生质体融合影响因素Table 1 Influential factors of protoplast fusion

表2 正交试验组合表L16(43)Table 2 Combinative table of orthogonal experiment L16(43)
1.2.6 融合菌在无机盐培养基中对苄嘧磺隆与丁草胺的降解
将融合菌株、BX2与LYC-1以5%的接种量分别接种至50 mL终浓度均为100 mg·L-1的苄嘧磺隆和丁草胺无机盐培养液中,以只含除草剂但不接菌的培养液作为对照,于150 r·min-1恒温振荡培养7 d,利用液相色谱与气相色谱[7,14]分别测定苄嘧磺隆与丁草胺的残留量并计算苄嘧磺隆和丁草胺的降解率。
2 结果与分析
2.1 菌株BX2与LYC-1抗性遗传标记的筛选
菌株Rhodococcus sp.BX2对青霉素G敏感,对磷霉素不敏感;菌株Acinetobacter sp.LCY-1对磷霉素敏感对青霉素G不敏感。青霉素G与磷霉素符合抗性互补条件,选择青霉素G和磷霉素作为筛选融合菌的抗性遗传标记。青霉素G对菌株BX2的最小抑制浓度为8.33 U·mL-1,磷霉素对菌株LYC-1的最小抑制浓度为200 μg·mL-1,本研究中选择青霉素G与磷霉素的抑制浓度分别为16.67 U·mL-1和250 μg·mL-1。
2.2 菌株BX2与LYC-1原生质体融合
2.2.1 PEG与PEG作用pH对原生质体融合的影响
研究中选择温度为30℃,时间为10 min,如表3所示,在PEG4000作用下,菌株BX2与LYC-1原生质体能够融合,其中PEG4000浓度为40%时融合频率较高,为1.03×10-7;菌株BX2与LYC-1 在PEG6000作用下几乎无融合发生。

表3 PEG4000与PEG6000对原生质体融合的影响Table 3 Effects of PEG4000 and PEG6000 on fusion frequency
如图1所示,随着pH升高,菌株BX2与LYC-1原生质体融合频率呈现先升高再下降趋势,在pH 7.5时融合频率达到最大值,为1.20×10-7。
2.2.2 PEG浓度、融合温度及融合时间的正交试验
正交试验直观分析结果见表4。当某一因素某一水平对应的平均值最大,说明该水平是这个因素的最佳水平,本试验得到菌株BX2与菌株LYC-1原生质体融合的最佳组合条件为A2B3C3,即PEG4000浓度为40%、融合温度为35℃、融合时间为10 min。极差大小可反映相应因素作用的大小,极差大表明该因素是对菌株生长量影响较大的因素,3个因素对原生质体融合影响大小顺序依次为:PEG浓度>融合温度>融合时间。
正交试验直观分析法具有简便、直观、计算量小的特点,但不能估计试验误差,即不能区分试验结果的差异是由各因素的水平变化所致,还是由试验的随机波动引起,故应用SPSS 19.0统计学分析软件对正交试验进行方差分析。由表5可知,A与B的F比大于F临界值,得出PEG浓度与融合温度对原生质体融合有显著影响。经试验验证,在最佳组合条件下两菌株融合频率为2.67×10-7。
2.2.3 融合菌的初步鉴定及稳定性检测
经分离纯化后有4株菌初步认定为融合菌,分别标记为F1、F2、F3与F4。
除F3外,F1、F2与F4均可在含有16.67 U·mL-1青霉素G、250 μg·mL-1磷霉素、100 mg·L-1苄嘧磺隆和100 mg·L-1丁草胺的再生培养基上稳定继代培养8代;只有F1均能够在Ⅰ、Ⅱ和Ⅲ的无机盐培养液中生长良好,故选择融合菌F1用于相关研究。
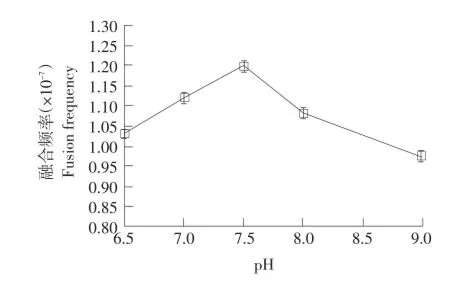
图1 PEG作用pH对原生质体融合的影响Fig.1 Effects of PEG pH on fusion frequency
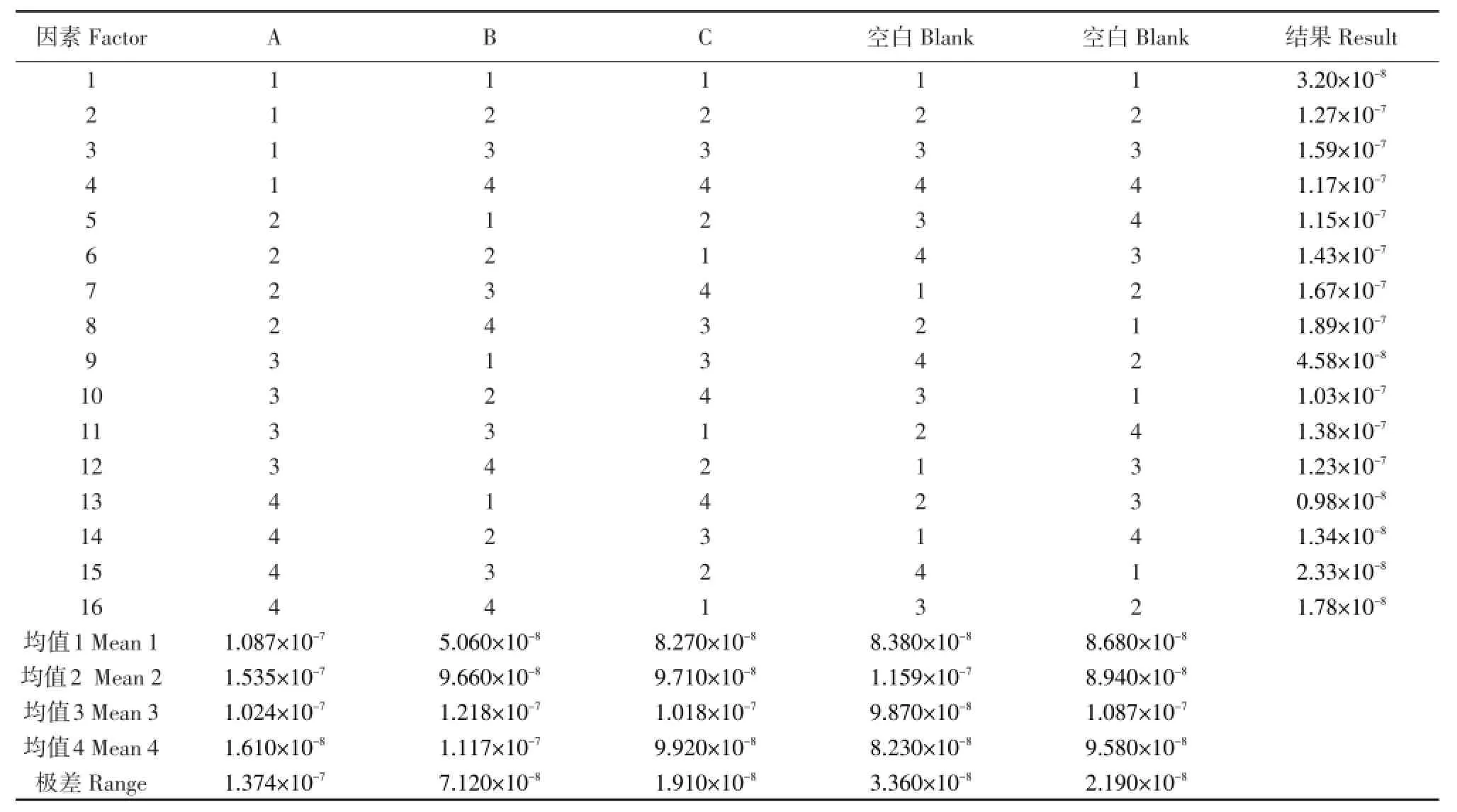
表4 原生质体融合正交试验结果及分析Table 4 Results and analysis of orthogonal experiment for protoplast fusion

表5 原生质体融合正交试验方差分析Table 5 Variance analysis of orthogonal experiment for protoplast fusion
2.3 融合菌F1的形态学观察
由图2可知,融合菌F1的形态介于两亲本之间但并不同于任一亲本菌落形态,菌落呈圆形隆起,微红、表面光滑、边缘整齐,稍干燥,不透明,易于挑取。
2.4 F1在无机盐培养液中对苄嘧磺隆与丁草胺的降解
结果见图3。
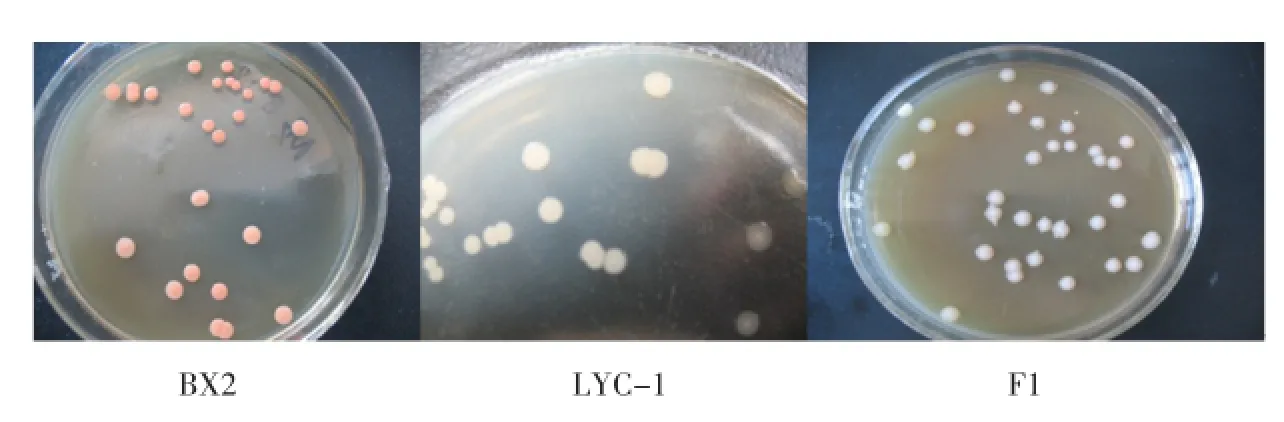
图2 两亲本及融合菌F1的菌落形态Fig.2 Colonial morphology of its parents and fusant F1
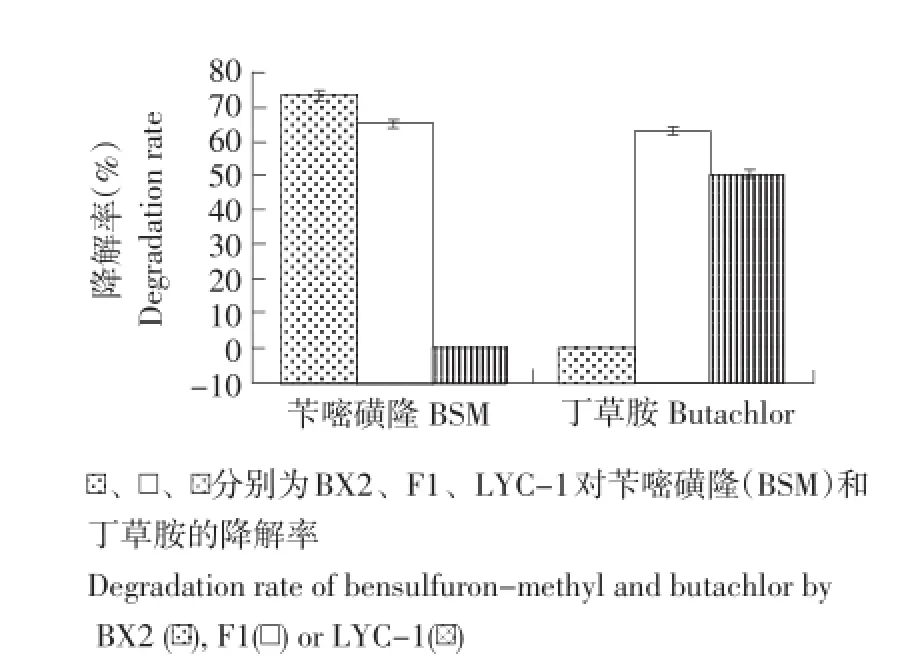
图3 苄嘧磺隆(BSM)和丁草胺(Butachlor)的降解(7 d)Fig.3 Bensulfuron-methyl and butachlor degradation(7 d)
由图3可知,融合菌F1对两种除草剂均有一定的降解能力,当培养温度34℃,pH 7.5,接种量为5%时,菌株BX2对100 mg·L-1苄嘧磺隆的降解率为73.52%;菌株LYC-对100 mg·L-1丁草胺的降解率为50.63%;融合菌F1对100 mg·L-1苄嘧磺隆与100 mg·L-1丁草胺的降解率分别为65.35%和62.41%,所有结果误差值在1.0%~1.2%。
3 讨论
苄嘧磺隆、丁草胺及其混剂是我国目前广泛用于稻田杂草防治的主要除草剂,长期使用引起严重的环境污染问题。目前,寻找只含其中一种除草剂残留的稻田几乎不可能。因此,构建同时降解苄嘧磺隆与丁草胺的融合菌更具有现实意义。
原生质体融合会受到融合方法、融合条件等因素影响,在研究中常选择PEG作为原生质体融合的促融剂。PEG可使原生质体膜电位下降,通过Ca2+离子交换而促进凝集,PEG渗透压导致的脱水作用扰乱分撒在膜表面的蛋白质和脂质排列,提高脂质胶粒的流动性,从而促进原生质体的融合[15]。在研究中,PEG4000对原生质体融合的促进作用最大,当使用PEG6000作为促融剂时几乎无融合子产生,其原因尚不清楚,可能与PEG的聚合度有关[16]。PEG常用浓度为30%~50%,PEG浓度过高会引起原生质体皱缩甚至产生中毒现象,在研究中最终选择PEG浓度为40%,该浓度能够保证原生质体活性的同时使融合效率最高。PEG作用时间也能影响融合效率,在一定时间范围内原生质体融合率是随着作用时间的延长而增加,但时间过长则会导致融合率下降,这可能是由于PEG毒害作用或是PEG使原生质体脱水失活,所以本研究中,原生体融合最佳时间选择为10 min。研究最终确定原生质体最佳融合条件为PEG4000的浓度为40%,融合时间为10 min。
原生质体融合过程中,可能发生亲株内或亲株间的原生质体融合,即产生所谓的同源或异源融合菌,这些都可能在基础培养基平板上形成菌落。菌株BX2与LYC-1形态差异较大,对抗生素耐药性不同。本研究综合使用形态学观察、抗药性标记及底物利用能力筛选融合菌,获得一株符合条件的融合菌F1。为避免苄嘧磺隆与丁草胺代谢小分子的相互影响以及萃取、检测中两种除草剂相互影响造成误差,采用分开测定的方法检测亲本与融合菌F1对苄嘧磺隆与丁草胺的降解情况。经测定,融合菌F1对苄嘧磺隆与丁草胺的降解率均在60%以上,融合菌F1对两种除草剂均有较好的降解能力。融合菌F1与两亲本相比,其对相应除草剂的降解率均低于亲本,但F1能够在同时含有这两种除草剂的环境中生长良好,而两亲本却只能在含有单一除草剂的环境中生长,在同时含有两种除草剂的环境中不能够生长,故F1与两亲本相比有更好的应用价值。
4 结论
a.通过单因素试验和正交试验,确定亲本Rhodococcussp.BX2和Acinetobactersp.LYC-1原生质体融合最佳条件为:PEG4000 pH 7.5的条件下,PEG4000浓度为40%、融合温度为35℃、融合时间为10 min、新生磷酸钙溶液0.5 mL,此条件下,融合频率达2.67×10-7。
b.以青霉素G 16.67 U·mL-1、磷霉素250 μg·mL-1作为遗传标记筛选融合菌,最终获得可在含有双抗生素、双除草剂培养基中稳定继代培养8代以上的融合菌一株,命名为F1。融合菌菌落形态特征介于两亲本之间。
c.F1以5%的接种量、34℃、培养基初始pH 7.5的条件下,在分别含100 mg·L-1苄嘧磺隆与丁草胺的无机盐基础培养液中培养7 d后,对苄嘧磺隆与丁草胺降解率分别为65.35%和62.41%。。
[1]Ayansina A D V,Oso BA.Effect of two commonly used herbicides on soil microflora at two different concentrations[J].Afr J Biotechnol,2006,5(2):129-132.
[2]Cedergreen N,Streibig J C.The toxicity of herbicides to non-target aquatic plants and algae:Assessment of predictive factors and hazard[J].Pest Manag Sci,2005,61:1152-1160.
[3]Aida M,Ikeda H,Itoh K,et al.Effects of five rice herbicides on the growth of two threatened aquatic ferns[J].Ecotoxicol Environ Safe,2006,63:463-468.
[4]Wackett L P,Bruce N C.Environmental biotechnology.Towards sustainability[J].Curr Opin Biotechnol,2000,11:229-231.
[5]Zhang S B,Zhang D Y,Luo X W,et al.Isolation and identification of a bensulfuronmethyl degradation photosynthetic bacteria and its degradationcharacteristics[J].EcolEnviron,2008,17(5):1774-1777.
[6]Chu X Q,Pang G H,Fang H,et al.Isolation,identification and characteristics of a butachlordegrading bacterium[J].J Agro-Environ Sci,2009,28:145-150.
[7]Kumari J,Panda T.Intergeneric hybridization of Trichoderma reesei QM9414 and Saccharomyces cerevisiae NCIM3288 by protoplast fusion[J].Enzyme and Microbial Technology.1994,16 (10):870-882.
[8]Zhang X X,Jia H Y,Wu B,et al.Genetic analysis of protoplast fusant Xhhh constructed for pharmaceutical wastewater treatment. [J].Bioresour Technol,2009,100:1910-1914.
[9]田静.工程菌处理高浓度化纤酯化废水的研究[D].常州:江苏工业学院,2008.
[10]杨国钊,叶红,容庭.嗜水气单胞菌生长曲线的测定及药物敏感性试验[J].畜牧兽医科技信息,2009(9):27-29.
[11]Hanson K G,Anjana J D.Intergeneric protoplast fusion between Acinetobacter sp.A3 and Pseudomonas putida DP99 for enhanced hydrocarbon degradation[J].Biotechnol Lett,1996,18:1369-1374.
[12]Feng L P,Li C Y,Xu C H,et al.Protoplast formation and regeneration of Rhodococcus sp.BX2[J].FBIE,2010(2):8-11.
[13]Chassy B M,Giuffride A.Method for the lysis of grampositive, asporogenous bacteria with lysozyme[J].Appl Environ Microbiol, 1980,39:153-158.
[14]窦阿丽,许景钢,李淑芹,等.除草剂丁草胺在东北地区主要土壤中的吸附研究[J].东北农业大学学报,2009,40(5):53-57.
[15] 郑重谊,谢达平,谭周进,等.影响微生物原生质体融合技术的因素[J].湖南农业科技,2006(4):35-38.
[16] 毛雨,王丹,黄占斌,等.微生物原生质体融合育种技术及其应用[J].中国生物工程杂志,2010,30(1):93-97.
Optimization of protoplast fusion conditions of bacteria able to de-grade bensulfuron-methyl and butachlor
LI Chunyan1,WU Zhiyang1,FENG Liping1,XIONG Minghua2,CHENGXiaosong3(1.Schoolof ResourcesandEnvironmental Sciences,Northeast Agricultural University,Harbin 150030,China;2.School of Life Science, Huaibei Normal University,Huaibei Anhui 235000,China;3.School of First Clinical Medicine, Harbin Medical University,Harbin 150001,China)
In this study,functional fusants with dual functions to simultaneously degrade bensulfuron-methyl and butachlor were constructed through protoplast fusion ofRhodococcussp.BX2 andAcinetobactersp.LYC-1.The protoplast fusion condition was optimized and finally the fusion frequency reached to 2.67×10-7under the following condition:40%of PEG4000,10 min,35℃,500 μL of freshly-prepared calcium phosphate,pH 7.5.The fusant F1 was obtained with the use of penicillin G and fosfomycin as selection markers and determined to be able to pass more than eight generations stablely on the plates containing bensulfuron-methyl and butachlor.The fusant F1 had respective high degradation rate of 65.35%BSM and 62.41%butachlor in mineral medium supplemented by BSM 100 mg·L-1and butachlor 100 mg·L-1.
bensulfuron-methyl;butachlor;Rhodococcussp.BX2;Acinetobactersp.LYC-1;protoplast fusion;optimization condition
S482;Q813.2
A
1005-9369(2014)03-0079-06
时间2014-3-21 10:06:00 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140321.1006.011.html
李春艳,吴志洋,冯丽萍,等.苄嘧磺隆和丁草胺降解菌原生质体融合条件优化[J].东北农业大学学报,2014,45(3):79-84.
Li Chunyan,Wu Zhiyang,Feng Liping,et al.Optimization of protoplast fusion conditions of bacteria able to degrade bensuluronmethyl and butachlor[J].Journal of Northeast Agricultural University,2014,45(3):79-84.(in Chinese with English abstract)
2012-12-21
国家自然科学基金项目(41271504)
李春艳(1970-),女,教授,博士,研究方向为污染环境生物修复。E-mail:chunyanli@neau.edu.cn

