响应曲面优化喜树生物碱醇提工艺研究
余响华,蒋琼凤,邵金华
湘南优势植物资源综合利用湖南省重点实验室 湖南科技学院,永州 425100
喜树(Camptotheca acuminata)又名旱莲、水栗、水桐树、旱莲子、野芭蕉等,属蓝果树科(Nyssaceae)、喜树属(Camptotheca),为我国特有植物,主要分布于长江以南地区[1]。喜树中含有显著、广谱抗肿瘤活性[2]的生物碱物质-喜树碱(camptothecin,CPT),它能够稳定拓扑异构酶I-DNA 裂解复合物,使之转变为细胞毒素DNA 的双链裂解,最终导致细胞死亡[3]。CPT 是迄今为止发现的唯一通过抑制拓扑异构酶I 发挥细胞毒性的天然植物活性成分[4]。由于喜树碱本身具有较大毒性,不能直接用于临床治疗,较为可行的是以喜树碱为前体原料,通过合成高效低毒的衍生物以获得新的抗癌药物[5]。目前美国食品和药物管理局(FDA)已批准4 种喜树碱衍生物CPT-11、TPT、9-AC、9-1NC 用于治疗结肠/直肠癌及卵巢癌[6,7],开发出的CPT 衍生物已成为继紫杉醇后的又一类重要抗癌新药。因此,对当今抗癌新药的原料药-喜树碱的研究仍具有十分重大的现实意义。
不同地区喜树中喜树碱含量差异性较大,湖南产喜树果中CPT 在0.9%左右[8,9]。本研究以湖南产喜树果为原材料,运用Design-Expert 7.0 软件,建立正交实验组,通过对实验结果的分析优化,建立了喜树碱乙醇提取的最佳工艺条件,为喜树碱的规模化生产提供实验参考。
1 材料与仪器
喜树果,2013年11 月采摘自湖南永州,根据《中国植物志》的描述,结合咨询2 位具有天然植物有效成分(药用)方面的博士(姜红宇、刘小文),鉴定为喜树果(Camptotheca acuminate fruit),晒干后4℃低温贮藏。
喜树碱标准品(纯度>98%,上海纯优生物,批号:P0281)、甲醇(色谱纯),氯仿、95%乙醇、无水乙醇、甲醇、NaOH、盐酸均为AR 级;
主要设备与仪器:粉碎机、TG21KR 离心机、日本岛津LC-10ATvP 高效液相色谱仪、Kromstar C18柱(250 mm×4.6 mm,5 μm)、予华仪器HH-WO 型旋转蒸发仪、HASUC DZF-6030 型真空干燥箱。
2 实验方法
2.1 工艺流程
干燥、粉碎→乙醇回流浸提→减压浓缩得浸膏→氯仿提取→减压浓缩→甲醇回流提取→过滤,得不溶物→NaOH 溶解→离心,收集滤液→调酸→加甲醇,保温析出→抽真空干燥→定容→HPLC 检测。
2.2 原料及提取液的处理
2.2.1 原料的前处理
将采集到的喜树果实经60 ℃低温干燥,控制水分在5%以下,粉碎过20 目筛,备用。
2.2.2 乙醇浸提流程
准确称取20.0 g 喜树果粉末,按一定的料液比加入乙醇溶液回流浸提,收集浸提液,减压浓缩得浸膏,加200 mL 氯仿震荡提取,旋转蒸发仪减压浓缩,回收氯仿,干物质经200 mL 甲醇回流提取,抽真空过滤,用50 mL 2.5 mol/L 的NaOH 震荡溶解滤渣部分,6500 rpm 离心5 min,取上清液,2.0 mol/L HCl调酸至pH 2.0~3.0,加200 mL 的甲醇震荡析出喜树碱,旋转蒸发仪60 ℃蒸发至干,加甲醇(色谱级)溶解,定容于100 mL 容量瓶中,备用,HPLC 检测。
2.3 喜树碱含量的测定
2.3.1 标品溶液配制
精确称取喜树碱标准品1.0 mg,用10 mL 色谱级甲醇溶解,配成100 mg/L 母液备用。将母液稀释成5.0、10.0、15.0、20.0、40.0 mg/L 的系列标准品溶液。
2.3.2 HPLC 条件
流动相:甲醇∶水(v/v)=60∶40;流速1.0 mL/min,检测波长254 nm[10],柱温25 ℃,进样量10μL。
2.3.3 样品喜树碱含量的测定
按上述色谱条件,吸取10 μL 样品溶液,上HPLC 仪检测。测得数据代入标准曲线回归方程,得样品喜树碱浓度,喜树碱含量按下式计算:
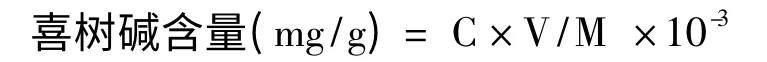
式中,C 为样品喜树碱浓度(mg/L),V 为样品定容的体积(mL),M 为称取样品质量(g)。
2.4 乙醇浸提喜树碱单因素实验
设定其它条件不变的情况下,分别考察液料比、乙醇浓度、提取温度和提取时间对喜树碱得率的影响(表1)。

表1 喜树碱乙醇提取单因素变化条件Table 1 Condition of single factor experiments for ethanol extraction
2.5 响应面实验设计
依据单因素实验结果,选取对喜树碱提取率有显著影响的3 个因素:料液比、乙醇浓度、提取时间,利用正交实验结合Design-Expert 7.0 软件分析上述3 个因索在3 个水平上对喜树碱提取效果的影响,实验设计如表所示。

表2 响应面实验因素与水平Table 2 Factors and levels of RSM experiment

图1 喜树碱标准品(A)及样品(B)HPLC 色谱图Fig.1 HPLC chromatogram of camptothecin standard (A)and sample (B)
3 结果与分析
3.1 喜树碱含量测定
将标准喜树碱溶液和分离纯化后的样品溶液上HPLC 仪器检测,所得图谱如下:
结果表明,喜树碱标准品的保留时间为7.492 min(图1A);喜树碱浓度(mg/L)X 与峰面积(uv·s)Y 的线性回归方程为:Y=16713X -20674,R=0.9994,表明喜树碱在5.0~40.0 mg/L 范围内具有良好的线形关系;样品(图1B)在7.502 min 处出峰,且与其它组分达到基线分离,证明提取物中含有喜树碱。
3.2 乙醇浸提喜树碱单因素实验结果
3.2.1 乙醇浓度对喜树碱提取效率的影响
取喜树果粉末20.0 g,按20∶1 液料比分别加入80%、85%、90%、95%、100%的乙醇40 ℃浸提2.0 h,经纯化后测定喜树碱浓度,得乙醇浓度与喜树碱含量变化曲线,如图2(A)。结果表明,提高乙醇浓度有利于喜树碱的浸出,当乙醇浓度超过90%,得率反而降低,100%时提取效率最低,仅有0.375‰。水的存在有利于喜树果粉末有效成分的溶出,提高乙醇浓度可增加喜树碱提取率,在90%时达到最大值,因此选择90 %的乙醇溶液为浸出最优浓度。
3.2.2 液料比对喜树碱提取的影响
取喜树果粉末20.0 g,按10∶1、15∶1、20∶1、25∶1、30∶1 的液料比加入90 %的乙醇40 ℃浸提2.0 h,经纯化后测定喜树碱浓度,得料液比与喜树碱含量变化曲线,如图2(B)。结果显示,随着提取溶剂用量的增加,喜树碱含量也相应提高,但增幅随溶剂用量的增加而减缓,当浓缩比超过1∶20 后,喜树碱的得率保持不变,为节省溶剂及回收溶剂的能耗,选择最佳液料比为20∶1。
3.2.3 提取温度对喜树碱提取率的影响
取喜树果粉末20.0 g,按20∶1 的液料比加入90%的乙醇,分别于20、30、40、50、60 ℃浸提2.0 h,经纯化后测定喜树碱浓度,得提取温度与喜树碱含量变化曲线,如图2(C)。
结果显示,在20~40 ℃提取范围内,随着温度升高,喜树碱得率缓慢增加,但增势不明显,仅为0.84%;40 ℃至60 ℃时则基本无变化,说明在40~60 ℃范围内,温度对提取效率影响不显著,因此喜树碱乙醇提取温度宜控制在40 ℃,后续实验不再考查温度因素。
3.2.4 提取时间对喜树碱提取率的影响
取喜树果粉末20.0 g,按20∶1 液料比加入90%的乙醇,40 ℃下分别浸提0.5、1.0、1.5、2.0、2.5 h,经纯化后测定喜树碱浓度,得提取时间与喜树碱含量变化曲线,如图2(D)。
由图可知,浸提时间对喜树碱的得率有较大影响,提取时间越长,喜树碱得率越高。考虑到提取时间过长将延长提取周期,且会增加喜树碱发生氧化概率,进而降低喜树碱提取效率,因此选择浸提时间2.0 h 为宜。


图2 乙醇浓度(A)、液料比(B)、温度(C)及时间(D)对喜树碱提取效率的影响Fig.2 Effects of ethanol concentration (A),liquid:solid ratio (B),temperature (C)and time (D)on the extraction yield of camptothecin
3.3 响应面实验结果与分析
3.3.1 响应面实验结果
对影响提取得率较大的液料比、乙醇浓度、提取时间3 因素作3 水平的响应面正交设计实验,所得结果见表3。
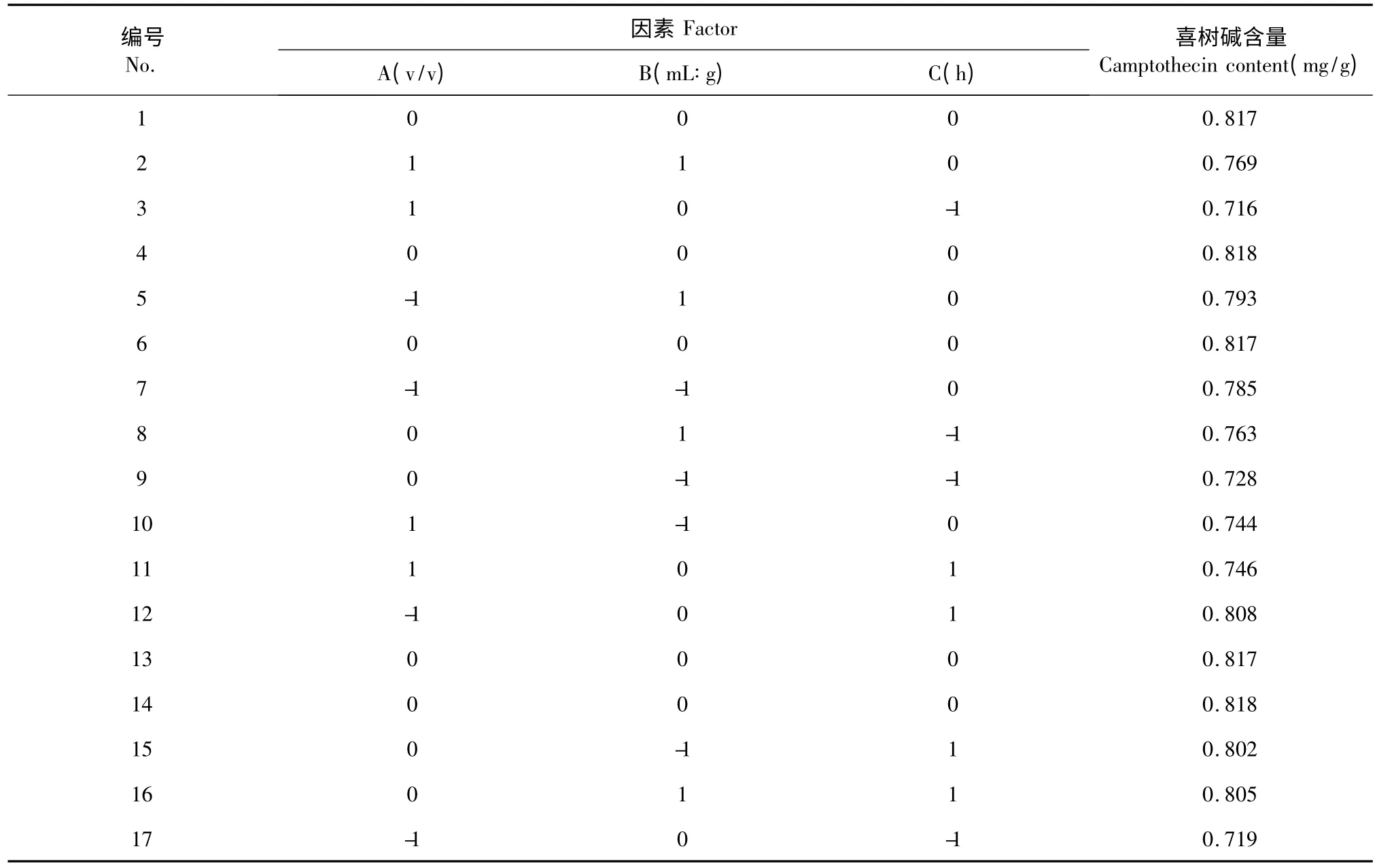
表3 响应面实验结果Table 3 Results of RSM experiments
3.3.2 模型的建立及其显著性检验
对上述实验结果进行响应曲面分析,所得方差分析如表4 所示。

表4 回归模型方差分析表Table 4 ANOVA of regresion models

利用Design-Expert 7.0 对表2 试验数据进行多元回归拟合,得到生物碱提取率(Y)对乙醇体积分数(A)、液料比(B)、时间(C)的二次多项回归模型为:Y=-12.2613+0.26399A+6.795 × 10-3B +1.20095C+1.7 ×10-4AB-5.9 ×10-3AC-3.2 ×10-3BC-1.438 × 10-3A2-3.48 × 10-4B2-0.1368C2,R2=0.9998,表明拟合情况良好,回归方程模型可行。
方差分析结果表明,各因素与响应值之间线性关系显著:回归模型F 值=87.72,P<0.0001,表明二次多元回归模型极其显著;失拟F 值=4.72,P=0.0839>0.05,模拟失拟不显著;模拟的整确定系数R2=0.9998,说明该模型拟合程度比较好,实验误差小,适合用于对喜树生物碱提取进行分析和预测。
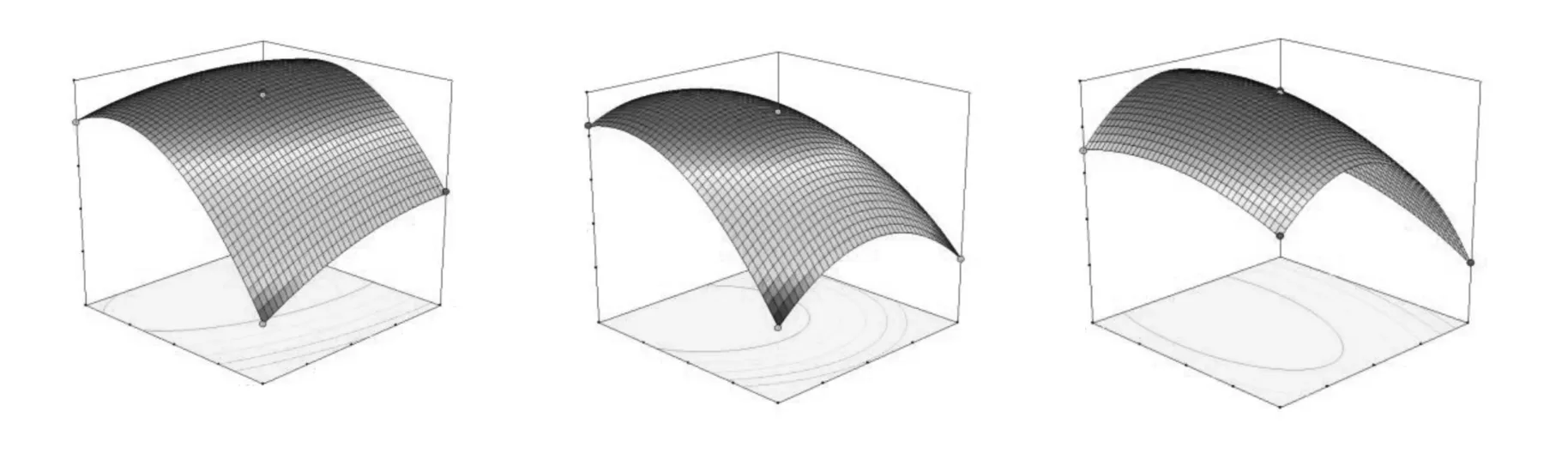
图3 3 因素交互作用对喜树碱提取率影响的响应面图(B-C、A-C、A-B)Fig.3 Response surface plots showing the cross interaction among three factors (BC,AC,AB)
图4 分别表示在固定乙醇浓度90%、液料比20∶1(mL/g)和醇提时间2.0 h 的条件下,液料比-时间(B-C)、液料比-时间(A-C)、乙醇浓度-液料比(AB)3 因素交互作用对提取率的影响。结果显示,A、B、C 三者交互作用显著。对回归方程进行一阶求导,得3 元一次方程:0.26399-0.00017B-0.0059C-0.002874A=0;0.006795-0.00017A-0.0032C-0.00696B=0;1.20095-0.0059A-0.0032B-0.2736C=0。求解方程得到最佳提取条件为:乙醇浓度88.53%,液料比21.4∶1(mL/g),时间2.23 h,按照上述条件补做验证性实验,结果显示喜树碱提取率提高至0.847 mg/g(干重),较单因素最佳提取工艺提高了3.42%,优化效果显著。
4 结论
依据单因素实验结果,采用响应面正交实验法对喜树生物碱3 个影响因素进行分析,确定最佳提取工艺为乙醇浓度88.53%,液料比21.4∶1(mL/g),时间2.23 h,此时喜树生物碱提取率可达到0.847 mg/g(干重)。本研究首次采用响应面正交实验的方法对湖南产喜树生物碱提取工艺进行了优化。本研究为实现喜树中特殊成分-喜树碱提取效率的提高,进一步开发利用喜树这一重要药用植物提供了重要的实验依据,为喜树碱的提取工艺提供了又一科学合理,准确可靠的实验数据。
1 Zhao JL(赵金良),Tang XD(唐晓丹),Yun D(运达),et al.Optimization of extraction process of camptothecin and 10-hydrxycamptothecin by orthogonal design.J Anhui Agric(安徽农业科学),2012,40:9655-9656.
2 Liu LF,Desai SD,Li TK,et al.Mechanism of action of camptothecin.Ann NY Acad Sci,2000,922:1-10.
3 Mross K,Richly H,Schleucher N,et al.A phase I clinical and pharmacokinetic study of the camptothecin glycoconjugate,BAY 38-3441,as a daily infusion in patients with advanced solid tumors.Ann Oncol,2004,15:1284-1294.
4 Hsiang YH,Liu LF,Wall ME,et al.DNA topoisomeraseⅠ-mediated DNA cleavage and cytotoxicity of camptothecin analogues.Cancer Res,1989,49:4385-4389.
5 Giovanella BC.TopoismeraseⅠInhibitors.Cancer therapeu-tics:experimental and clinical agents (B.Teicher Humana eds.),1997,137-151.
6 Wang Y(王洋),Yu T(于涛),Zhang YH(张玉红),et al.Study on extraction of camptothcin by NaOH AQ.From fruits of Camptotheca acuminata.Bull Bot Res (木本植物研究),2000,20:433-437.
7 Lorence A,Nessler CL.Camptothecin,over four decades of surprising findings.Phytochem,2004,65:2735-2749.
8 Zhang YH(张玉红).The geographical variation and seasonal changes of camptothecin in fruits of Camptotheca acuminata.J Nor East Forest Univ(东北林业大学学报),2002,30(6):44-46.
9 Wang LL(王玲丽),Liu WZ(刘文哲).Contents of camptothecin in Camptotheca acuminata from different provenances.Chin Bull Bot (植物学通报),2005,22:584-589.
10 Zhang YH(张玉红),Zu YG(祖元刚).Study on camptothecin content in leaves of Camptotheca acuminata from different regions and season.Chin Bull Bot (植物学通报),2003,20:572-575.

