黑果枸杞中花色苷的提取与结构鉴定
谭 亮,董 琦,曹静亚,耿丹丹,胡风祖
中国科学院西北高原生物研究所,西宁 810008
黑果枸杞(Lycium ruthenicum Murr.)系茄科(Solanceae)枸杞属(Lycium L.)植物[1],是西北干旱地区一种特有的多年生灌木野生植物。其耐干旱,生长于盐碱土荒地、沙地或路旁,可作为水土保持的灌木植物[2]。其果实味甘、性平、清心热,据《四部医典》中记载,藏医将其用于治疗心热病、心脏病、月经不调、停经等病症;民间用作滋补强壮、明目及降压药[3-5]。现代药理学研究表明黑果枸杞中的多糖具有抗疲劳、降血糖[6]等药理活性;黄酮类化合物具有抗氧化及其他营养保健作用等[7];原花青素具有抗氧化、抑制肿瘤等功能[8];花色苷具有抗氧化、抗突变、抑制流感病毒和疱疹病毒[9,10]等活性。其中,花色苷的药理活性及可作为天然色素的良好来源越来越备受人们的关注,测定方法已有多篇文献报道,包括有高效液相色谱法、色价法、消光系数法、pH 示差法等。然而在测定时存在的问题有:花色苷易氧化,其标准品较难获得;采用色价法、消光系数法测定时仅仅测得花色苷总量,而不能测得花色苷具体的单一组成成分;采用pH 示差法测定时多以矢车菊素-3-O-葡萄糖苷计,而事实上由试验结果可知黑果枸杞中没有矢车菊素-3-O-葡萄糖苷,这样计算结果必然造成很大误差;有采用高效液相色谱法测定黑果枸杞中的花色苷组分含量的文献报道,然而也只是测定了其中部分成分,并不全面。本文首先采用紫外-可见光谱法,通过一系列化学试验并结合全波长扫描图分析主要花色苷的结构,然后采用高效液相色谱-电喷雾串联质谱分析技术,无需对照品,在分离化合物的同时,在线提供每个花色苷类物质的紫外光谱信息、相对分子质量、分子结构碎片的质谱信息,结合文献资料分析花色苷的具体结构,可为黑果枸杞质量控制提供了一定参考,为其资源的研究与开发利用提供了科学理论依据。
1 材料与方法
1.1 材料、试剂与仪器
黑果枸杞:采自青海诺木洪农场,经中国科学院西北高原生物研究所分析测试中心胡风祖教授鉴定确认为正品。样品预处理:将收集的黑果枸杞阴干、粉碎,过40 目筛,装入密封袋中密封,置干燥器中避光保存。
Delphinidin-3-O-glucoside(飞燕草素-3-O-葡萄糖苷)(H1401,上海惠诚生物科技有限公司);Peonidin-3-O-glucoside chloride(芍药素-3-O-葡萄糖苷氯化物)(40796,Sigma);Malvin chloride(锦葵色素-3,5-二葡萄糖苷)(72815,Sigma);D-无水葡萄糖对照品(批号:110833-201205,中国药品生物制品检定所);鼠李糖对照品(批号:111683-200401,中国药品生物制品检定所)。浓盐酸(甘肃白银瑞斯物资贸易有限公司);无水乙醇、正丁醇、正丙醇、冰乙酸(天津市百世化工有限公司);氯化铝、碳酸钡(天津市光复精细化工研究所),以上化学试剂为分析纯。甲醇、乙腈(山东禹王实业有限公司化工分公司,色谱纯);实验用水为一级超纯水(18.25MΩ·cm)。
Varian Cary 300 Bio 紫外-可见分光光度仪(美国Varian 公司);Agilent 1100 Series LC/MSD Trap液相色谱-质谱联用仪,Agilent 1100 DAD 检测器(美国Agilent 公司);KQ-100E 型超声波清洗器(昆山超声仪器科技公司);AG135 电子天平(METTLER TOLEDO);RE-52AA 型旋转蒸发仪(上海亚荣生化仪器厂)。
1.2 方法
1.2.1 黑果枸杞花色苷的提取及紫外可见光谱初步分析
称取已处理好的样品粉末50 mg,精密称定,置于50 mL 棕色容量瓶中,准确加入0.1%盐酸-甲醇提取液25 mL,密塞并称定重量,在40 ℃下避光超声30 min。取出,冷却至室温,再次称定重量,用提取液补足减失的重量,摇匀,过滤,一部分滤液用Varian Cary 300 Bio 紫外-可见分光光度仪进行全波长(200~800 nm)扫描,同时进行一系列化学鉴定试验进行初步定性分析。
1.2.2 黑果枸杞花色苷预处理
按上述“1.2.1”项下内容操作,剩余滤液减压浓缩除去甲醇,所得浸膏加水悬浮后加入水饱和正丁醇萃取3 次,每次20 mL,合并萃取液,减压浓缩除去正丁醇,取4 mL 浓缩液在9000 rpm 条件下离心5 min,取上清液经0.45 μm 有机滤膜过滤,备用。
1.2.3 花色苷分离液相色谱条件
色谱柱:Spursil C18-EP 柱(250 × 4.6 mm,5 μm);流动相:A 相为乙腈;B 相为2%冰乙酸水溶液;梯度洗脱程序:0~10 min,10%~25%A;10~15 min,25%~29%A;15~35 min,29%~ 50%A;流速:0.7 mL/min;检测波长:520 nm;柱温:30 ℃;进样量:10 μL。
1.2.4 质谱条件
离子源为电喷雾电离源(ESI),正离子方式检测。采集参数如下:离子源温度为425 ℃;碰撞气为氩气,流量为0.2 mL/min;雾化气为氮气,喷雾压力为60 p.s.i;干燥气为氮气,温度为350 ℃,流量为10.0 L/min;质量扫描范围(m/z)为100~1000;毛细管电压为3500 V,电晕电流为4000 nA(Pos);源内裂解电压为1.00 Volt;扫描方式:Auto MS/MSn。
2 结果与分析
2.1 紫外-可见吸收光谱定性分析结果
2.1.1 0.1%盐酸-甲醇溶液中色素颜色
常见的6 种花色苷在0.1%盐酸-甲醇溶液中的颜色如下[11]:天竺葵色素(桔红色)、矢车菊色素(浅红色)、芍药色素(深红色)、飞燕草色素、牵牛花色素和锦葵色素(紫红色)。试验观察到黑果枸杞花色苷在0.1%盐酸-甲醇溶液中呈紫红色,表明花色苷中的主要成分可能是飞燕草色素、牵牛花色素、锦葵色素及其衍生物中的一种或几种。
2.1.2 紫外-可见吸收光谱分析
通过花色苷在0.1%盐酸-甲醇溶液中的紫外-可见光谱特性及添加试剂后光谱的变化可判断花色苷的羟基、取代基、酰基、糖苷键的位置和数量。(1)花色苷的最大吸收波长特征吸收峰一个在可见光区540 nm 附近,另一个在紫外275 nm 附近。天竺葵色素λmax为510 nm 左右,矢车菊色素和芍药色素λmax为530 nm 左右,飞燕草色素、牵牛花色素和锦葵色素λmax为540 nm 左右[11]。黑果枸杞花色苷在0.1%盐酸-甲醇溶液中的紫外-可见吸收光谱图(图1)中最大吸收波长分别为545 nm 和294 nm,表明该色素主要是飞燕草色素、牵牛花色素、锦葵色素及其衍生物中的一种或几种;(2)向上述提取溶液中加入5% AlCl3甲醇溶液数滴后放置10 min,再次测定溶液的紫外-可见吸收光谱图(图1),结果提取液对5% AlCl3甲醇溶液呈阴性反应,最大吸收波长从545 nm 略微移动到547 nm,Δλmax仅为2 nm,无明显红移现象,表明花色苷结构B 环上无邻位酚羟基[12],色素中主要含有天竺葵色素、芍药色素、锦葵色素及其衍生物中的一种或几种;(3)根据F.J.Francis 的结论[13,14],即单一花色苷(3 号位置)在0.1%盐酸-甲醇溶液中,其A440nm/Aλmax比值一般大于20;而双取代的花色苷(3、5 号位置)在0.1%盐酸-甲醇溶液中A440nm/Aλmax比值一般为十几。试验中A440nm=0.0652,A545nm=0.4533,A440nm/A545nm=14.38%<20%,表明该色素是3,5 位均带有糖苷键的双取代花色苷;(4)根据花色苷在300~330 nm范围内有无吸收峰来判断该色素分子是否含有酰基[15]。紫外-可见吸收光谱图(图1)显示花色苷在304 nm 处有最大吸收峰,表明该色素分子内含有酰基;(5)糖组成的鉴定:将部分花色苷的0.1%盐酸-甲醇提取液在避光40 ℃条件下减压蒸馏除溶剂,残留物经80 ℃烘箱干燥除水分得黑果枸杞色素固体,粉碎后移入自封袋中置干燥器中备用。该色素粉末用2.0 mol/L 盐酸溶液溶解并置沸水浴中水解1 h,加入饱和碳酸钡溶液至水解液中沉淀,离心后上清液用于硅胶板点样。于同一块硅胶H 板点样葡萄糖、鼠李糖和样品水解液,以正丙醇∶水=4∶1(v/v)为展开剂展开,用联苯胺试剂进行显色,测量板上棕色色斑的Rf值。结果Rf(葡萄糖)=0.51,Rf(鼠李糖)=0.66,Rf(样品)=0.51,可见黑果枸杞色素水解后生成了葡萄糖。
综上所述,由试验结果可初步推测出黑果枸杞色素中主要花色苷为酰基化的锦葵色素-3,5-二葡萄糖苷。

图1 黑果枸杞0.1%盐酸-甲醇提取液(A)及加入5%AlCl3甲醇溶液后提取液(B)的紫外吸收光谱图(200~800 nm)Fig.1 UV absorption spectra of 0.1% hydrochloric acidmethanol extract of L.ruthenicum (A)and L.ruthenicum extract added with 5% AlCl3-methanol solution (B)(200~800 nm)
2.2 高效液相色谱-电喷雾串联质谱结构确证结果
黑果枸杞中的花色苷成分复杂,并非单一成分,为进一步确证黑果枸杞色素提取液中具体花色苷结构,将部分提取溶液减压浓缩除去甲醇,所得浸膏加水悬浮后用水饱和正丁醇萃取后再次减压浓缩除去正丁醇后进行HPLC-ESI-MS/MS 分析(图2),通过各成分的色谱保留时间、紫外最大吸收波长并结合各成分质谱的分子离子峰和碎片离子峰与参考文献进行比对验证,鉴定出8 种花色苷,数据见表1、质谱图及结构式见图3-A~H。
具体结构分析如下:(1)峰1 在采用负离子模式进行全扫描时没有响应,在正离子模式下有分子离子峰m/z 465.2,母离子峰m/z 303.2,并存在有碎片离子峰m/z 257.2,m/z 229.2 和m/z 153.1,与参考文献[16]中的一级、二级特征离子质谱数据一致,同时与飞燕草素-3-O-葡萄糖苷标准物质在HPLC 的保留时间(RT)为12.90 min、DAD 谱图特征λmax为525 nm 和HPLC-ESI-MS/MS 响应情况一致,由以上可确证峰1 是飞燕草素-3-O-葡萄糖苷;(2)峰2 参考了文献[17]的色谱、质谱数据,由母离子峰m/z 301.2 可确定其母核是芍药素,图中只有分子离子峰m/z 463.2,而无m/z 625.2(比分子离子峰m/z 463.2 多出162),而162 是脱水六碳糖基的质量数,可见该化合物是芍药素的单糖取代物。紫外图谱λ440nm处存在一个肩峰[18],则说明C5-OH 未被取代。同时与芍药素-3-O-葡萄糖苷氯化物标准物质在HPLC 的保留时间(RT)为14.09 min、DAD谱图特征λmax为516 nm 和HPLC-ESI-MS/MS 响应情况一致,由以上可确定峰是芍药素-3-O-葡萄糖苷;(3)峰3 在采用负离子模式进行全扫描时没有响应,在正离子模式下有分子离子峰m/z479.0,母离子峰m/z 317.2,同时还存在有碎片离子峰m/z 274.2 和m/z 245.3,与参考文献[16]中化合物2 有一致的一级、二级特征离子质谱数据,确定母核是矮牵牛素。其中,母离子是由分子离子失去一个质量数为162 的中性碎片(即脱水六碳糖基)所得,根据上述“2.1.2”项下花色苷用盐酸水解后的糖中只有葡萄糖,无其他的显色斑点,可推断出该化合物是矮牵牛素的单葡萄糖取代物。紫外图谱λ440nm处无肩峰存在,则说明C5-OH 被取代,因此确定该化合物是矮牵牛素-5-O-葡萄糖苷;(4)a.峰4 的分子离子峰m/z 为933.4,其中有母离子峰m/z 479.3 和m/z 317.4,二者与峰3 的离子峰相同,说明峰4 与峰3存在相同的结构,其基本母核也是矮牵牛素。紫外图谱λ440nm处无肩峰存在,说明结构5 位连有葡萄糖;b.碎片离子峰m/z 787.4 显然是由分子离子峰失去一个质量数为146 的中性碎片所得。而紫外图谱λ310nm处有吸收峰,根据花色苷在300~330 nm 之间有无吸收峰可判断该色素分子是否有酰基。如果有吸收峰,表明该色素有酰基存在,在308~313 nm处有吸收表示酰基化的酸为对香豆酸,若在326~329 nm 有吸收则表示酰基化的酸为咖啡酸[19]。在310 nm 处有吸收峰则说明该碎片离子是与对香豆酸脱水酰化(酰化后质量数146)所得;c.碎片离子峰m/z 787.4 又与m/z 479.3 相差质量数为308,这是与芸香糖脱水缩合(缩合后质量数308)而形成,由上述可知该化合物为矮牵牛素-3-O-(6-O-对香豆酰)芸香糖苷-5-O-葡萄糖苷;(5)a.峰5 参考了文献[17]中的色谱和质谱数据由母离子峰m/z 331.1可确定其母核是锦葵色素;b.母离子峰m/z 655.2,m/z 493.2 和m/z 331.1,与参考文献[20]中的特征离子质谱数据一致,说明结构中存在有锦葵色素-3,5-二葡萄糖苷的结构;c.分子离子峰m/z 为843.1,它分别失去质量数为42 和188 的中性碎片即得碎片离子峰m/z 801.1 和m/z 655.2,这是分别与乙酸(酰化后质量数42)和对香豆酸(酰化后质量数146)脱水缩合而形成的酰基,又根据空间位阻对位优先酰化大基团,同时结合a、b 两点推断出该化合物为锦葵色素-3-O-(6-O-对香豆酰-3-O-乙酰)-3,5-二葡萄糖苷;(6)峰6 同峰1 存在有母离子峰m/z 465.2 和m/z 303.2,并存在有碎片离子峰m/z 257.2,m/z 229.1 和m/z 153.2,可说明结构中有飞燕草素-3-O-葡萄糖苷的结构。母离子峰m/z 465.2 比分子离子峰m/z 为507.2 少了质量数42,显然这是与乙酸脱水缩合形成了乙酰基,同时考虑到空间位阻对位优先酰化,推知该化合物为飞燕草素-3-O-(6-O-乙酰)葡萄糖苷;(7)a.峰7 同峰5 存在有母离子峰m/z 331.1,说明其母核是锦葵色素;b.母离子峰m/z 493.1 比m/z 655.1 少了162,这是脱水六碳糖基的质量数,而紫外图谱λ440nm处存在有肩峰,则说明C5-OH 未被取代,可见该化合物是锦葵色素的3为糖苷取代物;c.母离子峰m/z 655.1 由分子离子m/z 801.1 失去一个质量数为146 的中性碎片(即脱水对香豆酰化)所得。又根据空间位阻对位优先酰化可确定该化合物为锦葵色素-3-O-(6-O-对香豆酰)葡萄糖苷;(8)峰8 中的分子离子峰m/z 655.2,母离子峰m/z 493.2 和m/z 331.1 以及λmax为525 nm 与参考文献[20]中峰位12 物质的特征离子质谱数据和DAD 谱图特征一致,同时与锦葵色素-3,5-二葡萄糖苷标准物质在HPLC 的保留时间(RT)为25.42 min、DAD 谱图特征λmax为525 nm 和HPLCESI-MS/MS 响应情况一致,由以上可确证峰8 是锦葵色素-3,5-二葡萄糖苷。
在正离子模式下,各组分在质谱中的主要离子峰的质荷比(m/z)见表1 和图3。由试验数据可知:(1)质谱图3-C~H 中均存在有质荷比(m/z)比分子离子[M+H]+多出36.5 的离子峰,这应该与提取液中含有Cl-(由HCl 产生)离子有关,而Cl-离子一般是正价苯基苯并的抗衡阴离子,以平衡原正电荷使总体达到电中性,从而增加其稳定性;(2)图中存在有比母离子峰质荷比(m/z)少18 和28 的离子峰,这是各组分离子峰继续脱H2O 和脱CO 形成的;(3)在图3-A~H 的中还可看到一些质荷比最小的碎片离子峰依次如下:153.1、151.2、167.2、167.2、181.3、153.2、181.1、181.1。这些碎片离子峰的形成是由于在源内CID 情况下花色苷C-环发生0/2位C-C 键断裂而形成的0,2A+·自由基正离子。
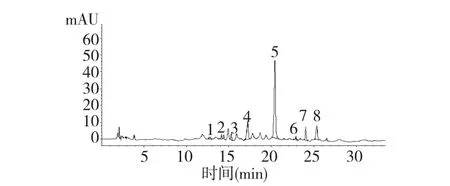
图2 黑果枸杞花色苷高效液相色谱图Fig.2 HPLC-DAD chromatogram of anthocyanins in L.ruthenicum

表1 高效液相色谱-电喷雾串联质谱联用检测黑果枸杞中花色苷结果Table 1 HPLC-ESI-MS/MS of anthocyanins in L.ruthenicum
2.3 黑果枸杞中花色苷的计算问题
以往在采用pH 示差法测定样品中花色苷时,常以矢车菊素-3-O-葡萄糖苷计来计算样品中花色苷的浓度,而由试验结果可知黑果枸杞中并非含有矢车菊素-3-O-葡萄糖苷,所以采用这种计算方法计算黑枸杞中花色苷的含量必然会引起结果误差。由液相分析黑果枸杞中含有8 种花色苷,按面积归一化法计算得最主要的花色苷是锦葵色素-3-O-(6-O-对香豆酰-3-O-乙酰)-5-O-二葡萄糖苷(68.35%)(表1),并且锦葵色素的单糖苷、二糖苷取代物含量之和占总花色苷的77.93%。由此可知在按pH 示差法计算黑枸杞中花色苷含量时应代入锦葵色素单糖苷、二糖苷取代物的平均分子量及二者平均消光系数到计算公式中,结果更准确。
3 结论
本研究通过采用紫外-可见光谱法并结合高效液相色谱-电喷雾串联质谱对黑果枸杞中花色苷组成及结构进行了鉴定。用0.1%盐酸-甲醇溶液超声提取黑果枸杞中的花色苷,取适量在紫外分光光度仪上全波长扫描进行初步光谱鉴定;再取适量减压浓缩除去甲醇,所得浸膏加水悬浮后再用水饱和的正丁醇萃取,采用高效液相色谱-电喷雾串联质谱进行最终的结构确证。经紫外分光光度法、质谱和文献报道综合分析鉴定出黑果枸杞中含有8 种花色苷,分别是:飞燕草素-3-O-葡萄糖苷、芍药素-3-O-葡萄糖苷、矮牵牛素-5-O-葡萄糖苷、矮牵牛素-3-O-(6-O-对香豆酰)芸香糖苷-5-O-葡萄糖苷、锦葵色素-3-O-(6-O-对香豆酰-3-O-乙酰)-5-O-二葡萄糖苷、飞燕草素-3-O-(6-O-乙酰)葡萄糖苷、锦葵色素-3-O-(6-O-对香豆酰)葡萄糖苷和锦葵色素-3,5-二葡萄糖苷。花色苷是黑果枸杞中重要的组成成分,该试验可为黑果枸杞的质量控制提供依据。
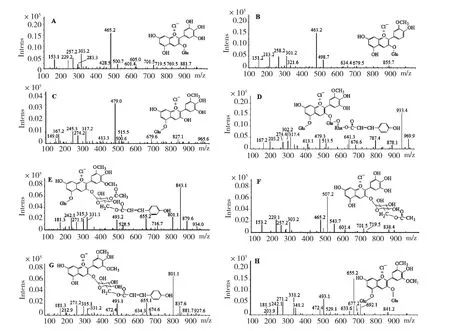
图3 黑果枸杞中各花色苷质谱图(A~H 分别与图2 中峰1~8 相对应)Fig.3 MS spectra of anthocyanins in L.ruthenicum (A to H was corresponding to peak 1-8 in Fig.2)
1 Peng Q(彭强),Bai XF(白雪芳),Du YG(杜昱光).Research progress of polysaccharides from Lycium ruthenicum Murr.Acad Period Farm Prod Proces(农产品加工.学刊),2010,12:77-79.
2 Flora of China Editorial Committee of Chinese Academy of Sciences(中国科学院中国植物志编辑委员会).Flora of China(中国植物志).Beijing:Science Press,1999.61,10.
3 Gan QM(甘青梅).Preliminary investigation on Tibeten Medicinal Herb.Chin Tradit Herbal Drugs(中草药),2001,32:371-373.
4 Gan QM(甘青梅),Luo GF(骆桂法),Li PY(李普衍),et al.The study of Tibeten drug Lycium ruthenicum Murr.in development and utilization.Qinghai Sci Technol(青海科技),1997,4:17-19.
5 Chen HK(陈海魁),Pu LK(蒲凌奎),Cao JM(曹君迈),et al.Current research status and exploitation of Lycium ruthenicum Murr.Heilongjiang Agric Sci(黑龙江农业科学),2008,12:155-157.
6 Feng W(冯薇),He EP(何恩鹏),Chen XQ(陈晓琴).Study on the effect of Lycium ruthenicum Murr.fruit polysaccharide on the athletic ability of mice and the dose-effect.Arid Zone Res(干旱区研究),2009,26:586-590.
7 Li J(李进),Li SZ(李淑珍),Feng WJ(冯文娟),et al.In vitro antioxidant and free radical scavenging activities of total flavonoids from the leaves of Lycium ruthenicum Murr.Food Sci(食品科学),2011,31:259-262.
8 Li FY(李凤英),Cui RJ(崔蕊静),Li CH(李春华).Microwave-assisted extraction of procyanidin by from grape seed.Food Ferment Ind(食品与发酵工业),2005,31:39-42.
9 Bai HJ(白红进),Wang HB(王河滨),Luo F(罗锋).Study on extracting and scavenging activity against DPPH free radical of pigment from Lycium ruthenicum Murr.Acta Agr Boreali-Occid Sin(西北农业学报),2007,16:190-192.
10 Yu D(于东),Chen GX(陈桂星),Fang ZX(方忠祥),et al.Advances on extraction,isolation,purification and identification of anthocyanins.Food Ferment Ind(食品与发酵工业),2009,35:127-132.
11 Ma ZC(马自超),Pang SZ(庞世珍).Natural Food Coloring Chemicals and Production Technology(天然食用色素化学及生产工艺学).Beijing:China Forestry Press,1994.39-92.
12 Hendry GAF,Houghtor JD.Natural Food Colorants.London:Springer,1992.227.
13 Jiang NS(江南生),Yan RR(严日仁),Tang BL(唐本琏).Identification of red pigment of roselle.Food Ferment Ind(食品与发酵工业),1990,3:18-23.
14 Hong V,Wrolstad RE.Use of HPLC separation/photodiode array detection for characterization of anthocyanins.J Agric Food Chem,1990,36:708-715.
15 Tang CH(唐传核).Bioactive Components from Plants(植物生物活性物质).Beijing:Chemical Industry Press,2005.218-248.
16 Yuan S(袁帅),Yao SJ(姚胜军),Geng Y(耿昱),et al.Identification of anthocyanins and flavonols in extract of blueberry by using HPLC-ESI-MS/MS.Acta Chim Sin(化学学报),2009,67:318-322.
17 Haibo W,Edward JR,Anil J,et al.Characterization of anthocyanins in grape juices by ion trap liquid chromatography mass spectrometry.J Agric Food Chem,2003,51:1839-1844.
18 Harborne JB.Spectral methods of characterizing anthocyanins.Biochem,1958,70:22-29.
19 Escribano-Bailón MT,Santos-Buelga C,Rivas-Gonzalo J C.Anthocyanins in cereals.J Chromatogr A,2004,1054:129-141.
20 Ji M(季梅),Li Q(李强),Lou HX(娄红祥).HPLC-DADMS-MS determination of anthocyanins in red grape skin.Chin J Pharm Anal(药物分析杂志),2011,31:2240-2243.
21 Liang ZC,Wua BH,Fan PG,et al.Anthocyanin composition and content in grape berry skin in Vitis germplasm.Food Chem,2008,111:837-844.

