小干扰RNA沉默瘦素揭示了瘦素在大鼠肝纤维化中的作用
薛秀兰 邢玉刚 吴晓鹭 刘家俊
(1厦门大学附属第一医院感染科,厦门361000;2江苏省昆山市中医院内科 昆山215300)
肝纤维化是各种慢性肝病发展为肝硬化必经的病理过程。它由肝星状细胞(HSC)被激活后转化为肌成纤维母细胞((MFB),大量合成细胞外基质(ECM),后者的沉积大于降解而形成。瘦素(leptin)是由ob基因(位于人类染色体7q32)编码的一种167个氨基酸组成的分泌型蛋白质,具有广泛的生物学效应。leptin与受体结合后,通过Janus家族酪氨酸激酶/信号转导与转录激活因子(JAK/STAT,其中主要是JAK/STAT 3)通道和增强TGFβ1及α1Ⅰ型胶原的基因表达[1]发挥作用。最新的实验研究表明,leptin作为新的肝纤维化形成因子,其机制研究已越来越引起人们的关注[2,3]。但瘦素在肝硬化发展中的具体作用尚未明确。本实验采用RNA干扰技术[4]针对leptin特意靶位点的小干扰RNA(small interfering RNA,siRNA)处理大鼠肝硬化模型,探讨siRNA抑制leptin基因对大鼠肝硬化的影响,为进一步以leptin为靶点的基因治疗提供理论依据。
材料和方法
1.材料
1.1 实验动物 健康纯种SD雌性大鼠,体质量200-230g,SPF级,由厦门大学动物实验中心提供,饲料由厦门大学动物实验中心提供。
1.2 试剂与仪器 脂质体Lipofectmine 2000及 Trizol Reagent:美国Invitrogen公司产品;UNIQ大剂量质粒抽提试剂盒:上海Sangon公司产品;RT-PCR引物由上海生工公司合成。PTPCR二步法试剂盒:北京百泰克公司产品。限制性内切酶Bbs I、Ase I、T4DNA连接酶、高保真Taq酶 Pyrobest、d NTPs(d ATP、d TTP、d GTP、d CTP的混合物)、DNA片段回收试剂盒以及质粒纯化试剂盒均购自Takara公司;M-MLV逆转录酶、RNasin(RNA酶抑制剂)购自Promega公司。真核表达载体psiRNA-h H1neo kit购自Invitrogen公司。HRP标记的羊抗兔IgG购自华美公司。TGFβ1一抗和leptin、STAT3一抗购自 Promega公司,αSMA 一抗和 desmin、collagenⅠ、NF-KB 一抗购自Santa Cruz公司凝胶成像系统为BIO-RAD公司Quantity One系统。彩色病理图文分析系统为OLYMPUS-DP70系统。
2.实验方法
2.1 质粒制备 采用本课题组构建的leptinsiRNA/pcDNA3.1(+)真核细胞表达质粒,通过测序,证实构建成功。采用上海生工公司质粒大量抽提试剂盒(方法详见说明)行质粒大量制备。经酶切及电泳证实抽出质粒,用分光光度计测定浓度,经计算符合所需量。
2.2 模型制备 重组质粒导入60只大鼠随机分为4组:正常对照组(N组,n=15),以正常饮食喂养;肝纤维化组(CCl4组,n=15);leptin-siRNA质粒转染组(CCl4(+)L组,n=15);质粒空载体对照组(CCl4(+)K组,n=15)。采用四氯化碳复合法制备肝纤维化动物模型。采用脂质体包埋法分别将leptin-siRNA重组质粒及pcDNA3.1(+)质粒各100ug通过腹腔注射导入大鼠肝纤维化模型。L组采用leptin-siRNApcDNA3.1(+)质粒;空质粒对照组给予pcDNA3.1(+)质粒。同时正常对照组和肝纤维化组腹腔注射0.9% 的生理盐水。每9天1次至第12周,共注射7次。注射前各组重组质粒均按比例与脂质体Lipofectmine 2000混匀。
2.3 HE染色 于实验第12周末,以10%水合氯醛腹腔注射麻醉,解剖各组大鼠,取出肝脏组织,各留取少许肝组织放入10%甲醛溶液中固定,制4um石蜡切片,进行 HE染色、苦味酸/酸性品红染色(VG)和免疫组织化学染色,其余肝组织投入液氮中快速冷冻后再置入-70℃冰箱保存备用。采用VG染色观察肝组织病理形态学变化:进行肝纤维化的病理形态学分级,分级标准参照2000年《病毒性肝炎防治方案》中关于组织病理学诊断标准中建议的病理学诊断分级标准[6]。
2.4 半定量RT-PCR 采用一步法提取肝组织总RNA,并用紫外分光光度计行RNA浓度及纯度测定。采用二步法RT-PCR试剂盒对肝组织总RNA进行扩增。leptin引物序列::Upstream:5'-GTGCCTATCCACAAAGTCCAGGATG-3 ';Downstream: 5 '-GCATTCAGGGCTAAGGTCCAACTG T-3',扩增片段长度为438bp。GDPDH:Upstream 5’-TCACCACCATGGAGAAGG-3’;Downstream 5’-TGGGAGTTGCTGTTGAAG-3’,扩增片段长度为550bp。加入反应体系中的RNA和引物的量每组均相同,按照试剂盒说明书行二步法RT-PCR:第一步将总RNA逆转录为cDNA;第二步行PCR反应。Leptin、β-actin退火温度分别为58℃、63℃、58℃,扩增35个循环后扩增产物行2%琼脂糖凝胶电泳(见图1)并以Bio-rad Quantity One凝胶成像系统测定各条带的灰度值进行定量分析,用β-actin作为内参校正上样量,以相应区带的灰度值相对于内参对照组的倍数表示(A值)。
2.5 Western blot 将保存-70℃ 冰箱中的各组标本取出,加入9倍体积的0.86% 冷生理盐水,用玻璃研磨器研磨提取组织蛋白,加入蛋白上样缓冲液后于沸水中煮沸约8min,冷却后-70℃冻存备用。在ESDS-PAGE凝胶中进行电泳分离,湿转法将蛋白转至NC膜上,室温封闭1h,加入I型胶原一抗,以1∶1000浓度孵育过夜,洗膜后加入相应的山羊抗兔HRP标记的二抗,工作浓度为1∶1000,室温孵育1h,洗膜后加入显色剂,X线胶片曝光后观察结果(图2),用凝胶成像系统(Bio-rad Quantity One测定曝光后条带的灰度值,用β-actin作为内参校正上样量,以相应区带的灰度值相对于内参对照组的倍数表示(A值)。
3.统计学方法
所有结果用平均数±标准差表示,采用SPSS13.0软件分析实验数据。多组间的差异比较采用F检验。两组间的比较用t检验。等级资料病理形态学分级结果作Ridit分析,P<0.05为统计学有意义。
结 果
1.肝组织病理结果
实验过程中正常对照组无大鼠死亡,空质粒对照组及肝纤维化组各死亡2只和1只,leptin-siRNA治疗组死亡3只。根据VG染色结果,对各实验动物肝组织切片进行肝纤维化的病理形态学分级,leptin-siRNA治疗组与肝硬化组和空载体组比较,肝纤维化病理学分级有显著性差异(P<0.05,表1,图1-4)
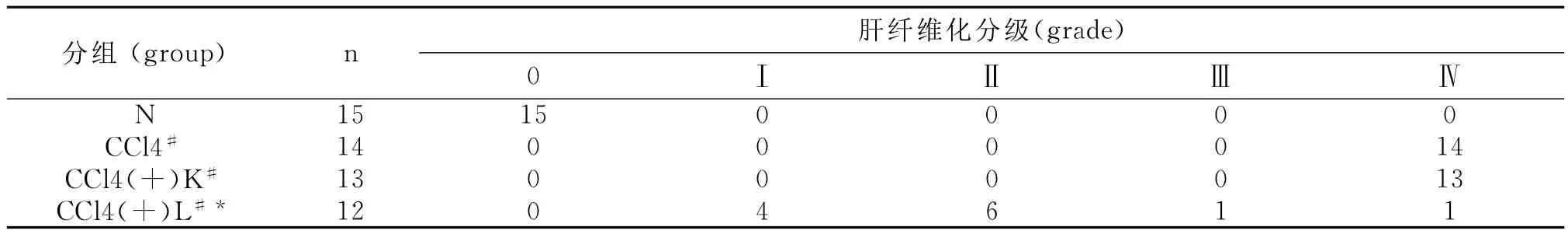
表1 各组动物肝组织纤维化病理分级Table 1 The pathology classification of liver fibrosis of rats
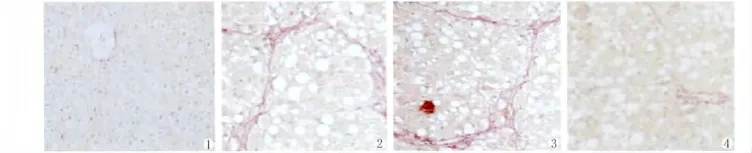
图1 N(正常对照组);图2 肝纤维化组(cd4组)图3 质粒空载体对照组(CCl4(+)K组);图4 leptin-siRNA质粒转染组(CCl4(+)L组)Fig.1 normal control group(N group,VG staining of liver)Fig.2 liver fibrosis group(CCl4 group,VG staining of liver)Fig.3 empty vector group(CGl4(+)K,VG staining of liver)Fig.4 leptin-siRNA group(CCl4(+)L,VG staining of liver)
2.RT-PCR结果
RT-PCR结果显示:与对照组比,肝纤维化组(CCl4)和质粒空载体组(CCl4(+)K)leptin-mRNA含量明显增高;与肝纤维化组(CCl4)和质粒空载体组(CCl4(+)K)比,leptin-siRNA 转染组可沉默leptin mRNA的表达(P<0.05,图5)。

图5 各实验组动物肝组织Leptin mRNA表达 N:正常对照组;CCl4:肝纤维化组;CCl4(+)K:空质粒对照组;CCl4(+)L:leptin-siRNA组;M:DNA markerFig.5 The expression of leptin m RNA in rats liver N:normal group;CCl4:liver fibrosis group;CCl4(+)K:pcDNA3.1(+)plasmid control group;CCl4(+)L :leptin-siRNA group;M:DNA marker
3.Western blot结果
Western blot结果显示leptin-siRNA重组质粒治疗组leptin值小于肝纤维化组(CCl4)和质粒空载体组(CCl4(+)K)(P<0.05,表2),collagen type I和STAT3蛋白条带亮度均明显低于肝纤维化组(CCl4)和质粒空载体组(CCl4(+)K)(P<0.05,图6)。以上实验室均用GAPDH作内参照,重复三次,实验结果相似。
表2 Western blot法检测各试验组动物肝组织leptin的表达(±s)Table 2 The expression of leptin protein of liver fibrosis of rats by Western blot(±s)

表2 Western blot法检测各试验组动物肝组织leptin的表达(±s)Table 2 The expression of leptin protein of liver fibrosis of rats by Western blot(±s)
与正常对照组相比,#P<0.05;与空质粒组、肝纤维化组相比,*P<0.05。#P<0.05,compared with the normal control group;*P<0.05,compared with the empty vector group,liver fibrosis group.
组别(group) 例数(N) leptin(A值)N 15 134.17621±8.125 CCl4# 14 210.3113±6.412 CCl4(+)K# 13 198.4123±5.124 CCl4(+)L#* 12 160.1241±10.123合计 Asymp.Sig.<0.05 54 Chi-Square=48.124 df=5
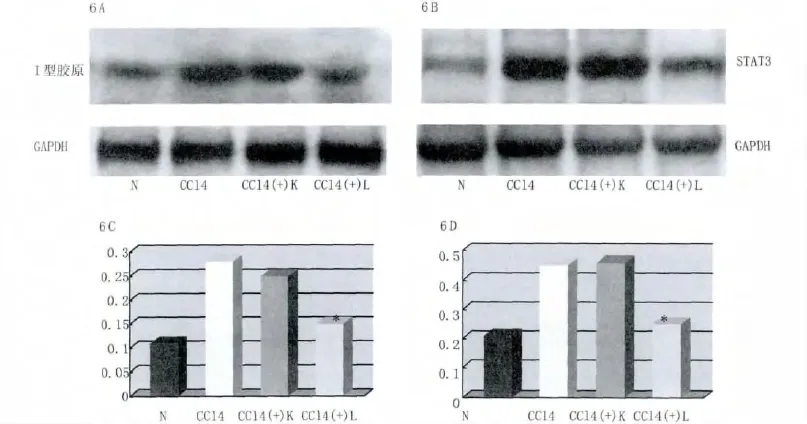
图6 leptin-siRNA抑制I型胶原和STAT3蛋白表达。Western blot法检测各试验组动物肝组织I型胶原(6A)和STAT3(6B)的表达。使用灰度比值法测定I型胶原(6C)和STAT3(6D)的表达。与空质粒组、肝纤维化组相比,*P<0.05。Fig.6 leptin-siRNA inhibits type I collagen and STAT3 protein.Western blots performed using antidodies recognising I collagen(6A)and STAT3(6B)are shown..The ratio of type I collagen(6C)and STAT3(6D)was determined using band densitometry.Result show mean±SE of the three independent studies。*P<0.05 relative to negative control siRNA.
讨 论
肝纤维化发生的主要机制是细胞外基质(extracellular matrix,ECM)合成与降解失衡,导致ECM在肝内过量沉积。肝硬化目前虽尚无有效药物可将其逆转甚至治愈,但目前证实肝纤维化是可逆的过程[7]。参与肝纤维化的形成与发展的过程中涉及多种信号转导通路及细胞因子[8]。近年来发现leptin在多种组织如胃、肾、肝等都有表达[9,10]。有研究发现,硫乙醇胺(thioacetamide,TAA)诱导大鼠肝纤维化模型中,体内活化的肝星状细胞均可以表达瘦素,,而且瘦素可增加肝纤维化和前胶原稳态mRNA的表达。leptin信号传导主要涉及JAK2/STAT3 来 调 控 靶 基 因 转 录[11]。RNA 干 扰(RNAi)是用来有目的地关闭特定基因的表达。具有自我扩增性,能够在细胞间传代,甚至将效应传到下一代,是封闭靶基因的最佳选择。
研究应用RNAi干扰技术,针对leptin构建leptin-siRNA/pcDNA3.1(+)真核细胞表达质粒并将其转染 HSC-T6(hepatic stellate cell,HSC)细胞株,结果显示leptin-siRNA/pc DNA3.1(+)真核表达质粒构建成功,外源性leptin基因可有效转染HSC,并使leptin mRNA和蛋白表达水平显著提高,HSC的分化及增殖减少[12]。之后制备肝硬化模型鼠并重组质粒导入导入各组模型中,肝组织病理显示)肝纤维化程度减轻,纤维化程度多为Ⅰ-Ⅱ级;Westerblot实验结果显示leptin-siRNA导入组的leptin、I型胶原和STAT3蛋白量同空载体对照组和肝纤维化组相比明显下降。RT-PCR结果也证实leptin-siRNA导入组的leptin的mRNA同空载体对照组和肝纤维化组相比明显降低。上述结果提示leptin-siRNA导入可抑制leptin、I型胶原和STAT3蛋白表达。
Leptin-siRNA导入肝纤维化鼠体内后,leptin、STAT3蛋白和mRNA表达明显降低,其原因可能是leptin-siRNA导入大鼠体内后,通过Ob-R配体与Ob-Rb结合,通过JAK2/STAT3信号转导系统,从而调节leptin基因的转录。本实验检测STAT3含量减少,JAK2/STAT3信号转导,使转导蛋白表达降低,目的基因leptin转录也减少。Karen和Bjorbaek等[13,14]采用免疫沉淀、细胞培养、Weston Blot发现leptin可以刺激信号转导相关蛋白p-STAT3和leptin在中枢和卵巢等外周组织的表达,从而增加肝纤维化。另外肝纤维化时ECM过多沉积,其中胶原是最重要的ECM,肝脏胶原以I、III型为主。当Leptin-siRNA导入肝纤维化鼠体内后,I型胶原含量明显抑制,可有效增强对ECM的降解能力,使沉积相对减少,肝纤维化得以在一定程度上逆转。
总之,leptin在肝纤维化发展中起到重要的促进作用,利用RNA干扰技术将leptin-siRNA导入肝纤维化的鼠体内阻断了JAK2/STAT信号通路所致,降低leptin蛋白表达,减轻肝纤维化,为以lepin为靶点的肝纤维化的基因治疗提供理论依据。
[1]Henriksen JH,Holst JJ,Moller S,et al.Increased cir-culating leptin in alcoholic cirrhosis:relation to release and disposal.Hepatology,1999,29(6):1818-1824
[2]Anania FA.Leptin,liver,and obese mice-fibrosis in the fat lane.Hepatology,2002,36(1):246-248
[3]Marra F.Leptin and liver fibrosis:a matter of fat.Gastroenterology,2002,122(5):1529-1532
[4]Paddison PJ,Caudy AA,Hannon GJ.Stable suppression of gene expression by RNAi in mammalian cells.Proc Natl Acad Sci USA,2002,99(3):1443-1448
[5]薛秀兰,林菊生,宋玉虎.靶向leptin基因的siRNA对大鼠肝星状细胞生物学特性的影响.华中科技大学学报(医学版),2006,35(3):331-335
[6]中华医学会传染病与寄生虫病学分会、肝病学分会联合修订.病毒性肝炎防治方案.中华内科杂志,2001,40(1):62-688
[7]Fridman SL.The cellular basis of hepatic fibrosis.mechanism and treatment strategies.N Engl J Med,1993,328:1828-1835
[8]Fridman SL.liver fibrosis-from bench to bedside.J Hepatal,2003,38:S38-35
[9]Anania FA.Leptin,liver,and obese mice-fibrosis in tne fat lane.Hepatology,2002,36:246-248
[10]Marra F.Leptin and liver fibrosis;a matter of fat.Gastroenterology,2002,122:1529-1532
[11]Ahima RS,Flier JS.leptin.Annu Rev Physiol,2000,62(1):413-437
[12]Bjorback C,Elmquist JK,Frantz JD,et al.Identificatio of SOCS3 as a potential mediatior of central leptin resistance.Mol Cell,1998,1:619-265
[13]Karen C,McCowen,Jesse C.Leptin signaling in tne hypothalamus of normal rats in Vivo.Endocrinology,1998,139:4442-4447
[14]Bjorback C,Elmquist JK,Frantz JD,et al.Identificatio of SOCS3 as a potential mediatior of central leptin resistance.Mol Cell,1998,1:619-265

